乙型肝炎病毒反转录酶区恩替卡韦耐药位点突变分析*
2022-02-19张宏宇申红玉郑国军
张宏宇,申红玉,郑国军
江苏省常州市第三人民医院检验科,江苏常州 213001
近年来,恩替卡韦(ETV)作为一种强效、耐药基因屏障高的药物,广泛应用于慢性乙型肝炎(CHB)患者的抗病毒治疗中[1],ETV在病毒学、组织学和生物化学改善方面的效果优于拉米夫定(LAM)和阿德福韦酯(ADV)。《慢性乙型肝炎防治指南(2019年版)》[2]按照“强效低耐药”的原则推荐将ETV、富马酸替诺福韦酯(TDF)和丙酚替诺福韦(TAF)作为CHB防治一线药物,非一线药物比如LAM、替比夫定(LdT)和ADV不再推荐使用。同时,指南进一步建议如果原来使用的药物是LAM和LdT,即使病毒控制得很好也建议调整治疗,原来应用这些药物没有出现耐药的患者建议换用低耐药药物治疗[2]。
但患者长期使用核苷(酸)类似物(NAs)进行抗病毒治疗会使乙型肝炎病毒(HBV)逆转录酶区一个或多个位点发生突变,即可导致机体对药物的敏感性下降甚至产生耐药[3-4],致使抗病毒治疗失败。目前,关于ETV耐药的报道相对较少,在初治CHB患者中,ETV治疗5年的累积耐药发生率为1.2%[5],但在治疗过程中,特别是ETV治疗其他NAs耐药的患者易出现病毒学突破等再耐药现象[6]。有研究回顾性分析了2009—2016年7年间该院收治的12 515例进行HBV耐药性检测的患者,结果显示2016年该院ETV的耐药突变发生率在17.1%[7],随着经济发展和社会进步,药物可及性已经得到了很大的改善,部分患者特别是ETV用于治疗LAM或ADV耐药的患者更易发生ETV耐药的现象[8]。分别ETV耐药比例不断升高,成为不容忽视的问题,对于这类患者有必要分析了解其耐药突变特征,为临床规范抗病毒治疗提供参考。
本研究回顾性分析本院HBV P基因测序ETV耐药位点阳性患者资料,以期了解本地区HBV耐药突变特征,为后期临床规范抗病毒治疗提供参考。
1 资料与方法
1.1一般资料 选取2010年7月至2020年12月在本院就诊并进行HBV P区耐药测序的慢性HBV感染患者7 886例为研究对象,所有患者均接受NAs单药或序贯治疗,经HBV-DNA定量检测>500 copy/mL,排除甲、丙、丁、戊、庚型肝炎和HIV合并感染者1 878例,剩余6 008例,所有诊断均符《慢性乙型肝炎防治指南(2019年版)》[2]相关标准。
1.2方法
1.2.1P区耐药测序 采用QIAamp DNA提取试剂盒(德国Qiagen公司)提取血清中HBV-DNA,美国伯乐公司试剂扩增DNA,反应条件为95 ℃ 5 min后,95 ℃ 10 s、56 ℃ 20 s、72 ℃ 30 s,共40个循环,取扩增标本产物2~4 μL进行1.5%琼脂糖凝胶电泳鉴定扩增产物,目的条带大小约为500 bp,参考Marker条带,如目的条带亮度大于Marker最弱的条带,则认为扩增成功,可进行下一步纯化测序工作。如无肉眼可见目的条带或目的条带亮度低于Marker最弱的条带,则需进行巢式PCR扩增。巢式PCR第一轮扩增引物序列如下,F:5′-ACTGTATTCCCATCCCATCAT-3′;R:5′-TTCGTTGACATACTTTCCAATCA-3′)。第二轮扩增引物序列如下,F:5′-CTTGACATACTTTCCAATCAA-3′;R:5′-AAGGTATGTTGCCCGTTTGT-3′。PCR产物纯化扩增产物后,采用ABI3100测序仪对其测序。所有操作严格按照试剂盒说明进行。
1.2.2ETV 耐药性变异的判断 本研究ETV耐药位点变异判断标准为在LAM耐药的基础上(M204I/V和L180M变异),再加上至少1个ETV耐药位点[T184、S202 和(或)M250]的变异[9]。
1.2.3临床实验室检测 HBV-DNA检测采用中山大学达安基因股份有限公司的DNA提取试剂盒,在RocheLightCycler480仪器进行PCR扩增检测,HBV-DNA结果以<500 copy/mL为阴性;乙型肝炎e抗原(HBeAg)检测采用郑州安图生物公司磁微粒化学发光法试剂,在全自动化学发光测定仪AutoLumo A2000上进行检测;血清肝脏酶学指标丙氨酸氨基转移酶(ALT),天门冬氨酸氨基转移酶(AST)的检测采用迈克公司试剂在日立7600生化仪器上进行检测,所有操作严格按照仪器与试剂说明书进行。

2 结 果
2.1ETV耐药位点阳性患者的一般资料 筛选出ETV耐药位点阳性的患者228例,占比3.8%(228/6 008),男185例,女43例,平均年龄(51.25±11.25)岁,ALT水平为(97.2±146.1)U/L,AST水平为(64.3±93.9)U/L,HBeAg阳性率为47.37%(108/228),HBV-DNA载量为(6.63±0.12)copy/mL。ETV耐药位点阳性率从2010年的0.67%逐年上升,到2016年达到峰值6.81%,2017-2019年有一定下降的趋势,2020年阳性率又上升至5.96%,但送检病例也有一定数量的减少。见表1。
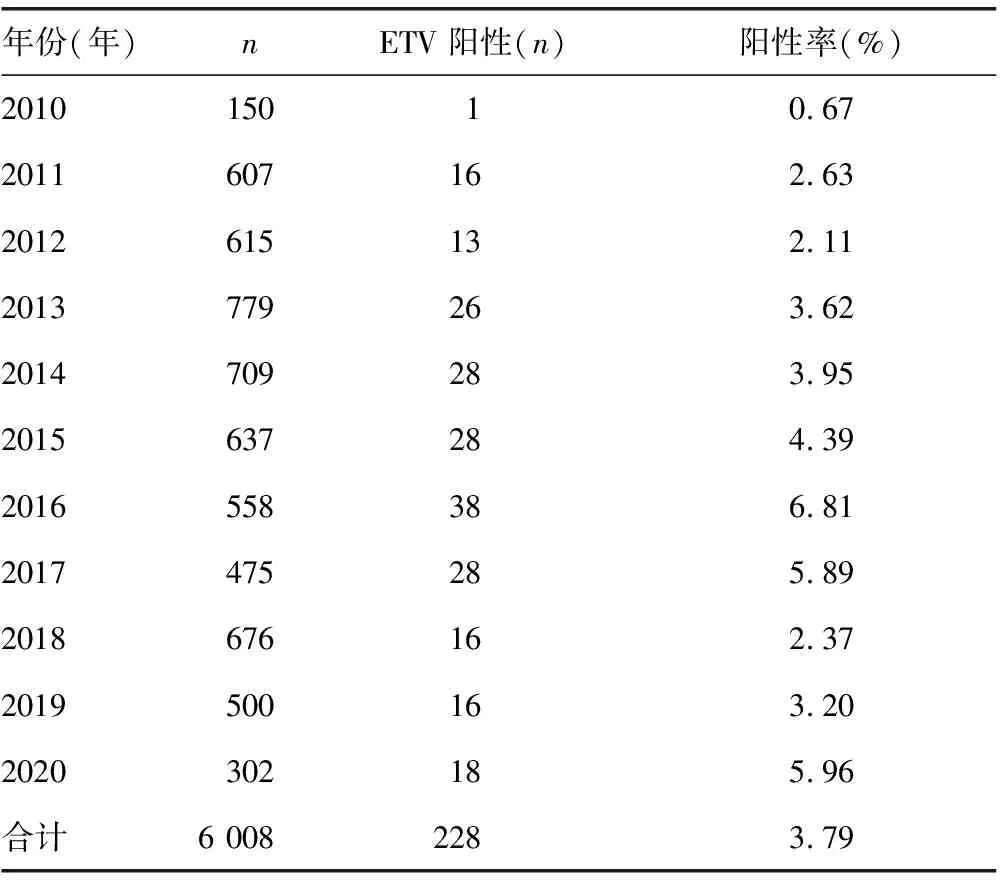
表1 2010—2020年HBV P区耐药测序情况及ETV耐药位点阳性分布情况
2.2临床主要NAs的使用情况 考虑ETV耐药率可能与药物使用情况有关,本研究分析了LAM、LdT、ADV、TDF这4类主要NAs的使用情况(因LAM和LdT属于同一类药物,故归为一组;因系统升级,未能查阅到2010年药物的使用情况,但不影响整体趋势)。2011—2014年低耐药屏障的LAM、LdT和ADV为主要使用的抗病毒药物,2014—2016年维持一定使用量,2016年后使用量明显下降;高耐药屏障药物ETV在2014年后使用量明显增加,2017开始高耐药屏障药物ETV和TDF使用量全面超过低耐药屏障药物;2014年以来,ETV一直是用量最多的药物。见图1。
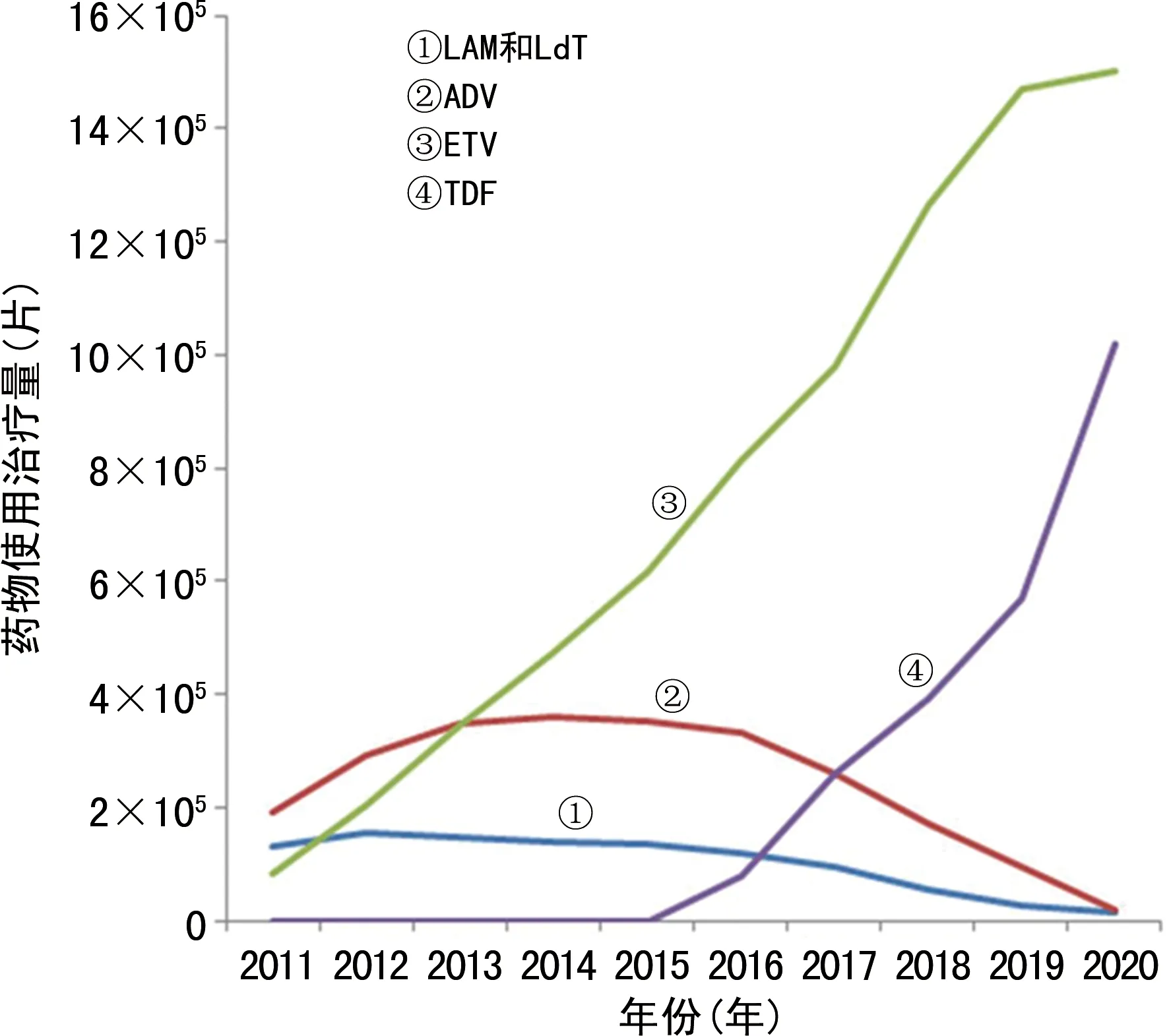
图1 2011—2020年临床主要NAs的使用情况
2.3ETV基因型突变模式分析 rtL180M+M204V+S202G和rtL180M+M204V+T184A(G/I/S/L)突变最为常见,分别占42.54%和28.51%;ETV突变模式主要表现为rtL180M+M204V伴随rtS202G或rtT184A(G/I/S/L)突变,M204I突变相对较少,其中rtL180M+M204I/V合并S202G突变者110例,rtL180M+M204I/V合并rtT184A(G/I/S/L)突变者81例。见表2。
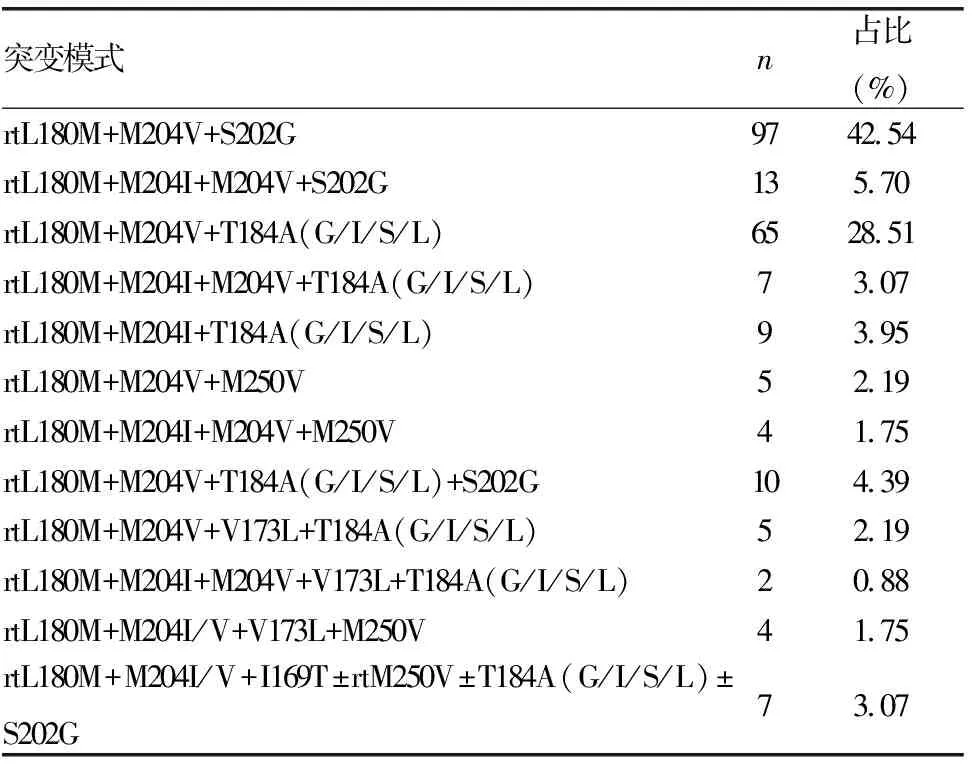
表2 ETV基因型耐药模式分析
2.4ETV主要耐药基因突变模式与临床特征的关系 鉴于ETV主要突变模式为rtL180M+M204I/V合并rtS202G或rtT184A(G/I/S/L),本研究对这两种耐药突变模式患者的一些常见实验室特征如HBeAg阳性率,HBV-DNA,ALT,AST等进行了比较,结果发现rtL180M+M204I/V合并rtT184A(G/I/S/L)突变模式患者HBeAg阳性率,HBV-DNA,ALT,AST等平均值略高于rtL180M+M204I/V合并rtS202G突变患者,但差异无统计学意义(P>0.05)。见表3。
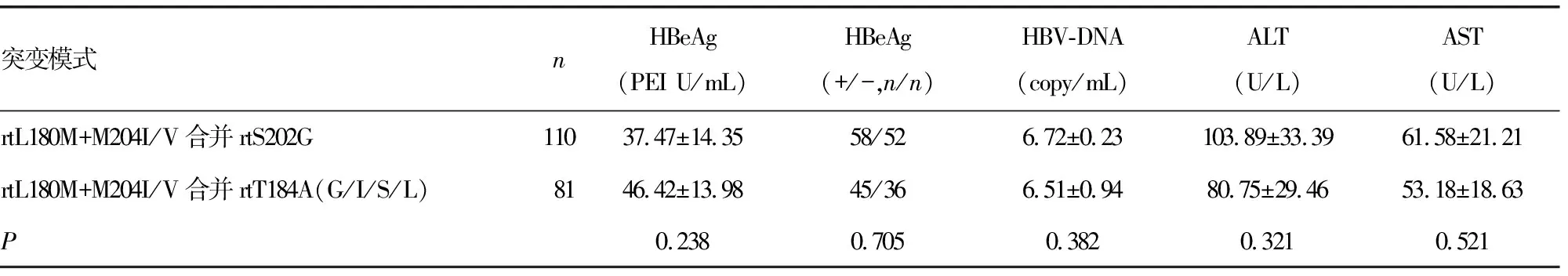
表3 ETV主要耐药突变模式临床实验室特征对比分析
3 讨 论
采用ETV治疗可强效抑制病毒复制,改善肝脏炎症,安全性较好,长期治疗可改善CHB肝硬化患者的组织学病变,降低肝硬化并发症和肝细胞癌发生率,降低肝脏相关和全因病死率。有研究表明,长期口服ETV或TDF的CHB患者,8年生存率为94.1%[10]。因此抗病毒治疗对CHB患者改善生活质量,延长生存时间至关重要。
目前,长期应用NAs进行抗病毒治疗的CHB患者体内病毒在这种药物压力筛选中更易发生突变而导致治疗失败[9]。有研究报道,在初治CHB患者中,ETV治疗5年的累积耐药发生率为1.2%,在LAM耐药的CHB患者中,ETV治疗5年的累积耐药发生率提升至51.0%[5]。多项研究显示,接受长期ETV或其他NAs治疗的CHB患者转换至TAF治疗后,病毒学抑制及肾功能得到显著改善[11-12]。充分了解本地区HBV耐药突变模式及相关临床症状对于调整用药及新耐药位点预测非常重要。
本研究回顾性分析了近11年来本院进行HBV P区耐药测序的6 008例患者,筛选出ETV耐药位点阳性患者共228例,占比3.8%(228/6 008),与之前报道的在初治CHB患者中,ETV治疗5年的累积耐药发生率为1.2%,在LAM耐药的CHB患者中,ETV治疗5年的累积耐药发生率提升至51.0%[5]存在差异,出现这种情况的原因考虑与本研究入组人群有关,虽然本研究多数为经治患者,但用药史不祥,有很多是LAM或LdT经治患者,可能会引发ETV累积耐药,也有很多为ADV经治患者,稀释了本底系数,且故本研究ETV耐药位点阳性率在1.2%~51.0%。分析从2010—2020年每年的ETV耐药位点阳性率,从2010年的0.67%逐年上升,到2016年达到峰值6.81%,与我国学者回顾性分析结果显示ETV的耐药突变发生率在2016年上升至17.1%的趋势基本一致[7],考虑与本研究时间跨度较长,多数患者为LAM或LdT经治累积耐药筛选有关;而2017-2019年又有逐渐下降的趋势,可能与后期ETV、TDF等高耐药基因屏障药物大量使用有关,分析这些年的药物使用情况,2017年开始,高耐药屏障药物ETV,TDF的使用量全面超过低耐药屏障药物。但在2020年,耐药率却又进一步升高至5.96%,出现这种情况可能是高耐药屏障药物的使用导致耐药人数减少,送检病例减少所致,也可能与长期大量高耐药屏障药物使用导致新耐药的产生有关,需进一步研究探索。
分析ETV耐药突变模式,结果显示rtT184A(G/I/S/L)和rtS202G是ETV耐药相关的最常见变异位点,而rtM250V位点变异较为少见,与之前相关报道一致[13-14];ETV耐药基因屏障的打破有赖于rtL180M+M204V/I的存在,本研究显示大部分ETV耐药发生在rtM204V的基础上,rtM204I相对较少,与相关研究基本一致[9],这可能是因为rtM204I突变株仍保留了对ETV较高的敏感性[13];由于ETV耐药突变经常发生在LAM或LdT经治基础上,rtM204I是LAM和LdT的主要变异形式,因此,有学者推测,在ETV耐药突变筛选过程中可能存在rtL180M+M204I 突变向rtL180M+M204V突变转换的过程[14]。有研究表明发生rtT184A/G/I/S基因突变患者的肝脏炎症状况比发生rtS202G/I突变的患者更为严重,且更易进展为肝硬化[15],本研究结果则显示两种突变模式的疾病严重程度无明显差异,与之前研究不同的原因可能与纳入患者临床分期不明确所致,仍需进一步观察研究。
本研究对本院近11年CHB患者的ETV耐药位点阳性进行回顾性分析,若有患者的用药史会更加完整,但由于时间跨度较长,且大部分患者为门诊病例,用药史、依从性不一,资料追踪难度较大,无用药情况说明,预存耐药情况不明。但作为中国东部地区长期的ETV耐药位点阳性患者的回顾性分析,本研究对于了解HBV变异情况、预后判断及换药治疗具有一定的指导意义。
