酸枣仁对失眠大鼠HPA轴功能的干预作用研究△
2022-02-18花玥郭盛朱悦朱昭颖谢红陶伟伟段金廒
花玥,郭盛,2*,朱悦,朱昭颖,谢红,陶伟伟,段金廒*
1.南京中医药大学 中药资源产业化与方剂创新药物国家地方联合工程研究中心/江苏省中药资源产业化过程协同创新中心/国家中医药管理局中药资源循环利用重点研究室,江苏 南京 210023
2.中国中药协会 药食同源物质评价和利用专业委员会,北京 100061
酸枣仁为鼠李科植物酸枣Ziziphus jujubaMill.var.spinosa(Bunge)Hu ex H.F.Chou 的干燥成熟种子,具有养心补肝、宁心安神、敛汗、生津之功,常用于虚烦不眠、惊悸多梦、体虚多汗、津伤口渴等证的治疗,是中医临床治疗失眠症的常用药味[1-2]。临床多以苯二氮䓬类药物治疗失眠,长期服用易出现成瘾性、戒断性等不良反应[3],而酸枣仁作为中医临床治疗失眠的药食同源类中药具有安全有效的优势[4]。现代研究表明,酸枣仁养心安神功效确切,其含有的黄酮类[2]、三萜皂苷类[5]、生物碱类[6]及脂肪酸类等[1]化学成分,均表现出一定防治失眠的作用,但其作用机制有待进一步研究。
现代研究表明,失眠症的发生发展多与下丘脑-垂体-肾上腺(HPA)轴功能紊乱、中枢神经递质失衡、炎性反应因子释放、迷走神经张力变化、褪黑素系统功能下降、边缘皮质系统环路功能或结构异常等密切相关[7-8]。其中,应激是导致失眠的重要原因,HPA轴过度兴奋和亢进,可表现出促觉醒作用,通过调节HPA 轴功能可改善睡眠状态从而达到治疗失眠症的效果[9]。因此,调节HPA 轴功能亢进已成为近年来治疗失眠障碍的新靶标[10]。
本研究选择腹腔注射对氯苯丙氨酸(PCPA)复制失眠大鼠模型,在前期考察酸枣仁提取物改善模型动物记忆及认知功能,并调控其内源性代谢网络及肠道菌群结构的基础上[10],选择与HPA 轴功能相关的调节因子,包括下丘脑分泌的促肾上皮质激素释放激素(CRH)、垂体分泌的促肾上腺皮质激素(ACTH)、肾上腺分泌的皮质酮(CORT)为主要评价指标,结合动物行为、病理组织及生化指标分析等,评价酸枣仁对HPA 轴的干预作用,进而探讨其防治失眠症的作用机制。
1 材料
1.1 实验动物
无特定病原体(SPF)级雄性SD 大鼠30只,体质量180~220 g,2 月龄,由上海斯莱克实验动物有限责任公司提供,许可证号:SCXK(沪)2017-0005,合格证编号:20170005010252。本实验经南京中医药大学动物伦理委员会批准(伦理学审查批号:201905A029),动物接收后饲养在屏障系统内,适应性喂养1周,每笼3只,自由进食、进水。
1.2 药物与试剂
酸枣仁饮片(批号:8017002)产自河北邢台,由南京中医药大学段金廒教授鉴定,为鼠李科植物酸枣Ziziphus jujubaMill.var.spinosa(Bunge)Hu ex H.F.Chou的干燥成熟种子。
PCPA(上海麦克林生化科技有限公司,批号:C10438621);地西泮片(上海上药信谊药厂有限公司,批号:14181201);戊巴比妥钠(中国医药集团上海化学试剂公司,批号:060222);聚山梨酯-80(Tween-80,批号:20130703,成都市科龙化工试剂厂);羧甲基纤维素钠(批号:20191203,天津市科密欧化学试剂有限公司);4%多聚甲醛(批号:70085400,中国Biosharp公司)。
苏木精-伊红(HE)染液试剂盒、免疫组化笔、柠檬酸钠缓冲液(江苏凯基生物技术股份有限公司);蛋白质定量试剂盒(BCA)、磷酸盐缓冲液(PBS,批号:GA19120085310)均购自北京索莱宝科技有限公司);中性树胶、二甲苯、甲醇、乙醇(国药集团化学试剂有限公司);MaxVision 试剂盒(兔)、二氨基联苯胺(DAB)显色试剂盒、耐高温塑料染色架(福州迈新生物科技有限公司);苏木精染色液(南京建成生物工程研究所);大鼠血清白细胞介素-1β(ⅠL-1β)、肿瘤坏死因子-α(TNF-α)、CRH、ACTH、CORT、5-羟色胺(5-HT)酶联免疫吸附测定法(ELⅠSA)试剂盒及一氧化氮(NO)试剂盒(南京建成生物工程研究所);大鼠组织CRH、ACTH、CORT酶联免疫检测试剂盒(上海酶联生物科技有限公司)。
1.3 仪器
R-250 型旋转蒸发仪(瑞士Buchi 公司);ML204、MS105 型电子分析天平(上海Mettler-Toledo 仪器有限公司);XO25-12DT 型超声波清洗机(南京先欧仪器制造有限公司);Tissuelyser-48型全自动样品快速研磨仪(上海净信科技);VX-Ⅱ型多管涡旋振荡器(北京踏锦科技有限公司);Microfuge 22R Centrifuge 型高速离心机(美国Beckman Coulter 公司);ST60-4 型微孔板恒温振荡器(美国Thermo Fisher Scientific 公司);EnSpire 型酶标仪(美国PerkinElmer 公司);Direct-Q5 纯水制备仪(美国Millipore 公司);DigBehv 型动物分析系统(上海吉量软件科技有限公司);THZ-312型台式恒温振荡器(上海精宏实验设备有限公司);101AS-3型电热鼓风干燥箱(上海圣欣科学仪器有限公司);BCD-258A/C型冰箱(海尔公司);BX43型生物倒置显微镜(日本Olympus 公司);E200A 型万分之一电子分析天平(德安特公司)。
2 方法
2.1 供试药物的制备
本实验采用笔者前期开展酸枣仁提取物改善模型动物记忆及认知功能实验用样品[11],其制备方法为将酸枣仁粉碎成粗粉(过二号筛),加2.5 倍量石油醚浸泡1 h 后,回流提取2 次,每次2 h,滤过。滤渣置通风橱挥干溶剂,得灰白色脱脂药渣,加8倍量70%乙醇回流提取2 次,每次2 h,滤过,合并滤液,60 ℃减压浓缩至生药质量浓度4 g·mL-1,得到酸枣仁醇提物。供试药物均置于-20 ℃冰箱中备用,临用时稀释至所需剂量。
2.2 动物分组与模型制备
随机将30 只大鼠分为5 组,每组6 只,分别为正常组、模型组、地西泮阳性药组、酸枣仁醇提物高剂量组、酸枣仁醇提物低剂量组。除正常组外,各组大鼠参照文献[12-13]方法腹腔注射PCPA 混悬液(350 mg·kg-1·d-1,含0.1% Tween-80 的0.9%氯化钠溶液配制),正常组腹腔注射等剂量的0.9%氯化钠溶液,体积均为10 mL·kg-1体质量,每天1 次,连续3 d。
2.3 动物给药
造模同期给药,地西泮阳性药组(1 mg·kg-1·d-1)、酸枣仁醇提物高剂量组(20 g·kg-1·d-1)、酸枣仁醇提物低剂量组(5 g·kg-1·d-1)均灌胃对应的药物,共给药10 d。正常组和模型组灌胃等剂量的水,给药体积均为10 mL·kg-1。
2.4 旷场实验
给药10 d后,检测大鼠在旷场环境的活动情况,测试前将动物放入测试房间内30 min,以适应环境。测试时轻轻提起尾巴,头朝前将大鼠放入旷场中使其自由活动。旷场规格为40 cm×40 cm,侧壁高40 cm,箱体内部为黑色。DigBehv 型动物分析系统拍摄记录大鼠5 min内的活动轨迹,检测大鼠在旷场内活动的总路程,中心区域滞留时间及爬壁情况,用于评价动物焦虑样行为[14]。
2.5 标本的采集及处理
旷场实验结束后禁食12 h,腹腔注射2%戊巴比妥钠(40 mg·kg-1,0.9%氯化钠溶液配制)进行麻醉。腹主动脉采集血液于负压管中,静置30 min,699.3×g离心10 min,分取上层血清,置于-80 ℃冰箱中保存,用于血清生化指标测定[15]。取血后,迅速摘取下丘脑、垂体、肾上腺组织,每组取部分置于4%多聚甲醛组织固定液中,用于组织病理分析,剩余用于组织生化指标测定。
2.6 HPA轴功能分析
2.6.1组织病理分析 对固定在4%多聚甲醛中的下丘脑、垂体、肾上腺组织进行HE染色。经无水乙醇脱水,二甲苯透明后,将组织浸入石蜡中包埋,切片烤片,石蜡切片脱蜡,经苏木精、伊红染色封片后,于400×光学显微镜下观察组织形态,每个组织取3 个区域拍照,用ⅠmageJ 1.8.0 软件统计每组400×图片中所有染色细胞的数量,观察不同组织细胞数量在给药前后的变化。
2.6.2ELⅠSA 分析HPA 轴激素水平 根据ELⅠSA试剂盒说明书记载的操作方法,测定各组大鼠血清中HPA轴激素(CRH、ACTH、CORT)的含量。称取适量组织(下丘脑、垂体、肾上腺)于1.5 mL 离心管中,加入锆珠和一定量的PBS(pH 7.2~7.4),使用全自动样品快速研磨仪充分匀浆后,离心取上清液,得10%组织匀浆液。采用BCA 试剂盒测定匀浆液蛋白浓度,并按照相应ELⅠSA 试剂盒的操作说明,分别测定大鼠组织下丘脑中的CRH、垂体中的ACTH 及肾上腺中的CORT 含量,并以蛋白浓度校正。
2.7 血清ⅠL-1β、TNF-α、NO水平分析
根据试剂盒说明书描述的操作方法,ELⅠSA 测定各组大鼠血清中ⅠL-1β、TNF-α水平;按NO 试剂盒说明书方法测定血清中NO的含量。
2.8 统计学分析
3 结果
3.1 模型验证结果
造模最后一天禁食12 h后,眼眶取血分取血清,用ELⅠSA 试剂盒测定5-HT 含量。5-HT 是公认参与睡眠-觉醒机制的神经递质,而PCPA 是5-HT 拮抗剂,腹腔注射PCPA 能造成昼夜节律消失,以复制失眠模型。与正常组比较,模型组大鼠血清中5-HT的含量显著降低,说明模型复制成功[16-17](图1)。
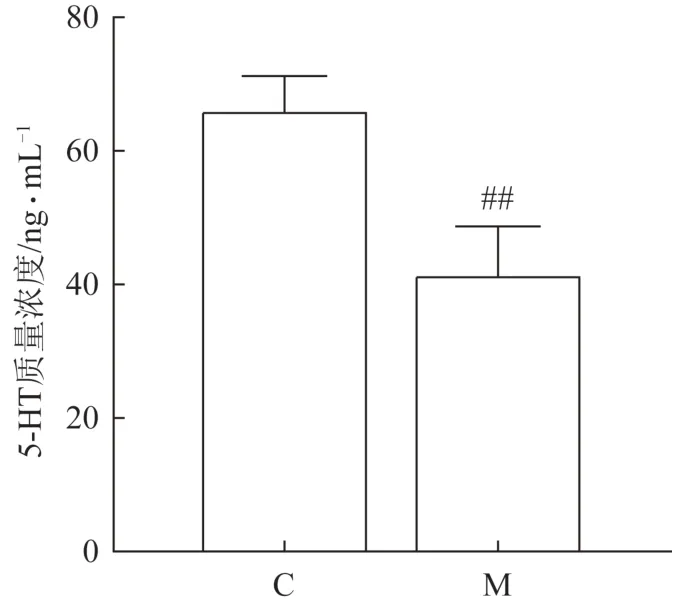
图1 正常组与模型组大鼠血清中的5-HT含量(,n=6)
3.2 酸枣仁对大鼠行为的影响
与正常组比较,模型组大鼠昼夜节律消失,毛发粗糙无光泽、对刺激敏感、兴奋且攻击性强等行为,表明失眠模型复制成功。末次给药后,对失眠大鼠进行旷场实验,选择动物旷场内活动总路程、中心区域时间和爬壁情况作为评价指标,其中总路程反映大鼠的运动情况,中央区域时间反映大鼠的焦虑情况;爬壁反映大鼠的探究行为。如图2 所示,在本实验中,模型组大鼠总路程、中心时间及爬壁均较正常组减少(P<0.05),给药酸枣仁提取物后,上述指标均有不同程度回归正常水平的趋势。上述结果表明失眠大鼠有一定的焦虑状表现,给药酸枣仁提取物可以改善这些症状。
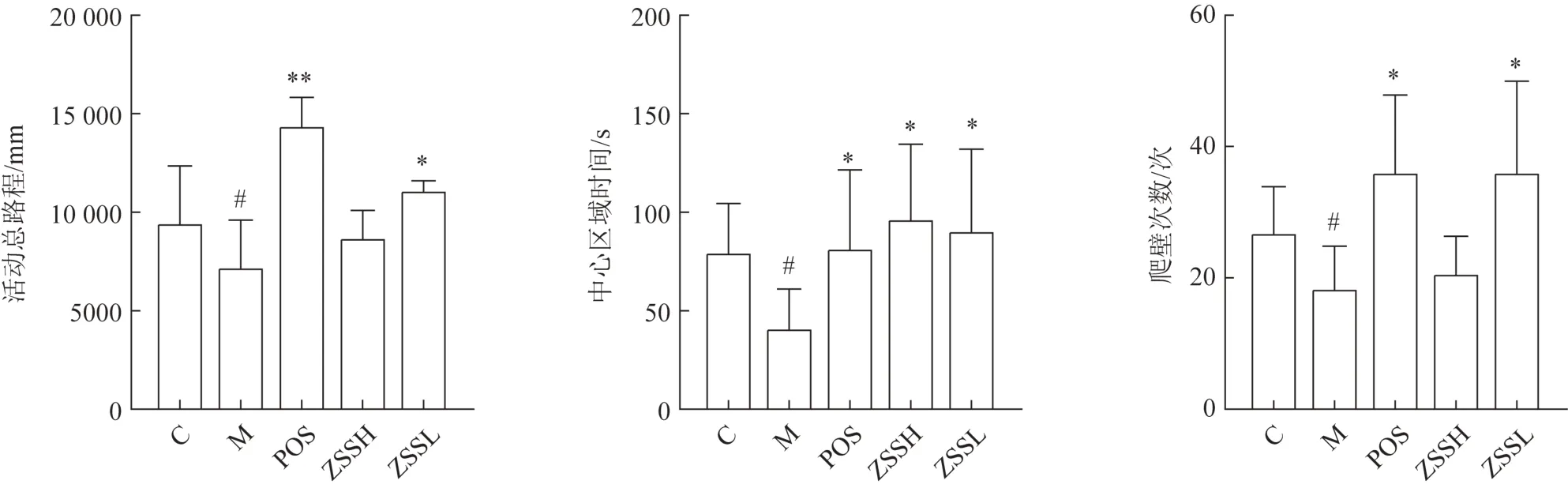
图2 酸枣仁对失眠模型大鼠旷场实验活动总路程、中心区域时间和爬壁情况的影响(,n=6)
3.3 酸枣仁对HPA轴功能的影响
3.3.1酸枣仁对HPA 轴组织病理变化的影响 HE染色结果如图3 所示,与正常组比较,模型组大鼠下丘脑中神经元数量减少但差异无统计学意义,而各给药组均有一定程度的回调(图4)。模型大鼠垂体中嗜色细胞数量较正常组明显减少,与正常组相比差异有统计学意义,取而代之的是细胞质较少、苏木精着色浅、细胞边界不清的嫌色细胞,提示模型动物垂体发生病理改变。给药酸枣仁后,组织病理改变出现回调,酸枣仁醇提物高、低剂量组细胞数量均回调且差异有统计学意义。模型组大鼠肾上腺中束状带和网状带细胞均出现体积变大、呈圆形、核染色变浅、核仁清晰可见的病理改变,提示细胞代偿性增大,肾上腺分泌功能增强,且造模后细胞数量与正常组相比显著减少。酸枣仁给药组对肾上腺的病理改变均有不同程度的回调,酸枣仁醇提物高、低剂量组细胞数量均回调且差异有统计学意义。

图3 酸枣仁对失眠模型大鼠下丘脑、垂体、肾上腺组织HE染色的影响(400×)
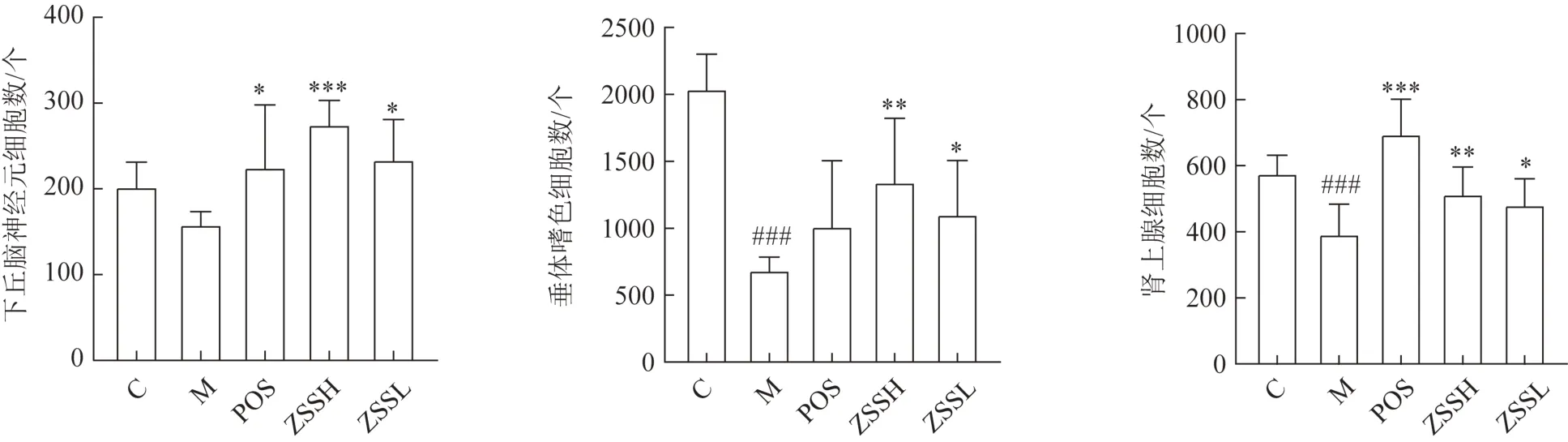
图4 酸枣仁对失眠模型大鼠下丘脑、垂体、肾上腺组织HE染色细胞数量的影响(,n=6)
3.3.2酸枣仁对HPA 轴激素水平的影响 研究结果(图5)显示,失眠模型大鼠血清中的HPA 轴相关激素CRH、ACTH、CORT 水平较正常组均显著升高,酸枣仁可不同程度地改善这种变化,其中酸枣仁醇提物低剂量组可显著降低血清中CRH 水平,酸枣仁醇提物高剂量组可显著降低血清中ACTH 水平,酸枣仁醇提物高、低剂量组均可降低血清中CORT 水平但无显著性差异。失眠模型大鼠下丘脑CRH 水平较正常组显著升高,给药酸枣仁醇提物高、低剂量均可显著降低CRH 水平;失眠模型大鼠垂体的ACTH 水平较正常组显著升高,给药酸枣仁醇提物高剂量组可显著降低ACTH 水平;失眠模型大鼠肾上腺的CORT 水平较正常组显著升高,给药酸枣仁醇提物高剂量可显著降低CORT 水平,而酸枣仁醇提物低剂量组差异无统计学意义。
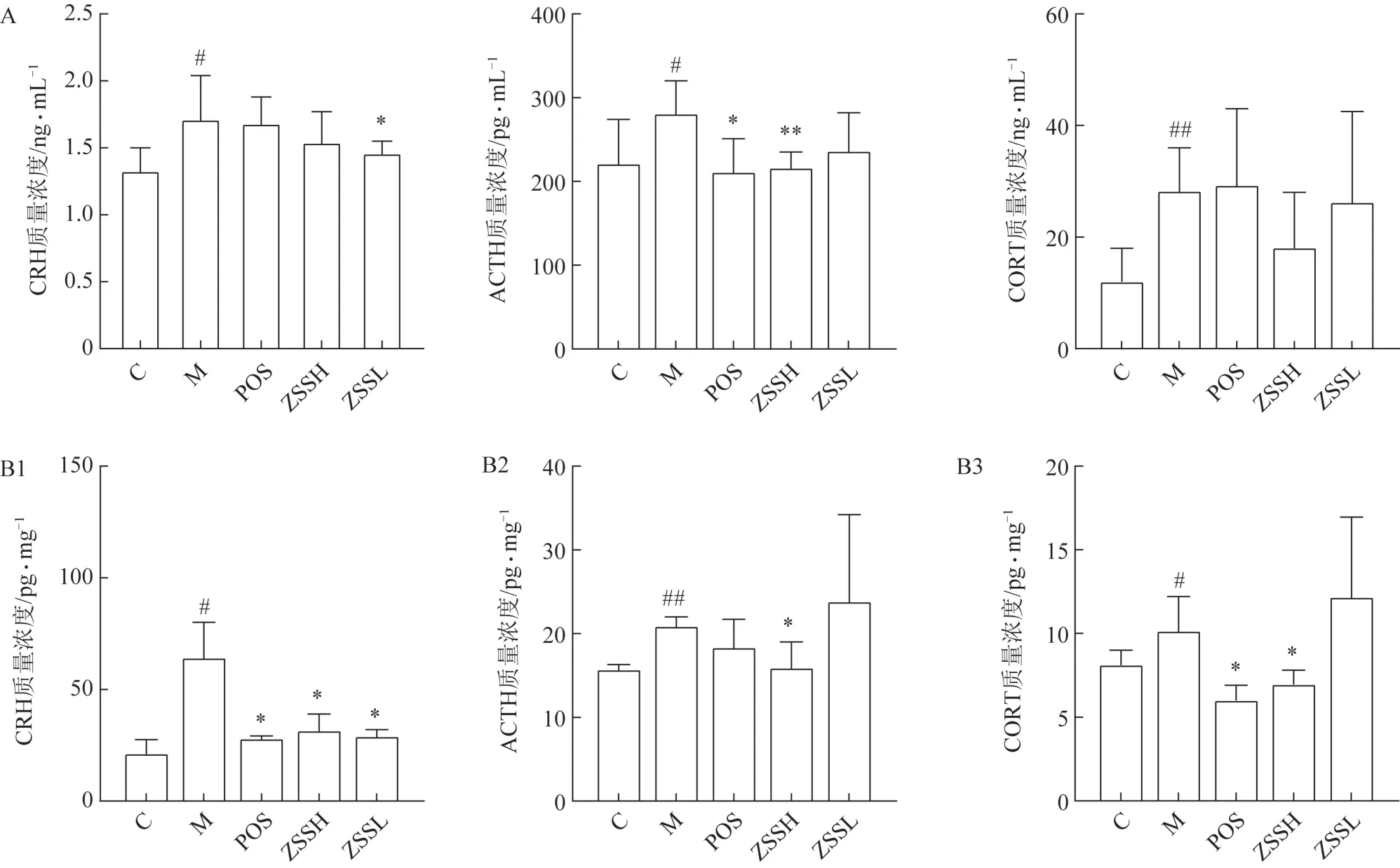
图5 酸枣仁对失眠模型动物血清和组织HPA轴相关激素水平的影响(,n=6)
3.4 酸枣仁对血清ⅠL-1β、TNF-α和NO水平的影响
血清生化指标分析结果(图6)显示,失眠模型大鼠血清中NO 含量显著低于正常大鼠(P<0.05),炎症因子ⅠL-1β、TNF-α水平均显著高于正常大鼠(P<0.05)。给药酸枣仁提取物后,血清中ⅠL-1β、TNF-α水平均有显著降低趋势(P<0.05),提示酸枣仁提取物可降低失眠动物的机体炎症水平,推测酸枣仁可通过降低机体炎症水平发挥干预失眠的作用。
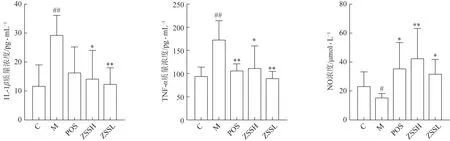
图6 酸枣仁对失眠模型动物血清生化指标的影响(,n=6)
4 讨论
失眠是临床上最常见的睡眠障碍类型。现代研究显示,PCPA 是一种色氨酸羟化酶(TPH)抑制剂,可选择性抑制TPH,进而阻断5-HT 的合成[16],常被用于腹腔注射建立睡眠剥夺动物模型,进而研究催眠药物的药理作用机制,但鉴于实验动物的个体差异,睡眠剥夺效果不易掌控[17]。
本研究采用腹腔注射PCPA 混悬液3 d,通过观察失眠大鼠造模后行为验证失眠模型复制的成功与否。模型复制期间,失眠大鼠表现出对刺激敏感、暴躁且攻击性强等行为特征,旷场实验表明失眠大鼠存在一定焦虑状表现。在模型建立和分组的基础上,对失眠大鼠的行为、病理切片及生化指标等进行分析,以探讨失眠大鼠的生化指标异常及酸枣仁对失眠大鼠的调节作用。给药不同剂量酸枣仁提取物后,失眠大鼠的焦虑样行为一定程度得到改善,攻击性减弱。
现代研究表明,HPA 轴在维持警觉和调节睡眠中起重要作用[18],HPA 轴主要由下丘脑、垂体和肾上腺三部分组成,HPA 轴功能紊乱均会影响睡眠,其致病机制为下丘脑释放CRH,CRH 作用于垂体后使其释放ACTH,ACTH 通过体循环作用于肾上腺皮质,使其释放糖皮质激素和CORT[19]。过量的CRH 导致垂体ACTH 分泌增加,进而增加CORT 的分泌,最终造成糖皮质激素分泌过多,过量的糖皮质激素不能有效抑制HPA 轴的活性,使其形成恶性循环而引发应激反应[20]。糖皮质激素作为HPA 轴的最终产物,会导致觉醒及失眠,睡眠对应激系统有抑制作用[21-22]。
HPA 轴亢进会导致睡眠障碍,当应激等因素使HPA 轴功能亢进时,机体出现非快速眼动(NREM)睡眠减少,快速眼动(REM)睡眠增多[23]。失眠患者血清CRH 较正常人水平升高,疲劳、疼痛、焦虑等症状均可作为压力源引起CRH分泌,CRH可引起非压力或压力性的觉醒,CRH 还可减少促进睡眠的生长激素分泌[24]。ACTH 能够提高大脑皮质的应激性,是睡眠-觉醒调控机制中的重要组成。应激状态下,ACTH 浓度会随之升高,但应激长时间持续,则可能使机体调节能力减弱,进而出现HPA 轴功能减退[25]。CORT 被称为“应激性激素”,目前被认为是应激反应经典指标,CORT 水平升高,影响机体物质吸收及新陈代谢,进而出现失眠症状。有文献表明,中老年慢性失眠患者有HPA 轴相关的内分泌失衡,表现为总睡眠时间<5 h 时,CORT 水平明显增高,CORT 和ACTH 水平与总睡眠时间呈负相关[26-27]。
本研究结果表明,失眠会对下丘脑、垂体及肾上腺造成一定程度的病理改变,表现为模型组大鼠下丘脑中非神经元细胞数量增多;垂体中嗜色细胞减少,而嫌色细胞增多,嗜色细胞主要分泌生长激素、催乳素(嗜酸性细胞)、促甲状腺素、促肾上腺素和促性腺激素等(嗜碱性细胞),嗜酸性细胞和嗜碱性细胞不易在HE染色下分辨,嫌色细胞主要是退化的嗜色细胞,或者是形成初期的嗜色细胞,提示失眠大鼠的垂体功能受到影响;肾上腺中细胞代偿性增大,肾上腺分泌功能增强。综上分析,失眠使HPA轴激素分泌功能紊乱。同时,失眠模型组大鼠血清中的CRH、ATCH、CORT 含量,下丘脑中的CRH、垂体中的ACTH、肾上腺中的CORT 含量均较正常组上升,HPA 功能呈亢进状态。上述指标均证明,失眠模型大鼠会出现HPA 轴功能亢进,长时间的应激状态使得垂体分泌功能减退,与文献报道一致[28]。
血清生化指标分析结果表明,酸枣仁可改善失眠引起的多种生化指标异常。HPA 轴功能亢进可能会导致机体炎症因子紊乱,已有研究证实睡眠不足会诱发先天性免疫反应,诱导促炎细胞因子(如ⅠL-1β和TNF-α)的表达增加。ⅠL-1β作为炎性细胞因子,广泛参与炎症反应,局部高浓度ⅠL-1β主要发挥内分泌调节作用,可作用于下丘脑引起发热,刺激下丘脑释放CRH,使垂体释放ACTH,促进糖皮质激素的释放[29-30]。本研究结果显示,给予酸枣仁提取物后可不同程度地降低模型动物血清ⅠL-1β和TNF-α的表达,提示其可缓解因失眠导致的机体炎症反应,同时降低促炎因子对HPA轴激素释放作用。
NO参与了学习与记忆的调节过程,有诱导多种睡眠因子促进睡眠的作用[31],其含量与人的神经系统具有密切联系,具有第二信使和神经递质的作用,调节多种病理生理过程[32]。本研究结果表明失眠大鼠血清NO 含量降低,酸枣仁提取物可升高失眠大鼠血清NO 含量,该作用可能为酸枣仁镇静催眠及治疗失眠症的作用机制之一。
综上所述,本研究基于PCPA 致失眠大鼠模型,证实HPA 轴功能紊乱与失眠的发生发展密切相关,而酸枣仁可一定程度缓解失眠造成的HPA 轴过激状态,其中酸枣仁高剂量对调节HPA 轴功能紊乱具有较好的效果,为后续基于HPA 轴研究失眠症的作用机制提供了研究基础。
