化学氧化技术处理水体中抗生素的研究进展
2022-02-18庞素艳段杰斌
周 越 ,庞素艳 *,段杰斌
(1.吉林建筑大学松辽流域水环境教育部重点实验室 吉林长春 130118; 2.吉林建筑大学市政与环境工程学院 吉林长春 130118; 3.广东工业大学环境生态工程研究院 广东广州 510006)
抗生素是抑制或消除微生物(如细菌、真菌或原生动物)生长的化学药物,近年来因在水环境中被频繁检测到[1-4]而备受关注。抗生素来源主要有人用医药抗生素、农林牧渔用抗生素、制药企业废水以及污水处理厂废水这4个途径。尽管抗生素在水环境中的浓度处于亚抑制水平,通常为ng/L至μg/L[1-5],但会对生态环境和人类健康造成极大的潜在危害[6]。主要原因有以下2点:①痕量的抗生素就能对微生物群落施加选择性压力,引起微生物群落结构和功能的变化[7];②抗生素在环境中的长期存在可能导致抗生素耐药基因(ARGs)和抗生素耐药细菌(ARBs)的产生,加速抗生素耐药性的传播[8]。为消除上述潜在风险,必须开发有效的处理工艺,最大限度减少抗生素向环境中释放。
水环境中抗生素的处理方法有物理法、生物法和化学法等。物理法如混凝、吸附、膜分离等,仅具有富集和分离作用,而非降解、矿化[6]。由于大多数抗生素具有高溶解度,物理法并不能有效地将其去除。生物降解则需要较长的水力停留时间,会明显促进抗药性的发展[9]。而化学氧化反应时间快、氧化能力强且不依赖吸附过程,被认为是最有潜力的技术之一[10]。化学氧化技术包括直接氧化技术和高级氧化技术:直接氧化技术是指利用化学氧化剂(如二氧化氯、高锰酸钾[11]等)的氧化性能,破坏有机物的结构,选择性地将抗生素氧化成易于降解和毒性较低的化合物;高级氧化技术(AOPs)产生活性极强的活性物质,如羟基自由基(·OH)、硫酸根自由基(SO4·-)等,通过活性物质与抗生素之间发生加合、取代、电子转移或断键等反应,使水环境中难以生物降解的大分子抗生素分解成无毒或毒性较低的小分子物质。
本文对臭氧直接氧化及臭氧高级氧化、氯氧化、芬顿及类芬顿法这3类化学氧化技术处理抗生素废水的国内外最新研究现状进行综述,总结了水环境中常见的5类抗生素[磺胺类(SAs)、喹诺酮类(FQs)、四环素类(TCs)、大环内酯类(MA)和β-内酰胺类(βlactams)]在化学氧化过程中的降解特性。着重讨论相关反应机理,通过归纳与选定抗生素的二级反应速率常数来评估氧化剂的效果,为化学氧化技术在抗生素废水处理中的进一步应用提供理论指导。
1 化学氧化技术
1.1 臭氧氧化及臭氧高级氧化技术
臭氧(O3)氧化技术的作用机理包括O3的直接氧化和水基质诱导O3分解产生羟基自由基(·OH)[12]的氧化[式(1)]。O3是亲电氧化剂,可与具有亲核部分如烯烃、芳香环、胺基以及含有硫、磷、氮和氧原子的官能团的有机分子快速反应。·OH主要是在较高pH条件下由氢氧根离子催化O3形成,因此在O3氧化抗生素过程中,·OH对抗生素的去除作用可能不大,O3的直接氧化占主导作用。O3直接氧化的效率高度依赖于臭氧剂量和接触时间,而酸碱度由于与官能团的电离相关,也强烈影响着降解动力学。Alsager等[13]研究发现O3氧化牛奶样品中4类抗生素(阿莫西林、强力霉素、环丙沙星和磺胺嘧啶)的去除效能比纯水更高。这是由于牛奶的自缓冲特性,使得体系保持中性pH,令结构中的胺基处于非质子化状态,从而提高O3的亲电攻击反应性。
在臭氧的高级氧化技术(AOPs)中,O3通过光解(O3/UV)[14]、过氧化氢(H2O2)联用(O3/H2O2、O3/H2O2/UV)[15]以及催化剂(O3/催化剂)[16]等手段产生·OH,其氧化降解效能一般高于单独的臭氧氧化技术。臭氧AOPs降解抗生素过程中产生许多高活性的氧化物质(ROSs),如·OH、超氧自由基(O2·-)、四氧化氢自由基(HO4·)和过氧自由基(HO2·)[式(1)~式(5)],这些ROSs还可促进O3进一步分解。

在这些ROSs中,·OH由于其更高的氧化还原电位(1.8~2.7V)和非选择性氧化特性,能够与溶液中的大多数有机污染物快速反应[17]。·OH主要通过 3种机制与有机物相互作用[18]:①从脂肪族碳原子中提取氢,产生以碳为中心的自由基;②双键或芳香环的亲电加成;③电子转移反应。Pelalak等[15]提出了O3/H2O2体系氧化降解柳氮磺胺吡啶的2种主要反应途径,如图1所示。首先是·OH对偶氮基团的攻击(途径1),其次是·OH对磺酰胺基团的攻击(途径2),这2种途径分别导致N=N和N—S键的断裂(图中只显示部分中间产物)。最后ROSs与这些中间体进一步反应,产生了二氧化碳、水和无机离子等最终 产物。
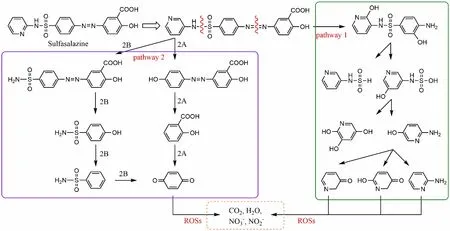
图1 O3/H2O2体系氧化SSZ的反应途径 Fig.1 Reaction pathway of oxidation degradation of SSZ by O3/H2O2 process
1.2 氯氧化技术
氯是饮用水消毒最常用的化学氧化剂之一,用于控制废水中的病原体。尽管许多氯化消毒副产物(DBPs)的形成引起了公众的关注,但由于其成本较低,氯化消毒仍被广泛应用。游离氯(FC)和二氧化氯(ClO2)是氯化消毒过程中常见的氧化剂。游离氯(FC)是以次氯酸(HOCl)、次氯酸根离子(OCl-)或溶解的氯单质形式存在的氯。HOCl和OCl-又称为游离有效氯(FAC),主要存在于pH为6~9范围内[19]。HOCl是氯化过程主要的活性氯物质,可通过3种机制与有机物相互作用[20]:①氧化反应;②不饱和官能团上的加成反应;③亲核位点的亲电取代反应。因此HOCl对有机微污染物具有高选择性,其反应性通常仅限于有限位点(还原、亲核和不饱和位点),特别是中性胺基、还原的硫基或活化的芳香族部分[21]。亲电取代反应是主要的作用机制,作为一个双电子亲电 体,HOCl通常以其Cl原子攻击有机分子的富电子位置。ClO2通常用于消毒地下水或经处理的地表水。与FC相比,ClO2消毒效率高,且不与有机物发生氯代反应,不容易形成DBPs[22]。ClO2通常经历一个单电子氧化过程转化为亚氯酸根离子(ClO2-)。尽管ClO2氧化电位低于O3和HOCl,它对结构中显示出酚类或胺基等特定官能团的抗生素具有较高反应 性[23],且反应性受pH控制:酚氧阴离子和中性胺比中性酚和质子化胺更具有活性。
Dodd等[24]和Ben等[22]分别提出了HOCl和ClO2氧化降解磺胺甲恶唑(SMX)的反应路径,如 图2所示。对于HClO,HClO首先进攻SMX上的胺基,发生取代反应,生成有机氯胺并被进一步降解成小分子有机物或无机物。若体系内存在还原剂,则生成的氯胺将重新还原成SMX,无法进行后续反应。这表明HClO亲电取代过程不稳定,难以破坏具有生物活性的基团且可能生成毒性更大的氯代副产物。ClO2降解表现出3种主要反应路径:路径①,苯胺部分羟基化形成产物1,并且苯环上的胺基进一步氧化形成产物2;路径②,C—S键断裂形成产物3和苯胺;路径③,S—N键断裂形成产物4和对胺基苯磺酸。ClO2氧化可能会破坏对胺基苯磺酰胺部分,因此对降低SMX溶液的抗菌活性有疗效。

图2 HOCl和ClO2氧化降解SMX的反应路径 Fig.2 Reaction pathway of oxidation degradation of SMX by HOCl and ClO2
除上述磺胺类抗生素氯化机理的探讨外,还报道了TCs、FQs氯化过程的相关研究。Wang等[20]的研究发现ClO2氧化TCs会导致TC分子发生羟基化和断裂,而FAC氧化TCs会形成氯化和羟基化的产物,没有任何实质性的环断裂。因此,ClO2氧化更有可能降低TCs的抗菌能力。另外还发现ClO2对含三级胺的FQ转化效果明显[25],但基于结构中的喹诺酮环几乎没有被破坏,该转化可能不会消除抗菌活性。
1.3 Fenton及类Fenton法
1894年,法国科学家Henry J.Fenton研究中发现酒石酸会在铁盐和双氧水(H2O2)作用下迅速被氧化[26]。基于此,Fenton反应首次被提出并被广泛应用。Fenton反应是复杂的链式反应,这组反应主要由2个反应[式(6)~(7)]组成:①Fe2+氧化成Fe3+,同时分解H2O2产生羟基自由基(·OH);②Fe3+还原回Fe2+,也是整个反应的限速步骤。
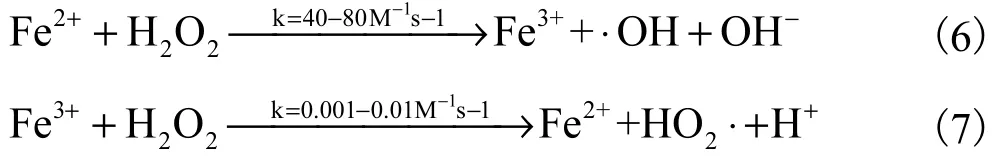
·OH能够无差别断裂大分子抗生素,并逐步降解为小分子物质,这是Fenton法实现对水中抗生素降解的主要手段,通过加快Fe2+/Fe3+循环可提高体系内·OH的浓度。实际情况中除·OH外,还会产生HO2·和·O2等活性氧化剂[27],但就本文而言,不会对链式反应进行进一步分析。
传统Fenton法在工程应用中受到限制。①适用pH范围窄,通常在pH为3左右实现Fe2+/Fe3+高效循环,但调节pH会增加运营成本。在偏碱条件下由于铁的沉淀和活性氧化剂的转移[即由·OH转化为更具选择性的Fe(IV)][28],Fenton反应速率受到限制,Fe3+难以被H2O2还原为Fe2+,其速率常数仅为0.001~0.02L·mol-1·s-1[29]。②Fenton体系试剂利用率低,需加入高剂量Fenton试剂才能达到适合的处理效率,这会提高水中金属离子浓度和水体色度,需要额外的除铁步骤,增加操作复杂性和成本。③H2O2的储存和运输过程中也具有潜在的风险。为突破该局限性,在传统Fenton原理上进行改进,出现类Fenton和非均相Fenton体系。这2种体系均可在较宽的酸碱度范围内进行,催化剂可循环利用,避免产生铁污泥。此外,H2O2通过O2活化原位生成,然后被Fenton催化剂分解为·OH[30],该方法可解决H2O2的储存和运输风险。
类Fenton体系是指用其他催化剂代替Fe2+,与Fenton体系的运行机理完全一致。常见的类Fenton体系催化剂主要是一些过渡金属元素:铁(Fe)、锰(Mn)、铜(Cu)、钴(Co)、铷(Ru)等。一些非金属有机物也能促使H2O2产生·OH,如卤代醌、苯醌、羟胺(HA)、腐植酸等。Wang等[31]研究总结了诺氟沙星(NOR)在HA-Fenton体系中的3个降解途径,如图3所示:途径①,苯环上的氟原子被·OH取代,并进一步脱羧和双羟基化;途径②,先脱氟,然后·OH攻击哌嗪环中的碳原子,随后哌嗪环被打开、脱氢、脱氧 或脱氨基;途径③,·OH攻击喹诺酮部分羧酸基团附近的碳碳双键。最后所有中间产物将被·OH进一步氧化成低分子有机产物和无机产物。此外,Fenton与类Fenton体系可与电化学、超声、紫外等联合来加速Fe3+与Fe2+之间的转换与循环,光芬顿与电芬顿因为可以通过原位生成H2O2,相比Fenton法更有益。
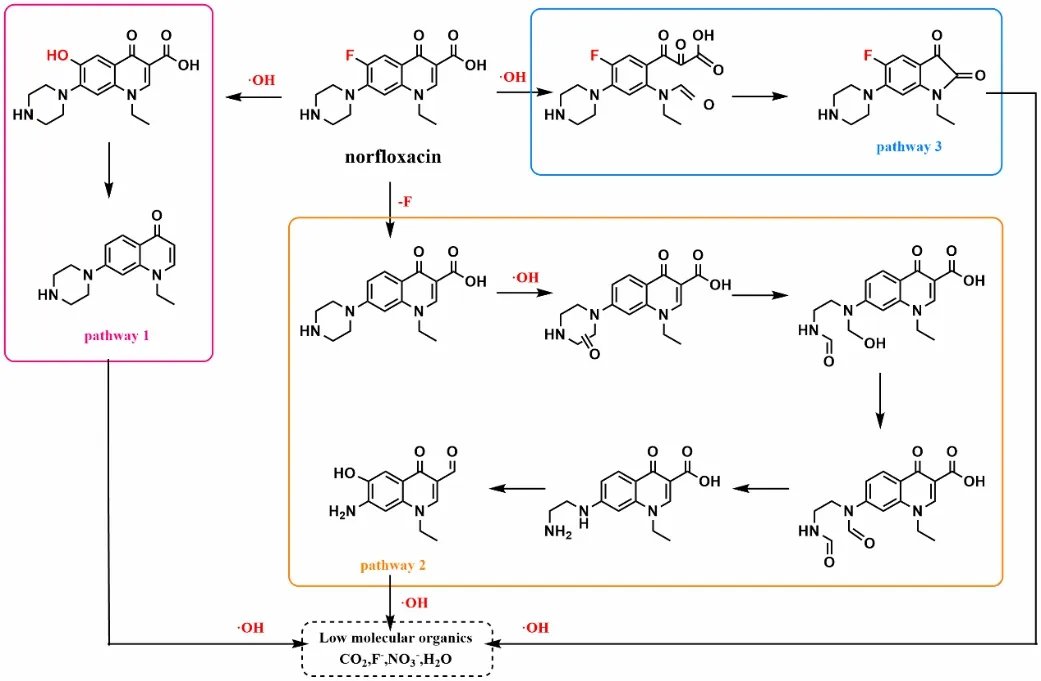
图3 HA-Fenton体系氧化降解NOR的反应路径 Fig.3 Reaction pathway of oxidation degradation of NOR by HA-Fenton process
非均相Fenton体系改变系统催化剂的状态,将游离铁离子改为铁基固体催化剂。在非均相Fenton体系中,催化剂主要包括:①有机或无机载体,常用的载体包括活性炭、氧化铝、半导体材料(Fe2O3、TiO2、ZnO)、黏土、二氧化硅、沸石、蒙脱石、生物吸附剂等;②铁矿物,如磁铁矿、磁赤铁矿、纤铁矿和赤铁矿等;③其他金属催化剂,如锰氧化物、金纳米颗粒等;④金属有机骨架,是由过渡金属离子和有机配体组成的晶体功能材料;⑤零价铁(ZVI)。
2 抗生素降解特性
氧化剂与不同类型的抗生素之间的反应活性各有不同,这种反应活性可以通过确定氧化剂与选定的抗生素之间的二级反应速率常数来评估,即二级反应速率常数越高,其反应活性越强。O3、·OH、HOCl和ClO2与各类抗生素在pH为7条件下反应的二级速率常数见图4[11,15,18,21,24,35-43]。其中·OH的反应活性是最高的,它与选定的FQs、SAs、MA和TCs的反应速率常数均在109之上,O3对SAs和TCs的反应活性整体高于FQs和MA,HOCl和ClO2对TCs的反应活性整体高于SAs和FQs。这种不一致的反应性是 由氧化剂对抗生素分子结构中反应位点的选择性而引起的。·OH氧化还原电位高,表现出强大的非选择性氧化能力,抗生素分子结构中的各类基团都容易被·OH氧化。而O3、HOCl和ClO2是选择性氧化剂,只对抗生素分子结构中的部分基团具有反应活性。此外,抗生素结构中可电离的官能团的存在形式也会强烈影响反应动力学[20,44]。官能团的电离与酸离解常数相关联,通常导致抗生素在介质中以阳离子(质子化)、中性或阴离子(去质子化)形态存在。官能团质子化形态的反应活性一般低于其中性或阴离子形态。因此,有必要对氧化剂与抗生素的反应位点和存在形态进行讨论,从SAs、FQs、TCs、MA和βlactams这5类抗生素中各选出一种代表性抗生素,分析其结构和形态,以及O3、·OH、HOCl和ClO2的进攻位点,如图5所示[20,22,45-53]。
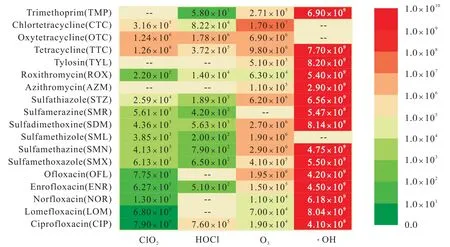
图4 选定的抗生素与O3、·OH、HOCl和ClO2反应的二级反应速率常数 Fig.4 Secondary reaction rate constants for the reaction of selected antibiotics with O3,·OH,HOCl and ClO2
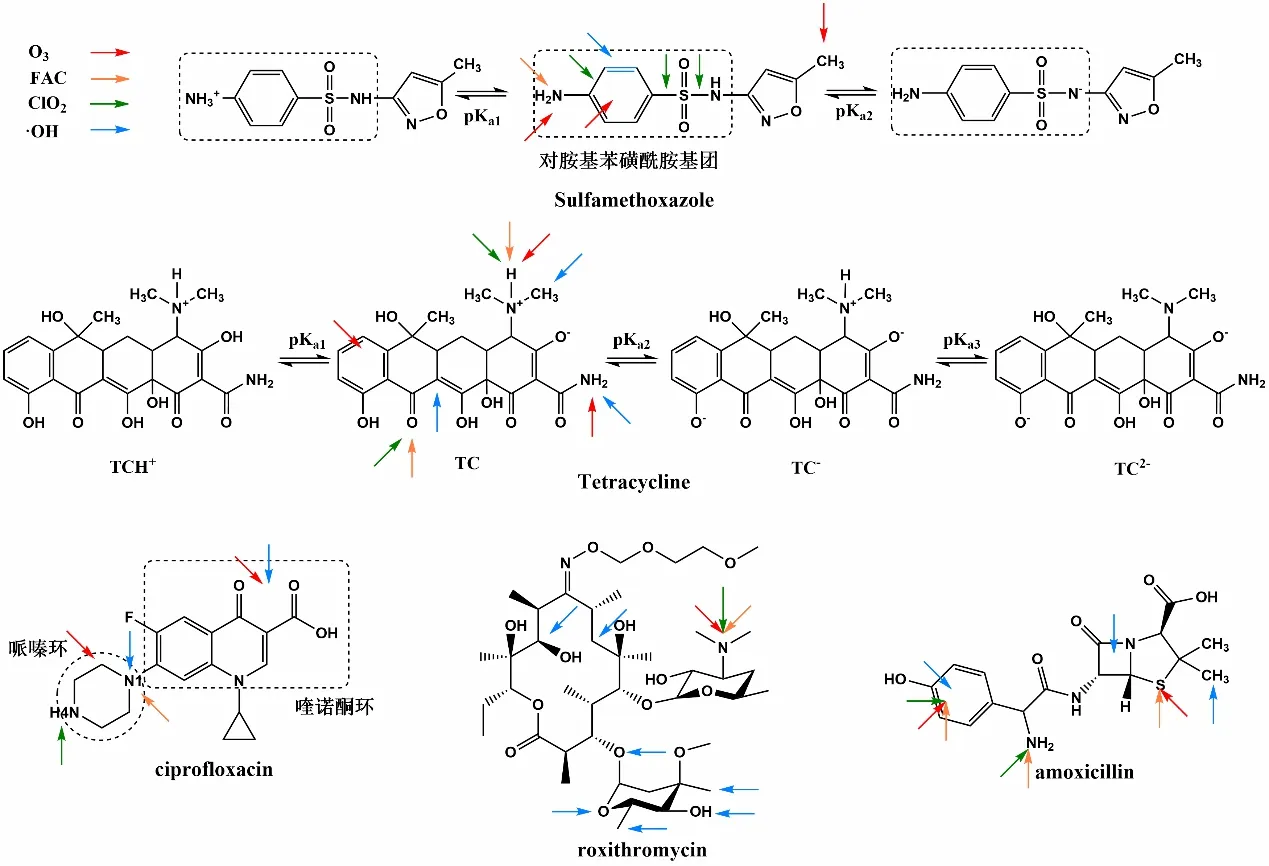
图5 5种抗生素的结构特性及O3、·OH、HOCl和ClO2的攻击位点 Fig.5 Structural characteristics of five antibiotics and attack sites of O3,·OH,HOCl and ClO2
由图4可知,FQs与ClO2的反应活性较O3、HOCl和·OH低。以环丙沙星(CIP)为例,分子结构中存在喹诺酮环和哌嗪环,其中喹诺酮环与抗菌活性密切相关。比较CIP与这4类氧化剂的反应位点,推测ClO2对CIP反应活性较低的原因是ClO2不容易氧化喹诺酮环。O3、·OH均可攻击哌嗪环和喹诺酮环,·OH容易攻击哌嗪环上碱性较弱的N1位点和喹诺酮环上的2个强吸电子基团,即氟和羧基[50]。HOCl可与N1位点快速反应。ClO2攻击的特定位点是哌嗪环N4原子,ClO2氧化导致哌嗪环脱烷基、羟基化和分子内环化,但喹诺酮环保持完整,表明ClO2可能无法消除CIP的抗菌活性[25]。
与FQs相比,SAs与O3、·OH、HOCl和ClO2均表现出良好的反应活性,这可能是因为对氨基苯磺酰胺基团容易被这4种氧化剂氧化。SMX表现出2种酸离解常数(pKa1=1.8;pKa2=5.57),分别涉及胺基的质子化及对磺酰胺基团的去质子化。在O3氧化过程中,SMX阴离子形态比中性及质子化形态反应性高[51],这可能是因为阴离子形态电子密度较高,对磺酰苯胺部分容易受到O3的亲电攻击。因此较高pH有利于SMX的臭氧氧化。而在氯化过程中,尽管HOCl与SMX阴离子形态的反应性比中性形态反应性高[53],但随着pH的增大(pKa,HOCl=7.5),活性氯物质HOCl的浓度减少,反应性较低的OCl-浓度逐渐增加。因此在酸性条件下,氯化过程中SMX的降解效率更高。
TCs与O3、·OH、HOCl和ClO2反应活性是选定的几类抗生素中最强的,推测认为是由于其结构中包含二甲胺基、酚基和共轭双键等富电子基团,容易受到亲电氧化剂的攻击。TCs结构均含并四苯基本骨架,包括4个可电离官能团的连接环系统,这些官能团与3个宏观酸离解常数相关联。TC2-和TC-2种阴离子形态的TCs对HOCl、ClO2反应活性较高,TCs主要通过未质子化的二甲氨基和去质子化的酚二酮基团与ClO2和FAC反应[20]。O3主要通过攻击酚基与TCs反应,而·OH可无差别氧化TCs中大部分 基团。
MA共同反应位点是叔氨基。因为叔胺基容易发生电离,去质子化形态比质子化形态反应活性更高,所以MA的降解有pH依赖性。以罗红霉素为例,O3、HOCl和ClO2的攻击均发生在叔胺基上。·OH可对多个基团进行亲电攻击,造成芳香环的羟基化,C—O、C—N或S—N键断裂以及α位上芳香环的裂解和开环[54]。
β-lactams通过β-内酰胺环获得抗菌特性。以阿莫西林为例,其结构中的四元β-内酰胺环、甲基、胺基、苯甲酸环等是容易受到攻击的位点。O3攻击发生在酚基和噻唑烷环的硫基,HOCl的攻击发生在胺基、硫基及芳香族部分,ClO2的攻击发生在酚基和伯胺基。·OH的攻击可造成四元β-内酰胺环的开环、甲基的氧化及苯甲酸环的羟基化[46]。
3 结论与展望
文献中关于抗生素在降解过程中的大量信息表明:传统化学氧化技术不足以防止抗生素污染的发展和蔓延,以及转化副产物的完全矿化、降低毒性等,需要开发新型氧化技术或将已有技术相结合以获得更好的处理效果。臭氧氧化和氯化法与抗生素的反应活性遵循O3>HOCl>ClO2,O3主要与活化的芳香环、非质子化胺反应,HOCl的反应性通常仅限于胺基、还原的硫基或活化的芳香环,ClO2对酚类或胺基等特定官能团具有较高反应性。不同于臭氧法和氯化法的选择性反应性,臭氧高级氧化和Fenton及类Fenton法由于产生·OH等活性物质而表现出强大的非选择性反应活性,与选定抗生素的反应速率常数均在109之上。抗生素在·OH的攻击下,发生芳环羟基化、键的断裂及芳香环的裂解和开环,转变为有机小分子或无机物。然而在水环境中常含有多种抗生素和其他溶解性物质,彼此存在竞争消耗关系,使得该转化无法顺利进行。在这种情况下,必须通过监测实际水环境中的抗生素,确定是否真正消除了这些药物对生态和人类健康的威胁。■
