多元统计法高效筛选薏苡仁蛋白抗氧化提升肽方法构建*
2022-02-18杨土娣陈展鹏杨容郑文宇林维杰古敏陈潼林邱穗琳周苏斌赵谋明廖兰
杨土娣,陈展鹏,杨容,郑文宇,林维杰,古敏,陈潼林,邱穗琳,周苏斌,赵谋明,廖兰,
(1.佛山科学技术学院 食品科学与工程学院,广东 佛山 300134;2.福州大学 生物科学与工程学院,福建福州 350102;3.华南理工大学 食品科学与工程学院,广东 广州 510640)
薏苡仁为禾本科植物薏苡的干燥成熟种仁,其营养价值高,具有抗肿瘤、免疫调节、降血糖血钙、降血压、抗病毒等作用[1-3]。薏苡仁中含有65%碳水化合物,其次是蛋白质,约占18.7%[4-9]。
董红艳[10]和韩丽丽[11]等采用商业蛋白酶对薏苡仁蛋白进行酶解研究,利用单因素、响应面等手段获得了经优化的薏苡仁抗氧化肽的酶解条件。朱海峰等[12]的研究表明酶解法处理蛋白质后,使处于蛋白质内部的疏水性氨基酸暴露出来产生苦味肽,使水解产物呈现出一定的苦味,限制了水解产物的最终应用。因此,蛋白质的水解不仅需要内切酶,还需要外切肽酶的参与,内切酶仅能将蛋白质水解为多肽,而外切酶可以将多肽水解为氨基酸[13]。风味蛋白酶(Flavourzyme)既包含内切位点又含有外切位点,复合蛋白酶(Protamex)主要作用于内切位点,两者均为商业蛋白酶。商业蛋白酶酶解蛋白质是制备各功能性多肽的主要方法[14-16]。
单因素实验、回归正交和响应面优化等是酶解过程筛选条件最常用的方法。传统的单因素试验筛选策略在较多考察因子时需扩大试验次数,不但延长了试验周期,且易产生随机误差[17]。响应面优化方法虽解决了随机误差问题,但当变量个数较多时,准确构造一个近似多项式以进行确定性分析具有一定困难,特别是当模型具有明显的非线性特征,或误差为非正态分布时,获得模拟切真而合适的优化更加困难[18]。因此,十分必要构建一种高效快速筛选蛋白功能性酶解物的方法。
本研究利用相对丰度热图(Heatmap)、主成分分析法(Principle component analysis, PCA) 与差异条形图分析法三者结合对三种酶(风味蛋白酶、复合蛋白酶和两者各50%复合酶)二次酶解薏苡仁蛋白碱性蛋白酶Alcalase 2.4 L水酶法制得的苦味肽,对其水解度(Degree of Hydrolysis, DH)、蛋白质回收率(Protein Recovery, PR)与抗氧化指标进行多变量统计分析,以薏苡仁蛋白肽进行抗氧化功能提升为目标,利用样品多元统计学的相关性与显著性来确定最佳酶解物,进而确定最优酶解条件。该方法快速直观,可为食品酶蛋白解领域高效筛选目标样品提供具有参考价值的工具。
1 材料与方法
1.1 材料与试剂
薏苡仁:福建南平浦城仙芝楼公司赠予;碱性蛋白酶Alcalase 2.4L、风味蛋白酶 Flavourzyme、复合蛋白酶 Protamex:北京Novozymes公司;其他试剂均为分析纯级,由国药试剂提供。
1.2 仪器与设备
ML204 分析天平,梅特勒-托利仪器有限公司;HWCL-3加热磁力搅拌器,郑州长城科工贸有限公司;TGL-20MB高速冷冻离心机,长沙湘智离心机有限公司;THZ-82水浴恒温振荡器,常州市金坛鸿科设备有限公司;FM200高速分散均质机,厦门精艺业主科技有限公司;WGL-125B电热鼓风干燥箱,天津市泰斯仪器有限公司;PHS-25 pH计,上海仪电科学仪器股份有限公司;FD-1C-50冷冻干燥机,北京博医康实验仪器有限公司;EU-2600紫外可见分光光度计,上海昂拉仪器有限公司。
1.3 方法
1.3.1 一次薏苡仁水酶法蛋白肽的制备
浦城薏苡仁精米→打粉、80目过筛→配制成20%(w/w)悬浮液→30 ℃恒温水化12 h→高压(20 MPa)均质、3次→冷冻干燥制粉→25 ℃恒温浸泡3 h→离心取渣→0.4%(w/w)L-半胱氨酸盐酸盐溶液预处理浸泡30 min→调节pH值至9.6→Alcalase 2.4 L[2%(w/w)底物蛋白]35 ℃孵育3 h→沸水浴10 min灭酶活→离心得上清液→薏苡仁水酶法蛋白肽溶液。
1.3.1 二次酶解薏苡仁蛋白制备抗氧化功能提升肽的工艺流程
薏苡仁水酶法蛋白肽溶液→调节pH值至7,温度50 ℃→加酶→分别孵育 0.5、1、1.5、2、3、4、5、6 h→定量取样→沸水10 min灭酶活→离心得上清液。其中,酶为分别加入1% Flavourzyme(w/w,底物/蛋白)、1% Protamex(w/w,底物/蛋白)、0.5%Flavourzyme+0.5% Protamex的复合酶(w/w,底物/蛋白)。
1% Flavourzyme 处理n小时记作F-n;1%Protamex处理n小时记作P-n;0.5% Flavourzyme+0.5% Protamex的复合酶处理n小时记作FP-n;共24组样品。
1.3.2 蛋白质回收率(PR)测定方法
根据Aspevik等[19]人的方法测定酶解液样品的蛋白质含量,采用凯氏定氮法测定薏苡仁粗蛋白和酶解液中的蛋白含量。蛋白质回收率为酶解液中蛋白含量与原始薏苡仁蛋白中蛋白含量的比值。
1.3.3 水解度(DH)测定方法
根据Zhao等[20]人的方法稍作修改,水解度的定义为水解的肽键数量(h)相对于每单位重量的肽键数量(htot),以百分比表示。
计算公式如下:
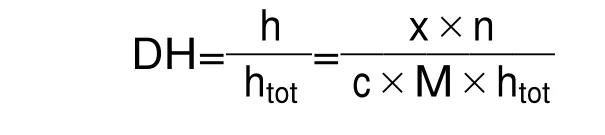
式中:x——样品蛋白水解液的-NH2含量(μmol/mL);

1.3.4 样品蛋白水解液的-NH2含量
根据Bidlingmeyer等[21]人的方法稍作修改,精密称取不同样品1.0 g,加入20 mL水,浸泡2 h,60 ℃、250 W超声提取1 h,抽滤30 min,取滤液冷冻干燥成粉,加水定容至10 mL备用,以不加样品的溶液为空白对照,采用HPLC分析。
1.3.5 抗氧化性测定方法
1.3.5.1 DPPH 自由基清除能力
根据Liu等[22]人的方法稍作修改,分别取1 mL酶解样品与1 mL 95%乙醇配置的0.1 mM DPPH溶液混合,室温黑暗放置0.5 h后于517 nm测定吸光值。参比组为1 mL 95%乙醇溶液与1 mL酶解样品混合,空白组为1 mL 95%乙醇配置的0.1 mM DPPH溶液与1 mL 95%乙醇混合溶液。
DPPH自由基清除能力
式中:Ai——样品组吸光值;
Aj——样品参比组吸光值;
A0——空白组吸光值。
1.3.5.2 ABTS 自由基清除能力
根据Re等[23]人的方法稍作修改,取7 mM ABTS与2.45 mM过硫酸钾溶液等比例混合,室温避光静置12~16 h后,采用5 mM pH值7.4的磷酸盐缓冲液稀释混合溶液至吸光值为0.70±0.02(λ=734 nm),配置成ABTS自由基溶液。分别取酶解样品与ABTS自由基溶液等比例混合,室温避光反应20 min于λ=734 nm下测定吸光值,采用5 mM pH值7.4的磷酸盐缓冲液调吸光值为零,空白组以蒸馏水代替。
ABTS自由基清除能力
式中:Acontrol——空白组吸光值;
A sample——样品组吸光值。
1.3.5.3 Fe2+螯合能力
根据Guo等[24]人的方法稍作修改,取1 mL不同酶解样品,分别添加4.7 mL蒸馏水和0.1 mL 2 mM FeCl2,充分混匀后加入0.2 mL 5 mM Ferrozine溶液反应30 min,取上清液于562 nm测吸光值。空白组以1 mL蒸馏水替代样品,参比组为1 mL样品加入5 mL蒸馏水。
计算公式为:
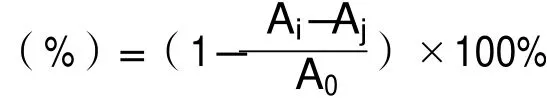
式中:Ai—样品组吸光值;
Aj—样品参比组吸光值;
A0—空白组吸光值。
1.3.5.4 ·OH清除能力
根据Yang等[25]人的方法稍作修改,分别取1 mL酶解样品,分别添加0.3 mL 8 mM FeSO4、1 mL 3 mM水杨酸和0.25 mL 20 mMH2O2,充分混匀后于37 ℃反应0.5 h,待冷却至室温后补足蒸馏水使反应液体系达到3 mL,离心取上清液于510 nm测吸光值,空白组以蒸馏水代替样品。
·OH清除能力
式中:Acontrol——空白组吸光值;
Asample——样品组吸光值。
1.3.6 数据分析
所有实验进行3次重复平行实验;用SPSS 22.0(IBM,美国)中Ducan分析法进行差异显著性分析(p<0.05具有统计学意义)。采用R语言(v 3.6.3,http://www.datavis.ca/R/)pheatmap包进行热图聚类分析(Heatmap);XLSTAT 2014(Addinsoft,美国)进行主成分分析(PCA)以及STAMP(v 2.1.3,http://kiwi.cs.dal.ca/Software/STAMP)进行差异条形图(Extended error bar),对二次酶解薏苡仁蛋白制备抗氧化功能提升肽的DH、PR和4个抗氧化性指标进行综合分析。
2 结果分析
2.1 二次酶解薏苡仁蛋白肽的水解度和蛋白质回收率变化
3 种酶二次酶解薏苡仁蛋白肽的DH和PR的变化如图1,样品颜色和浑浊度外观变化如图2。由图1可知0~0.5 h是二次酶解薏苡仁蛋白肽的主要作用时期,在反应前0.5 h,3种酶酶解产物的DH与PR均显著增加,1 h后缓慢增加并逐渐趋于平稳。在前1 h反应期,Flavourzyme组的PR与DH迅猛增加至62%,明显高于另外2组,而Protamex组的增加幅度最小,说明Flavourzyme对二次酶解液的酶法敏感性高,原因可能是Alcalase 2.4L是内切酶,一次酶解薏苡仁蛋白会产生大量中短肽,而Flavourzyme具有较多的外切位点,可以将碱性蛋白酶水解后的短肽进一步水解为氨基酸,前1 h反应期内Flavourzyme相对内切位点多的Protamex,底物中自由氨基酸含量更高。而Flavourzyme+Protamex组较Protamex组有明显提升,表明风味蛋白酶和复合蛋白酶两者的复合酶较单复合蛋白酶来说对于蛋白质的水解作用有所提升,这应该是由于风味蛋白酶的加入,而风味蛋白酶和复合蛋白酶作用位点可能有所冲突,导致2种酶复合酶对蛋白质的水解能力不及单风味蛋白酶的水解能力强。表观现象也有相似的趋势,Flavourzyme酶解1 h,酶解液颜色发生显著变化,随着酶解时间延长,酶解颜色越来越深。Protamex组颜色变化较为缓慢,酶解3 h后才发生显著的颜色变化,说明发生轻微的美拉德反应。Flavourzyme+Protamex组从3 h后开始发生显著的颜色变化,在酶解5 h后颜色变深变亮。因此,Flavourzyme酶解1 h对二次酶解薏苡仁蛋白肽的水解更有应用价值。
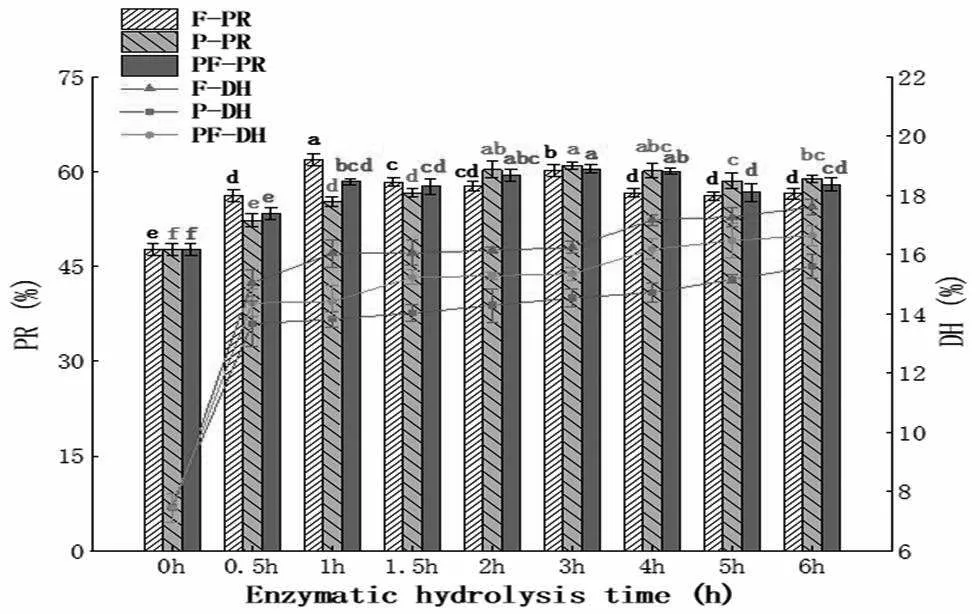
图1 二次酶解薏苡仁蛋白肽不同时间的水解度和蛋白质回收率的变化

图2 二次酶解薏苡仁蛋白肽不同时间的水解度和蛋白质回收率的变化
2.2 二次酶解薏苡仁蛋白肽提升抗氧化性能结果分析
2.2.1 DPPH 自由基清除能力
由图3可知,二次酶解显著提高了薏苡仁蛋白肽的DPPH自由基清除能力。3种酶酶解物其DPPH自由基清除能力均随水解时间的增加先增加再趋于稳定。Flavourzyme组的清除DPPH自由基能力在酶解1 h最强达到78.37%,而Protamex组最小60.42%。但是反应3 h后,Protamex组的清除DPPH自由基能力最强达到76.41%,而Flavourzyme组最小71.28%,原因可能是高含量的疏水性氨基酸或肽有关联[26]。

图3 不同组合酶在不同酶解时间的DPPH自由基清除能力
一次水酶法Alcalase 2.4 L单酶酶解其薏苡仁蛋白提取率仅为(70.78±1.3)%。一方面,一次酶解不彻底,剩余较多的部分完整蛋白未被酶解,加入Flavourzyme和Protamex可以进一步酶解释放更多具有活性的肽段;另一方面,一次酶解液中含有薏苡仁油脂,从图2中样本A表观看出,一次酶解液是均一稳定的乳液,推测一次酶解薏苡仁蛋白肽结构中含有大量暴露的疏水性氨基酸短肽。因此,Flavourzyme的外切酶1 h就可将薏苡仁蛋白含有疏水性氨基酸的短肽链末端切断释放氨基酸,增加薏苡仁酶解物中疏水性氨基酸含量,而Protamex组酶切位点更加广泛,3 h后薏苡仁蛋白结构内疏水性氨基酸才得到有序释放。
2.2.2 ABTS 自由基清除活性
由图4可知,相比于DPPH自由基清除能力, 薏苡仁多肽具有更为优异的ABTS自由基清除活性。分析其原因,一方面可能由溶剂效应引起,相比于溶解在乙醇中的DPPH自由基,溶解于水中的ABTS自由基能够更加充分地与薏米多肽接触,从而更容易发生反应;另一方面,从化学结构上来说, 相比于具有较大位阻的DPPH自由基,ABTS自由基位阻更小,因此更有利于同自由基清除剂反应。由此可见薏米多肽具有较强的ABTS自由基清除活性[27],3种酶组合的ABTS自由基清除能力与DPPH自由基清除能力表现相似,都随着时间先增加后趋于稳定,Flavourzyme酶解1 h清除ABTS自由基能力达到最强为87.10%,Protamex 酶解3 h达到86.52%。

图4 不同组合酶在不同酶解时间的ABTS自由基清除能力
2.2.3 ·OH清除能力
由图5可知,3种酶组合的·OH清除能力都随着时间先增加后减小再趋于稳定。Flavourzyme组1 h的清除·OH能力最强达到62.47%。Flavourzyme良好的·OH清除效果和清除DPPH自由基类似,均是由于Flavourzyme酶切位点为疏水性氨基酸,导致酶解物产生良好的自由基清除能力[28]。大分子的蛋白的高度空间结构不利于与自由基发生反应,但经水解后,形成许多小分子肽,暴露能参加反应的氨基酸侧链基团,因此对薏苡仁水解物的·OH清除能力明显提升[26]。
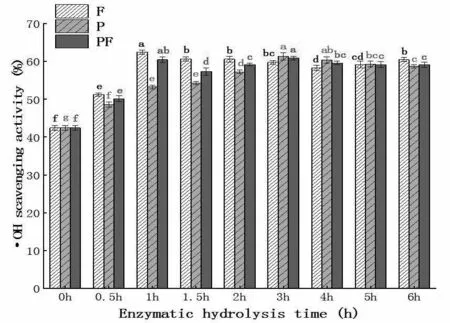
图5 不同组合酶在不同酶解时间的羟基自由基清除能力
2.2.4 Fe2+螯合能力
由图6可知,与前3种抗氧化指标变化趋势相似,3种酶组合的Fe2+螯合能力随着酶解时间先增加后趋于稳定。Flavourzyme组在1 h时Fe2+螯合能力最强达到82.97%,Protamex组最小,Protamex酶解3 h达到81.46%。这是由于Alcalase 2.4 L酶解薏苡仁蛋白仅释放了较少的螯合位点,而Flavourzyme组酶解较Protamex更快速破坏蛋白胶束产生了更多的自由氨基酸基团,从而使其与Fe2+螯合位点随之增加[29],提高了Fe2+螯合能力。

图6 不同组合酶在不同酶解时间的亚铁离子螯合能力
综上,从3种酶二次酶解薏苡仁蛋白肽的DH,PR,DPPH、ABTS、Fe2+螯合能力和·OH清除能力6个指标变化指标看出,Flavourzyme 1 h与Protamex 3 h二次酶解薏苡仁蛋白提升肽的各方面综合表现差异不显著。因此,Protamex 3 h组和Flavourzyme 1 h组在高效筛选抗氧化提升肽均有应用价值。针对这2个样本,进一步科学评估综合筛选到最合适的目标样本,而不是基于单一的因素的考量,将利用相对丰度热图(heatmap)、主成分分析法(PCA)与差异条形图分析法对二次酶解薏苡仁蛋白进行监控和条件筛选构建出一套新的方法。
2.3 多元统计分析
2.3.1 基于热图分析对二次酶解的监控和条件筛选
相对丰度热图可以反映样品之间的相似性以及群落结构的相似性[30]。图7是基于本试验25个样品(右纵坐标)和6个变量(指标)的丰富度的热图。如图7所示,热图已纵向分成5大组,第3组大部分指标的丰富度类似而第2组呈现显著的差异性(p<0.05),例如ABTS自由基清除率、DPPH自由基清除率、·OH清除率、DH、PR、Fe2+螯合能力的差异性,F-1、P-3、P-4在数学模型上其结构以及物理化学特性有显著性差异。另一方面,从图7可看6个指标可以根据特征分为2类(一级分类),第一类是抗氧化性,第二类是酶解程度。聚类树状图显示6个指标之间的相似性主要分为3类(二级分类):第一类是DH;第二类主要聚集了PR、·OH;第三类主要聚集了ABTS、DPPH、Fe2+。进一步分析第2组中的P-4、F-1、P-3的差异性,其中F-1和P-3在聚类上归成一类,F-1相对于P-3所使用的时间短,具有较高的抗氧化性和酶解程度。
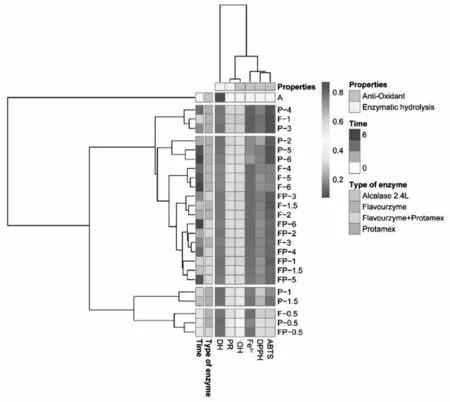
图7 不同酶解时间下不同酶组合的酶水解产物的相对丰度热图
综上,F-1和P-3的处理对二次酶解薏苡仁蛋白抗氧化提升肽具有显著性影响,并且能显著提升酶解程度和抗氧化特性,验证了上一节初步筛选的结论,为二次酶解筛选抗氧化提升肽的识别提供第一步依据。
2.3.2 基于PCA对二次酶解的监控和条件筛选
主成分分析是基于降维的原理,用少数的综合变量即主成分来代表原复杂的多变量,且最大程度保留了原始数据代表的信息,显著降低数据的复杂度,并对数据进行可视化处理[31]。图8是基于本试验25个样品(右纵坐标)和6个变量(指标)的主成分分析图,获得抗氧化性指标与酶解特征指标与PC1和PC2的关系以及对二次酶解薏苡仁蛋白制备抗氧化提升肽的抗氧化性指标与酶解特征的影响。
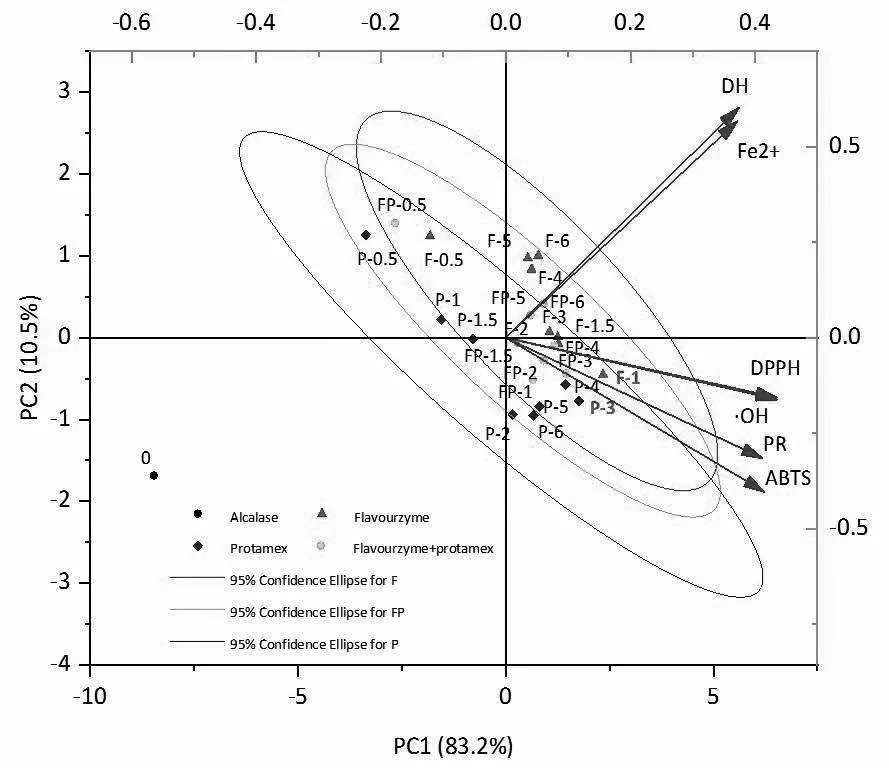
图8 不同酶解时间下不同酶组合的酶水解产物的主成分分析
由图可直观看出:第一主成分PC1的贡献率为83.2,第二成分PC2的贡献率为10.5。25份样品呈现2种不同的区域分布,第一类,DH和Fe2+螯合能力都在第一象限。第二类,DPPH自由基清除能力、ABTS自由基清除能力、·OH清除能力、PR在第四象限。通过皮尔逊相关系数与PCA图的关系可知,DPPH自由基清除能力、ABTS自由基清除能力、·OH清除能力、PR有较强的相关性,DH和Fe2+螯合能力有较强的相关性。F-1和P-3距离6个指标的距离较近,具有较强的相关性,F-1与6个指标的相关性强于P-3。综合PCA结果分析,F-1与6个指标的相关性比较强,显著性高,在第一主成分上的占比高于P-3,筛选F-1作为二次酶解的条件,有利于提高薏苡仁酶解产物的抗氧化性和酶解程度,为二次酶解筛选抗氧化提升肽的识别提供第二步依据。
2.3.3 基于差异条形图对二次酶解的监控和条件筛选
图9是STAMP软件特有的误差线图,即差异条形图。如图所示,把DPPH自由基清除能力、ABTS自由基清除能力、·OH清除能力、Fe2+螯合能力归为抗氧化特性组,DH和PR归为酶解程度组。利用这2组综合指标对25个样品进行显著性分析,可以明显地从图中看出F-1的抗氧化特性指标和酶解程度指标的平均含量是最大的,且其p值为0.087,较P-3的0.328更具有显著性,为二次酶解筛选抗氧化提升肽的识别提供第三步依据。
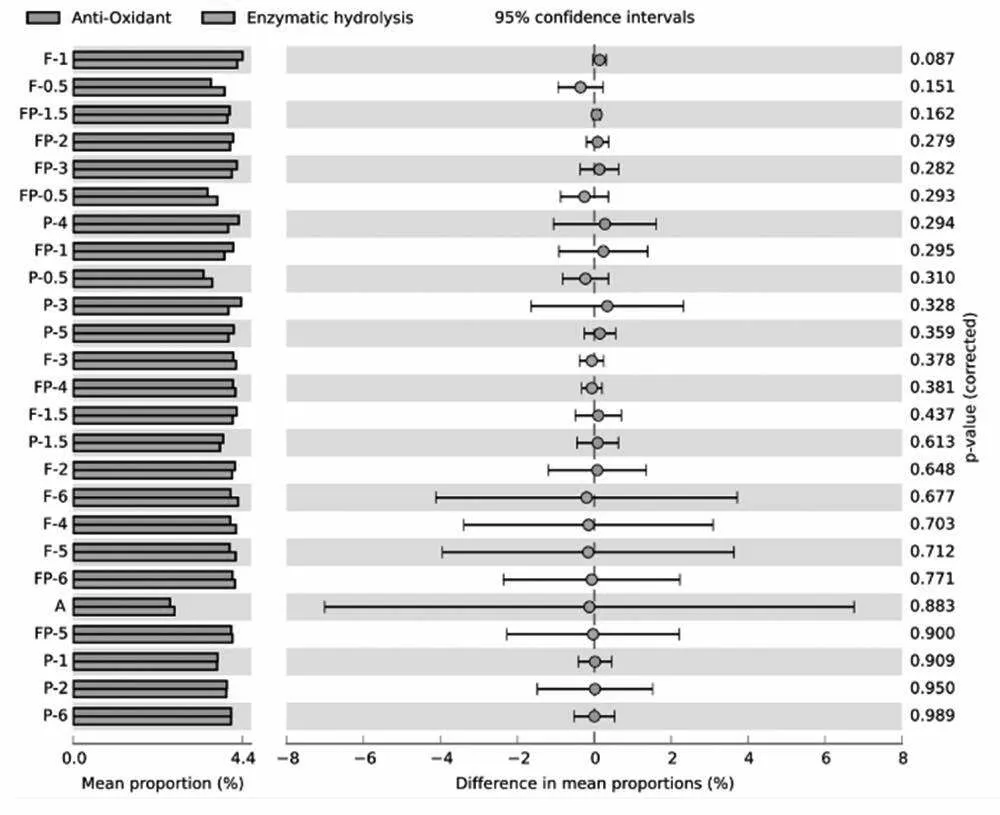
图9 不同酶解时间下不同酶组合的酶水解产物的差异条形图
综上可知,采用多元统计学的分析方法可以有效对二次酶解薏苡仁蛋白肽提升抗氧化性的过程进行监控和条件筛选,结合酶解程度和抗氧化特性,对不同酶以及不同酶解时间的组合进行综合性的评判,利用指标的样品的相关性以及显著性来确定F-1为最佳酶解产物。
3 结论
本文以风味蛋白酶、复合蛋白酶和两者复合酶酶解薏苡仁粗蛋白6 h的水解物进行分析,测定了它们的DH、PR及4个抗氧化指标,并采用了主成分分析、聚类分析丰度热图并结合误差线条形图对各个酶解样品进行统计分析,取得了以下结论:
⑴ 从理化指标变化趋势初步得到,风味蛋白酶处理 1 h与复合蛋白酶处理 3 h酶解薏苡仁蛋白提升肽的综合表现差异不显著,对薏苡仁蛋白的高效提取均有应用价值;
⑵ 进一步,相对丰度热图分析统计学量化显著性特征:F-1和P-3的处理条件都对酶解薏苡仁粗蛋白制备抗氧化肽具有显著性影响,并且能显著提升酶解程度和抗氧化特性;
⑶ 其次,主成分分析构建的数学模型获得分析结论:对25个样品的综合分析得出F-1为最佳酶解条件,可更为直观、全面地筛选最佳酶解样品;
⑷ 误差线差异条形图利用氧化特性和酶解程度2组综合指标最后验证F-1的抗氧化特性指标和酶解程度指标的平均含量最大且最显著,即选用F-1作为最佳酶解条件。
本研究采用多元统计学的分析方法可有效对复合酶解薏苡仁制备抗氧化提升肽的过程进行分析,有利于对酶解过程中的多种指标进行综合筛选,进而确立最佳酶解条件。
