2,3,7,8-四氯代二苯并噻吩在锦鲫不同组织中的生物富集及对肝脏的氧化损伤*
2022-02-15朱紫晴黄守龙张学胜李玉成
朱紫晴 黄守龙 张学胜 汪 梅 王 宁 李玉成
(安徽大学资源与环境工程学院,安徽 合肥 230601)
多氯代二苯并噻吩(PCDTs)是含硫“类二噁英”化合物,疏水性高,在环境中可长期存在,易在生物体内富集并产生毒性效应[1-2]。
PCDTs主要产生于城市垃圾和危险废物焚烧、冶金和金属回收的高温过程、制造多氯联苯和三氯苯磺酸盐的过程[3-5]。PCDTs已在河湖沉积物、造纸废水、垃圾焚烧飞灰和水生生物等环境样品中检出[6]。BUSER等[7]在瑞士焚烧飞灰中测得PCDTs总质量浓度为55 ng/g,其中2,3,7,8-四氯代二苯并噻吩(2,3,7,8-TCDT)质量浓度达到35 ng/g;BUSER等[8]在美国的螃蟹和龙虾中测得2,3,7,8-TCDT质量浓度分别为8.3、1.0 ng/g。可以发现,2,3,7,8-TCDT是PCDTs中检出浓度较高的化合物。
KOPPONEN等[9]发现,2,3,7,8-TCDT对大鼠肝脏癌细胞有内分泌干扰作用。MANTYLA等[10]发现,2,3,7,8-TCDT对小鼠肝脏正常细胞也有内分泌干扰作用。NAKAI等[11-12]通过免疫分析也证实了2,3,7,8-TCDT的内分泌干扰作用。由于水是生命之源,水生生物相比陆地生物更易暴露于水中溶解的污染物下,但对于2,3,7,8-TCDT在水生生物体内的毒性研究相对较少。
锦鲫(Carassiusauratus),一种典型淡水鱼,在中国普遍存在,易于获得,实验室内驯养简单,因此是一种理想的水生生物毒理学研究实验动物[13-15]。肝脏是锦鲫体内最主要的代谢器官,对外源污染物反应灵敏,被认为是研究氧化损伤的最佳器官[16-18]。机体氧化损伤可以通过抗氧化酶(包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GPx)等)的活力变化来体现[19]。SOD和CAT是对抗氧化损伤的第一道防线,SOD可以催化活性氧自由基(ROS)转变为水和过氧化氢,CAT能分解过氧化氢生成水和氧气[20]。GPx属于第二道防线,在细胞代谢和自由基清除中发挥关键作用[21]。另外,当细胞受到ROS攻击时,会产生脂质过氧化而引起细胞功能的紊乱,因此脂质过氧化物的降解产物丙二醛(MDA)也常被用于生物体氧化损伤的评估[22]。
本研究首先探究了锦鲫不同组织(肌肉、鳃和肝脏)中的2,3,7,8-TCDT生物富集规律,在得出肝脏富集能力最强的情况下又对不同剂量的2,3,7,8-TCDT氧化损伤锦鲫肝脏的影响进行了研究。
1 材料与方法
实验锦鲫经过安徽大学实验动物伦理与管理委员会审核批准(批准号:2020-026)。实验用鱼无明显的疾病和肉眼可见的畸形。实验前,锦鲫需在室内驯养1周,每天定时喂食一次,并持续充氧。实验用水为活性炭去氯的曝气自来水。
1.1 锦鲫不同组织的生物富集实验
以50 L实验用水作为锦鲫的生存环境,选取尺寸大小相近的锦鲫(约20.35 g)进行实验,实验设定3个暴露实验组和1个溶剂(丙酮)对照组。前期96 h急性毒性预实验结果表明,2,3,7,8-TCDT在锦鲫体内的半数致死浓度(LC50,以质量浓度计)大于1.0 mg/L。按照《化学品 生物富集 半静态式鱼类试验》(GB/T 21858—2008),生物富集暴露实验最高浓度不超过LC50的1%,设置3个暴露实验组的2,3,7,8-TCDT 暴露质量浓度分别为0.1、1.0、10.0 μg/L,每组设3个平行,以体积分数0.01%的丙酮作为助溶剂,对照组中只加等量的丙酮。实验过程中锦鲫无发育异常或死亡现象出现。暴露期间,每天更换一半体积的暴露实验用水并按相应比例重新投毒,使2,3,7,8-TCDT在整个实验周期内保持稳定。第28天取样后更换全部体积的暴露实验用水并停止投毒,转为净化期间,之后每天换一次全部体积的暴露实验用水。每天换水前2 h喂食。每天监测并控制水相的理化条件:pH 7.56±0.06、DO(9.31±0.06) mg/L、温度(20.27±0.12) ℃。分别于第0、1、3、7、14、21、28、30、32、36、42天取一条鱼,立即解剖取出肌肉、鳃和肝脏,用生理盐水洗净后立即液氮冷冻,置于-80 ℃条件下保存;同时取100 mL水样置于0~4 ℃条件下保存。
1.2 锦鲫肝脏氧化损伤实验
以35 L的实验用水作为锦鲫的生存环境,选取大小尺寸相近的锦鲫(约20.35 g)进行实验,实验设置3个暴露实验组和1个溶剂(丙酮)对照组。参照文献[23],氧化损伤暴露实验最高浓度不超过LC50的10%,设置3个暴露实验组的2,3,7,8-TCDT 暴露质量浓度分别为1.0、10.0、100.0 μg/L,每组设3个平行,以体积分数0.01%的丙酮作为助溶剂,对照组中只加等量的丙酮。暴露实验过程中锦鲫无发育异常或死亡现象出现。第7天暴露结束后取一条鱼立即置于冰块上解剖取出肝脏,用生理盐水洗净后,准确称取0.10 g,加入5 mL生理盐水中制成匀浆液,分别使用A001-1-2型总SOD测试盒、A007-1-1型CAT测试盒、A005-1-2型GPx测试盒和A003-1-2型MDA测试盒测定SOD活力、CAT活力、GPx活力和MDA含量。
1.3 样品处理与分析
使用Labconco FreeZone 4.5型冷冻干燥机将锦鲫的组织样品进行冷冻干燥,研磨过60目筛,准确称取0.10 g,加入5 mL生理盐水中制成匀浆液,置于10 mL离心管中,使用CT14RD型离心机离心3次(转速8 000 r/min)。取上清液加入5 mL正己烷和二氯甲烷的混合液(体积比1∶1,下同),超声萃取10 min,重复3次,合并萃取液并移入分液漏斗中,加入10 mL浓H2SO4以去除脂肪,再加入20 mL质量分数5%的NaCl溶液,振荡5 min后弃去水相,加入2 g无水Na2SO4干燥,用IKA HB10/RV1型旋转蒸发仪将萃取液浓缩至约1 mL,最后过自填复合硅胶柱净化。
自填复合硅胶柱净化步骤:(1)在有聚四氟乙烯活塞和硅筛板的玻璃色谱柱中自下而上依次填装1 g去活硅胶(含质量分数3%的水)、1 g酸性硅胶(含质量分数40%的H2SO4)、1 g碱性硅胶(含质量分数20%的NaOH)、1 g活化硅胶和1 g无水Na2SO4;(2)用15 mL正己烷清洗自填复合硅胶柱;(3)将浓缩的萃取液加入自填复合硅胶柱中;(4)将50 mL正己烷和二氯甲烷混合液加入自填复合硅胶柱中进行洗脱,收集洗脱液后再用旋转蒸发仪浓缩到约1 mL,用D10-12型氮吹仪吹至近干,用正己烷定容至1 mL,过0.45 μm滤膜后转移至色谱小瓶,封口,待Agilent 7980A/5975C型气质联用仪分析。上机前加入1 ng13C标记的2,2’,3,4,5-五氯二苯基醚(MCDE-86)作为替代标。
水样用固相萃取法(SPE)进行处理,具体方法参照文献[24],在气质联用仪上机分析前加入1 ng替代标。
气相色谱条件:色谱柱为DB-5MS(30 m×0.25 mm×0.25 μm),载气为99.999%(质量分数)的高纯氦气,流速为1.0 mL/min;进样采用不分流模式,进样口温度为250 ℃,进样体积为1.0 μL;升温程序为先60 ℃保持2 min,再以12 ℃/min升至240 ℃后保持1 min,再以15 ℃/min升至280 ℃后保持4 min。质谱条件:真空度小于10-5Pa,离子源温度为230 ℃,四极杆温度为150 ℃,采用全扫描模式(FS)定性,选择离子模式(SIM)定量。2,3,7,8-TCDT的保留时间为16.62 min,选定的定量离子质荷比为322。
1.4 生物富集动力学参数计算
通过式(1)拟合净化期间的数据得到斜率a,其数值取绝对值即为锦鲫对2,3,7,8-TCDT的净化速率(k2,d-1),半衰期(t1/2,d)为ln2/k2;通过式(2)拟合暴露期间的数据可得吸收速率,生物富集因子(BCF,L/g)为k1/k2[25]。
lnCT=aT+b
(1)
(2)
式中:CT为净化期间T时锦鲫组织中2,3,7,8-TCDT的质量浓度,μg/g;a、b分别为净化期间数据的回归斜率和常数;Ct为暴露期间t时锦鲫组织中2,3,7,8-TCDT的质量浓度,μg/g;Ct’为水中2,3,7,8-TCDT的质量浓度,μg/L;k1为锦鲫对2,3,7,8-TCDT的吸收速率,L/(d·g)。
1.5 质量控制与质量保证
(1) 确保对照组未检出2,3,7,8-TCDT。(2)2,3,7,8-TCDT的标准曲线相关系数为0.999 2。(3)锦鲫组织中2,3,7,8-TCDT的定量限为0.08~0.14 μg/g。(4)替代标在肌肉、鳃和内脏中的回收率分别为87.25%~102.85%、77.95%~95.37%、75.84%~94.26%。(5)式(1)和式(2)拟合的相关系数均在0.8以上。
1.6 数据处理与统计分析
测得数据均通过正态分布测试和方差齐性检验。使用单因素方差分析(ANOVA)和Duncan’s多重比较分析组间的差异性。
2 结果与讨论
2.1 2,3,7,8-TCDT在锦鲫各组织中的生物富集浓度
不同2,3,7,8-TCDT暴露浓度下锦鲫组织中2,3,7,8-TCDT的质量浓度见图1。由于第0天各实验组均未检出2,3,7,8-TCDT,对照组在整个暴露和净化期间也均未检出2,3,7,8-TCDT,因此图1中省略了相应的数据。
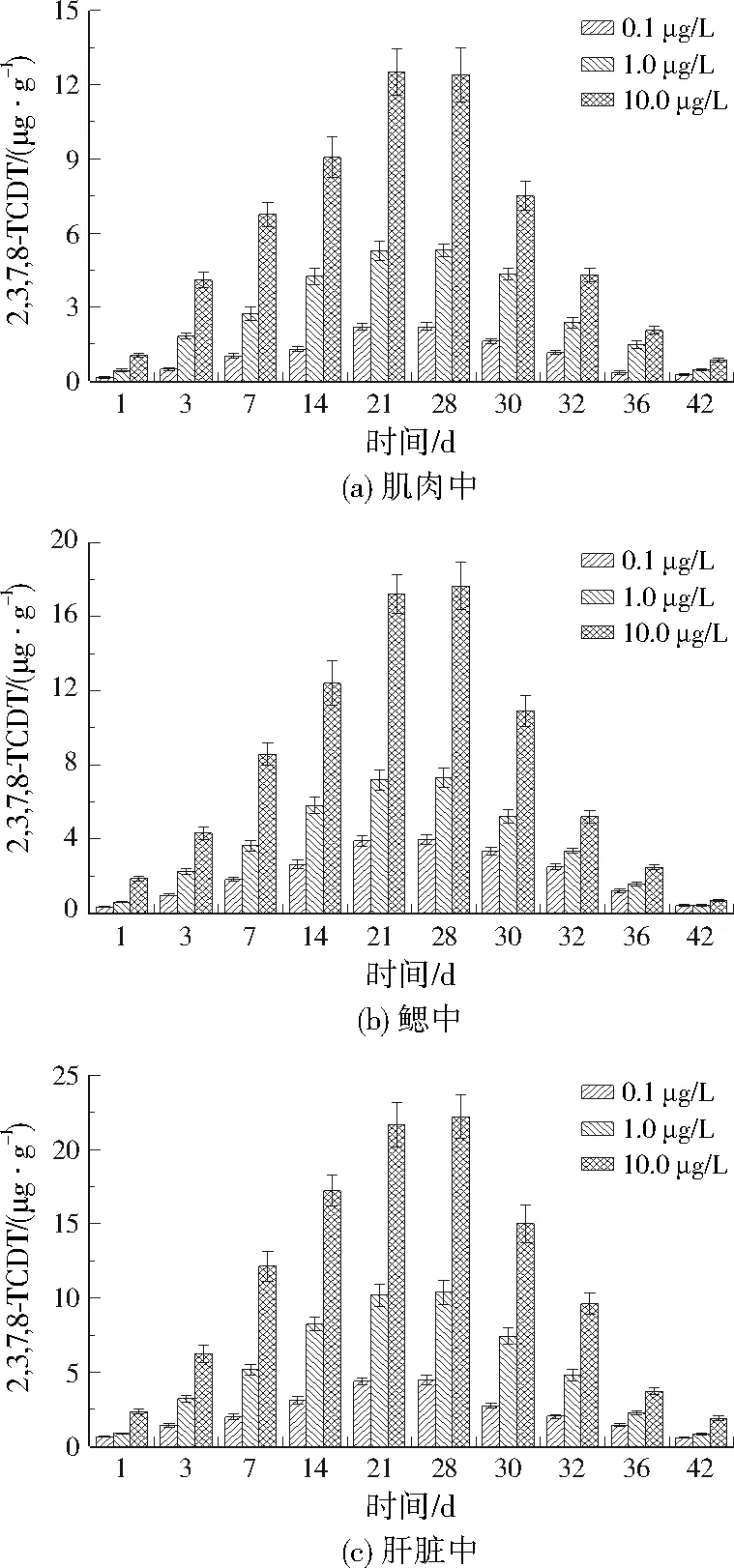
图1 锦鲫体内不同组织中的2,3,7,8-TCDT
暴露1 d后,锦鲫所有组织中均检出了2,3,7,8-TCDT,说明2,3,7,8-TCDT可快速被锦鲫吸收并转移。2,3,7,8-TCDT在肝脏中的浓度总体高于鳃中,鳃中又高于肌肉中,说明鳃和肝脏容易富集2,3,7,8-TCDT,特别是肝脏[26],这是因为肝脏是负责生物代谢的主要组织[27],[28]857。
3个实验组中,锦鲫3种组织中2,3,7,8-TCDT的浓度在暴露期间呈不断增长趋势,到了净化期间开始呈下降趋势。在10.0 μg/L的2,3,7,8-TCDT中暴露28 d时,锦鲫的肌肉、鳃和肝脏中2,3,7,8-TCDT的质量浓度分别达到了12.40、17.65、22.22 μg/g。可以发现,2,3,7,8-TCDT在锦鲫各组织中的生物富集浓度与暴露浓度、暴露时间均正相关。在净化期间,各组织中2,3,7,8-TCDT浓度逐渐下降,说明锦鲫对2,3,7,8-TCDT具有一定的解毒能力,可能是因为2,3,7,8-TCDT被转运或转移到肝脏中代谢而解毒[29]。
2.2 2,3,7,8-TCDT在锦鲫组织中的生物富集动力学参数
锦鲫各组织中2,3,7,8-TCDT的生物富集动力学参数计算结果见表1。
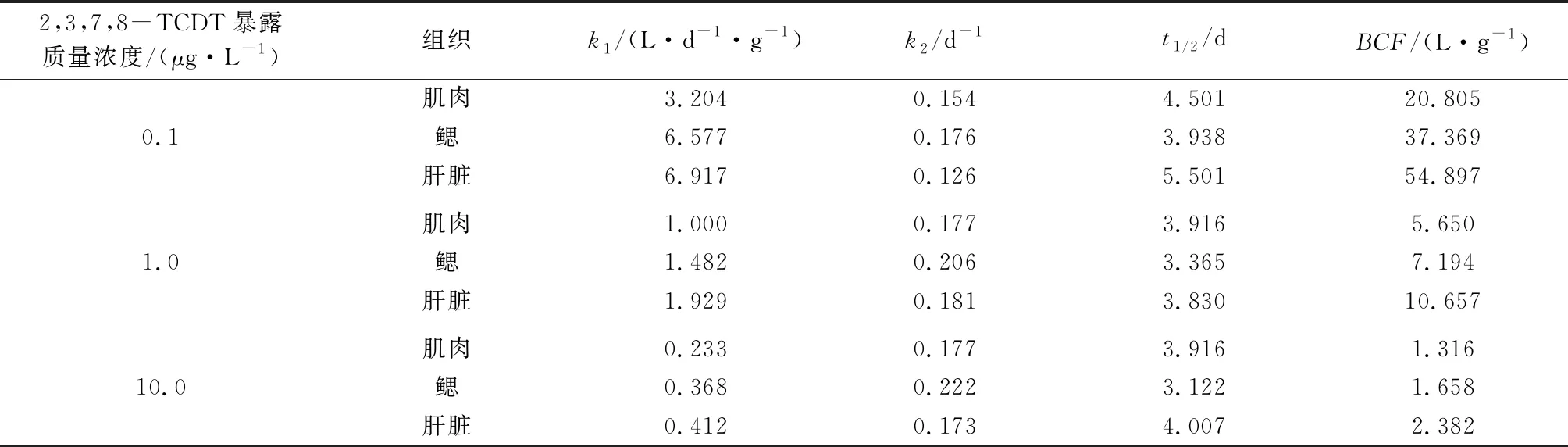
表1 锦鲫各组织中2,3,7,8-TCDT的生物富集动力学参数
2,3,7,8-TCDT在肌肉、鳃和肝脏中的k1分别为0.233~3.204、0.368~6.577、0.412~6.917 L/(d·g),说明锦鲫从水中生物富集2,3,7,8-TCDT速度最快的组织是肝脏,鳃次之,最后是肌肉,与2,3,7,8-TCDT在锦鲫各组织中的生物富集浓度测定结果吻合。随着2,3,7,8-TCDT暴露浓度的升高,3种组织中的k1均明显降低,说明2,3,7,8-TCDT暴露浓度越低,吸收速率越快。
2,3,7,8-TCDT在肌肉、鳃和肝脏中的k2分别为0.154~0.177、0.176~0.222、0.126~0.181 d-1。2,3,7,8-TCDT在肌肉、鳃和肝脏中的t1/2分别为3.916~4.501、3.112~3.938、3.830~5.501 d。由此说明,净化2,3,7,8-TCDT最快的组织是鳃,而不是肝脏。由于净化期间水中已不含2,3,7,8-TCDT,因此之前的暴露浓度对k2、t1/2的影响不大。
2,3,7,8-TCDT在肌肉、鳃和肝脏中的BCF分别为1.316~20.805、1.658~37.369、2.382~54.897 L/g,可以明显地看出,肝脏的生物富集能力最强,肌肉最弱。随着2,3,7,8-TCDT暴露浓度的升高,BCF逐渐降低,与磺胺类抗生素和羟基化多溴联苯醚在鱼体内的生物富集效应相似[30-31]。产生这种现象的原因可能有:(1)虽然实验过程中锦鲫无发育异常或死亡现象出现,但经2,3,7,8-TCDT诱导后会产生不良反应,对2,3,7,8-TCDT的代谢作用逐渐减弱[32];(2)锦鲫组织对2,3,7,8-TCDT的吸收能力有限,会随2,3,7,8-TCDT暴露浓度的升高而减弱;(3)2,3,7,8-TCDT具有高疏水性(正辛醇/水分配系数为6.87),高浓度时易吸附于悬浮颗粒物上或形成胶团[28]859。整体来看,2,3,7,8-TCDT在锦鲫体内具有较强的生物富集效应,其潜在的生态风险不容忽视。
2.3 2,3,7,8-TCDT对锦鲫肝脏氧化损伤的影响
在2,3,7,8-TCDT暴露下锦鲫肝脏中的抗氧化损伤指标见图2。
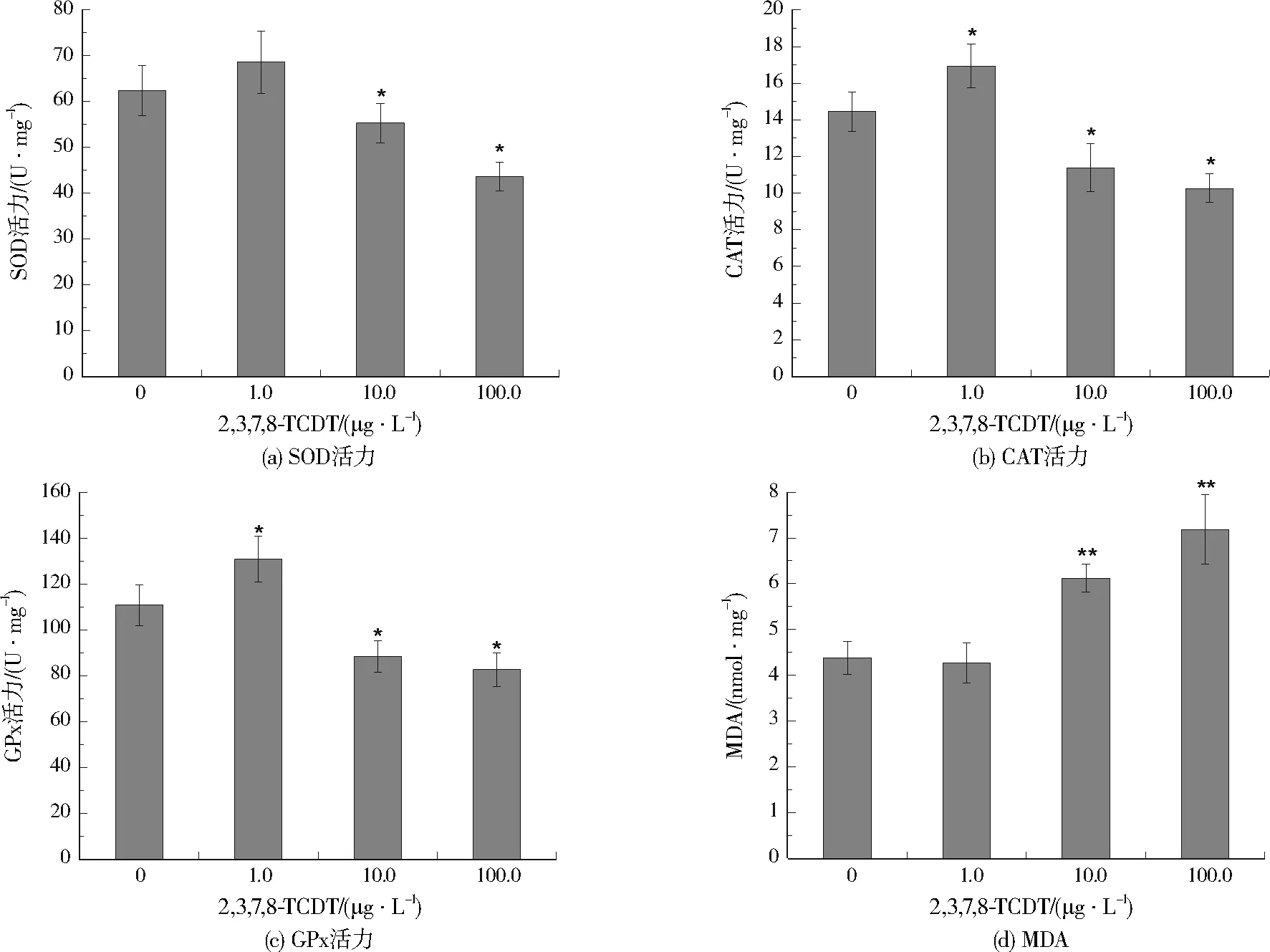
注:*表示与对照组相比差异显著(p<0.05),**表示与对照组相比差异极显著(p<0.01)。
与SOD相似,CAT也被认为是抗氧化损伤的第一道防线,它可以分解过氧化氢产生水和氧气[36]。与对照组相比,CAT活力在暴露质量浓度为1.0 μg/L时显著上升,但在2,3,7,8-TCDT暴露质量浓度为10.0、100.0 μg/L时显著降低,分别下降了21.21%、28.95%,这可能与ROS的变化以及SOD作用过程中产生的过氧化氢变化有关。此外,CAT需要还原型辅酶Ⅱ(NADPH)来激发其活力,因此如果缺乏NADPH也可能会降低CAT的活力[37]。
GPx为对抗氧化损伤的第二道防线,在清除自由基和减少过氧化物方面都发挥着重要作用,它可以催化过氧化氢或脂质过氧化氢(LOOH)转化为水[38]236。GPx活力随2,3,7,8-TCDT暴露浓度的变化趋势与SOD活力和CAT活力基本一致。因为肝脏受到低剂量2,3,7,8-TCDT暴露时会同时诱导SOD、CAT和GPx的产生以清除过量的ROS或过氧化物,而随着2,3,7,8-TCDT暴露浓度升高,谷胱甘肽水平降低、ROS和过氧化物增加,GPx活力将受到显著抑制[38]236。
MDA是机体在抗氧化损伤过程中脂质过氧化物的降解产物。MDA随2,3,7,8-TCDT暴露浓度的升高而上升,1.0 μg/L时MDA相对对照组变化不明显,可能是肝脏可以对抗低剂量的2,3,7,8-TCDT暴露引起的氧化损伤,不会出现严重的脂质过氧化,从3种抗氧化酶活力的数据也可证实这一点。但是,在2,3,7,8-TCDT暴露质量浓度为10.0、100.0 μg/L时,MDA相对对照组分别增加了39.61%、63.80%,并且差异极显著。如前所述,随着2,3,7,8-TCDT暴露浓度升高,脂质过氧化产物增加,而抗氧化防御系统不能清除过量的ROS和过氧化物,从而导致细胞氧化损伤,MDA升高。
3 结 论
(1) 2,3,7,8-TCDT在锦鲫体内各组织中的富集能力表现为肝脏>鳃>肌肉。2,3,7,8-TCDT在锦鲫体内各组织中的生物富集浓度与暴露时间、暴露浓度均正相关。在2,3,7,8-TCDT 质量浓度0.1 μg/L的低剂量暴露下也会引起锦鲫体内的生物富集,并且暴露浓度越低,吸收速率越快。
(2) 与对照组相比,锦鲫肝脏中抗氧化酶(SOD、CAT和GPx)活力在2,3,7,8-TCDT 质量浓度为1.0 μg/L暴露下升高,在10.0、100 μg/L暴露下降低;MDA随2,3,7,8-TCDT暴露浓度升高而上升,特别是在中高剂量下与对照组相比差异极显著(p<0.01)。由此说明,低剂量2,3,7,8-TCDT暴露时会诱导锦鲫肝脏抗氧化酶的产生以清除过量的ROS或过氧化物,而随着2,3,7,8-TCDT暴露浓度升高抗氧化酶受到抑制,锦鲫肝脏会出现氧化损伤。
