关于胸内应用医疗器械细菌内毒素限值的思考
2022-02-14连小奇史新立邢丽娜程茂波
【作 者】连小奇,史新立,邢丽娜,程茂波
国家药品监督管理局医疗器械技术审评中心,北京市,100081
0 引言
细菌内毒素是革兰氏阴性菌的细胞壁成分,主要化学成分是脂多糖,与血液接触会引起热原反应。所以,输血、输液器具、植入器械或类似器械通常需要规定细菌内毒素要求[1-2]。
医疗器械的细菌内毒素检测方法一般采用《中国药典》(2015年第四部)和GB/T 14233.2—2005(医用输液、输血、注射器具检验方法 第2部分:生物学试验方法),包括凝胶法和光度测定(浊度法和显色基质法),仲裁方法是凝胶法。凝胶法的原理是利用鲎试剂与细菌内毒素产生凝聚反应。
1 存在的争议
目前,国内医疗器械细菌内毒素限值一般参照GB/T 14233.2—2005,根据不同接触方式规定其限值(见表1)。其中胸内应用医疗器械的细菌内毒素限值目前还存在一些争议,具体包括“胸内应用器械”的范围模糊,限值要求科学基础不明。
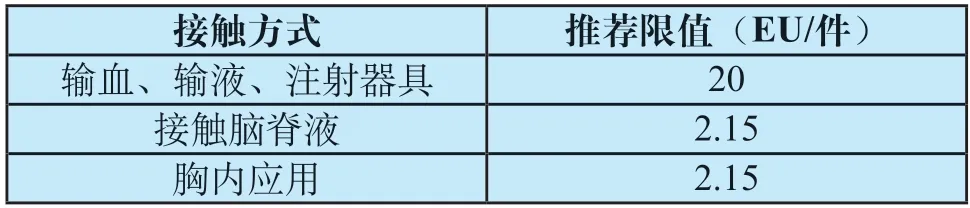
表1 不同接触方式对应的细菌内毒素限值Tab.1 Bacterial endotoxin limits for different exposure modes
GB/T 14233.2由1993版升级为2005版时,细菌内毒素试验方法明确了胸内器械的细菌内毒素限值,但是胸内应用医疗器械没有给出明确的定义或器械举例,这也导致对于胸内器械的理解存在模糊,进而导致相应的限值标准存在争议。
根据《医疗器械分类目录》(2017年),胸腔内器械主要归类在分类编码03、13和14等目录中(如表2)。这些胸内器械的实际临床风险、接触风险和临床操作差异较大,参照GB/T 14233.2—2005要求统一规定细菌内毒素限值2.15 EU/件是不合理的。

表2 胸内器械举例Tab.2 The examples of intrathoracic medical devices
2 国际普遍接受标准
2.1 美国FDA要求
美国FDA同样是按照接触方式规定细菌内毒素限值,但是没有单独列出胸内应用器械。
美国药典第161章节[3]《输血和输液组件及类似医疗器械》(USP<161>Transfusion and Infusion Assemblies and Similar Medical Devices)适用于直接或间接接触心血管系统、淋巴系统或脑脊液的无菌或无热原器械,包括液体检测设备、延长设备、血液监测设备、介入导管、植入氧合管、心脏瓣膜、血管移植物、输血输液器械等,需要按照USP<85>[4]《细菌内毒素检测方法》进行检测。USP<161>不适用于骨科产品、乳胶手套或伤口敷料等。
USP<161>规定了医疗器械的细菌内毒素限值要求:对于医疗器械,每件器械细菌内毒素不超过20 EU,与脑脊液接触的器械内毒素每件不超过2.15 EU。
FDA在2012年发布《Guidance for Industry Pyrogen and Endotoxins Testing:Questions and Answers》中对于医疗器械的细菌内毒素限值进一步做出解释[5],与USP<161>的要求相同(见表3)。

表3 FDA规定的细菌内毒素限值Tab.3 Bacterial endotoxin requirement by FDA
医疗器械的内毒素限度取决于器械的用途以及与器械接触的物品(例如:血液、心血管系统、脑脊髓液、鞘内给药、永久植入医疗器械和皮下植入器械)。如果采用下面推荐的提取体积,对于直接或者间接接触心血管系统和淋巴系统的产品,限度是0.5 EU/mL或者20 EU/件。对于接触脑脊液的器械,限度是0.06 EU/mL 或者2.15 EU/件。对于直接或者间接接触眼内环境的器械,要求更低的内毒素限度:①每10个测试样品应该用40 mL无热原水来淋洗;② 对于异常的小体积或者大体积器械,在选择淋洗液或者萃取液的体积时,器械接触患者的表面积应该有一个调节因素。
2.2 欧洲和日本的要求
欧洲和日本监管机构对于医疗器械的细菌内毒素限值要求与美国基本相同。人用药品注册技术要求国际协调会(ICH)发布草案《关于ICH区域内药典附录的评价及建议-细菌内毒素检查法》[6],当满足该草案2.1的条件时,欧洲、日本和美国的细菌内毒素检查法可以相互认可。所以,欧洲和日本对于细菌内毒素的限值与美国FDA要求基本相同。
3 国内标准的发展历程
在GB/T 14233.2—2005中,相比于输血类器械,与脑脊液接触类器械内毒素作用更严重,所以需要制定更严格的指标。胸内器械与脑脊液接触的指标相同,可能是该标准认为胸内器械内毒素作用也较为严重。在YY/T 0618—2007《细菌内毒素试验方法-常规监控与跳批检验》中也有相关考虑,认为胸内器械风险更高,所以应该更加严格[7-8]。但是该标准是等同转化的ANSI/AAMI ST72:2002(Bacterial endotoxins-Test methodologies,routine monitoring,and alternatives to batch testing)[9],其将附录A4的“Products designed for injection or instillation into intrathecal spaces have a more stringent product endotoxin limit because this exposure is more endotoxic than intravenous administration”,翻译为“设计用于注射或输注入胸腔的产品内毒素限值则更为严格,因为胸腔接触的内毒素作用大于静脉给药途径”,翻译不准确。
目前ANSI/ AAMI ST72升级为2011版[10],该部分描述无变化,YY/T 0618—2017《医疗器械细菌内毒素试验方法-常规监控与跳批检验》已将其修正为“用于向鞘内注射或输注的产品内毒素限值有更低一些的限值,因为鞘内接触比血管内接触更易致热”并补充了细菌内毒素限值,“对于医疗器械,每件器械细菌内毒素不超过20 EU,与脑脊液接触的器械内毒素每件不超过2.15 EU”,与USP<161>要求相同。
所以,如果参考同期YY/T 0618—2007的更新过程,GB/T 14233.2—2005中胸内应用器械细菌内毒素可能存在一定的歧义,或者根据科学认知发展历程已经不再采用“胸内应用”的划分方式。
4 医疗器械细菌内毒素限值的合理性
《中国药典》(2015年第四部)1143细菌内毒素检查法中规定,注射剂K=5 EU/(kg·h),这也是人体研究所支持的适宜的允许限值,人均体重按照60 kg计算,每小时人体可接受剂量限值是300 EU。因为药品可以完全注射,而医疗器械的内毒素需要先浸提,存在不完全回收的问题,所以一般医疗器械的细菌内毒素限值要求更加严格,目前普遍接受值为20 EU/件。
另外,DALY等[11]通过检测宿主对植入器械的免疫反应证明了细菌内毒素限值20 EU/件的合理性。大鼠对细菌内毒素小于10 EU/件和大于20 EU/件的植入器械产生类似的较低的免疫反应,但是对100 EU/件有严重的免疫反应。当植入时间大于35 d后,三种器械的免疫反应没有显著性差异。研究证明FDA目前关于细菌内毒素的标准20 EU/件远低于使宿主产生严重免疫反应的水平,该限值是安全合理的。
5 结论
综上所述,GB/T 14233.2—2005中细菌内毒素检查法中“胸内应用医疗器械”的范围模糊,不能清晰地区分该类器械细菌内毒素限值的要求,同时也与国际上医疗器械监管机构的要求存在一定的差异。另外,随着对于细菌内毒素更加科学的认识和有效的控制,以及细菌内毒素检测方法的成熟和标准化,医疗器械细菌内毒素接触方式的相关描述中,“用于心血管系统”替代“胸内应用”可能更合理。同时,接触心血管系统的医疗器械的细菌内毒素限值可以接受20 EU/件。
