黏蛋白-4和基质金属蛋白酶-7在种植体周病中的表达及意义
2022-02-14姜丹丹周政沈玉凤唐小雪缑小蕊黄枚钰童一洲陈苗苗余重庆
姜丹丹周政沈玉凤唐小雪缑小蕊黄枚钰童一洲陈苗苗余重庆
1.石河子大学医学院第一附属医院口腔科,石河子832000;2.石河子大学口腔医学系,石河子832000
种植体周围疾病(peri-implant disease,PD)是导致种植失败的主要原因[1],这种疾病状态分为种植体周围炎(peri-implantitis,PI)和种植体周围黏膜炎(peri-implant mucositis,PIM),分别有19.8%和46.8%的患病率[2],前者的特征是快速发展的、无症状的骨吸收[3],可能导致植体脱落。对口腔修复性治疗的成本、效益产生了负面影响[4]。目前尚缺乏对PD的标准治疗方案[3],若采用牙周疾病的治疗方案,12个月后疾病复发率高达100%[5],在这种背景下,更需要重新审视PD的发病机制和早诊早治措施[6-8]。
目前监测和诊断PD的传统指标有影像学骨丢失量、牙周探诊深度、探诊出血指数、微生物检测、种植体松动度和化脓等[9],但这些诊断方法可能不够敏感或特异,不足以区分疾病的发生、发展和活动阶段[10-11],它们可以检测出已形成的病损,然而此时疾病已到了中晚期阶段,治疗成本、难度相较于初期大大增加。冠部形态及穿龈轮廓的设计[12]和术者操作水平、植入位点的不同,影响了临床参数的标准化。此外,在种植体周围组织炎症状态下,探诊时使用牙周探针容易引起结合上皮的刺透及出血[13];若随访资料不完整,传统诊断方法的诊断敏感性会降低,影响对早期疾病的诊断效果。针对这种复杂性超过临床诊断能力的多因素疾病,出现了现代医学的另一个概念——精准医学[14],它可以利用现有的临床和生物学参数,针对每个病例提出高度精确的诊断或治疗策略,克服了20世纪“一刀切”医学方法的局限性。作为实践精准医学的一个提法,专家组在牙周和种植体疾病的新分类一文中首次引入了生物标记物这个概念[15]。与PD相关的生物标志物包括一系列促炎细胞因子、趋化因子、单核细胞趋化蛋白、巨噬细胞炎性蛋白和组织破坏酶等[16],对于正在发生发展的炎症过程,它们能够提供客观、可测量的诊断信息,高灵敏度的诊断分析能够在临床表现改变之前捕获样本中的浓度变化,从而优化牙周探诊中以“毫米”为单位的临床测量方式。其中,基质金属蛋白酶(matrix metallo‐proteinases,MMPs)类的临床应用很突出。牙周病原菌可诱导宿主细胞分泌MMPs,以往的研究[17]认为MMPs是检测PD及其严重程度的客观工具。
MMP-7是家族中有最小相对分子质量的成员,它不易被MMPs抑制剂调节[18],MMP-7能够处理各种基质和非基质分子[19],降解各种组织蛋白,包括纤维连接蛋白、明胶、Ⅳ型胶原和弹性蛋白等;MMP-7与许多肿瘤及炎症性疾病有关。在口腔领域中,牙周炎患者的唾液、龈沟液和牙龈组织中的MMP-7水平升高[20](P<0.05),体现出MMP-7与牙周炎症的发生发展有一定的关系。关于PD的研究中,MMP-7能够激活基质金属蛋白酶8酶原(pro-matrix metalloproteinase-8,pro-MMP-8),从而潜在地促进疾病进展[21],表明在种植体周围疾病的进展过程中,MMP-7与MMP-8可能存在协同作用。
Lundmark等[22]对牙周炎患者进行了基因测序研究,黏蛋白(mucin,MUC)-4与MMP-7基因分列高度上调的基因第一、二位,表明了这两种标记物与牙周炎症之间的强相关性,且后续研究[23]中,两因子联合对牙周炎症的诊断曲线下面积(area under the curve,AUC)为0.931,表现出很强的诊断效能。MMP-7和MUC-4可能共同参与炎症的过程,研究它们对PD的作用将有助于初探这些标志物对PD的潜在诊断能力。由于MMP-8是龈沟液中含量最丰富的胶原酶[10],是监测种植体周围状态最合适的生物标记物,在种植体周围炎症样本中的表达水平对疾病诊断有意义。本研究检测了种植体周围龈沟液(peri-implant crevicu‐lar fluid,PICF)中用于PD诊断的MMP-8、MMP-7、MUC-4生物标记物的水平。
1 材料和方法
1.1 研究对象
从2014年7月—2017年7月间在石河子大学第一附属医院口腔科接受后牙区种植义齿修复、负载2~5年的患者中选择63名受试者,入选对象满足以下纳入标准,并通过医院伦理委员会审核(伦理批件号:2019-095-02),研究前患者签署知情同意书。
纳入标准:1)实验前6个月未服用抗生素、钙通道阻滞剂、苯妥英钠、环孢菌素等药物;2)无影响种植体周病理改变的系统性疾病(糖尿病、骨质疏松症、关节炎、抑郁症等);3)每天吸烟<10支;4)有定期(半年/1年)进行龈上洁治的习惯。
排除标准:1)1年内行种植体周围疾病手术治疗;2)6个月内服用抗生素、钙通道阻滞剂、苯妥英钠、环孢菌素等药物;3)重度牙周炎;4)怀孕或哺乳期女性;5)为避免医源性因素的影响,排除有生物力学过载和粘接剂残留迹象的种植体支持修复体。
1.2 分组
参考2018年欧洲牙周病与植体周病新分类国际研讨会共识性报告[24],进行分组,具体如下。
1.2.1 PI组(n=24) 临床标准:1)植体周围软组织炎症,如脓液溢出、肿胀、疼痛等;2)探诊出血(bleeding on probing,BOP)阳性;3)探诊深度(pocket probing depth,PPD)较基线增加;4)PPD≥6 mm。种植体X线摄影检查标准:1)种植体周围骨丢失与初期愈合相比≥2 mm;2)存在进行性骨丧失。满足临床标准及X线片标准中任何一条即可。
1.2.2 对照组(n=39) 临床标准:1)种植体周围组织与正常牙周组织不存在明显区别;2)无BOP;3)PPD≤5 mm;4)PPD和基线对比无明显变化;5)种植体植入以来,无疼痛、无松动、无渗出物史。X线片表现:1)即使种植体周围PPD较深,牙龈乳头轻度退缩,但无种植体周围骨流失(或种植体周围骨流失较愈合初期<2 mm);2)可能存在过种植体周围牙槽骨吸收,但此时骨吸收处于静止状态,没有进行性骨丧失。
1.3 记录受试者的一般情况
经受试者知情同意,采用问卷调查法,对受试者的一般人口学资料、既往病史、家族史、生活方式、行为习惯等进行调查,并进行种植体状况检查和实验室检查。
1.4 种植体周围软硬组织评价
所有测量均由2名经验丰富的检查人员在校准后进行,证明PPD测量的95.7%一致性在“±1 mm”范围内。所有口腔内种植体的临床检查、测量均采用Hu-Friedy树脂探针,以“mm”为单位,对每个植体施加0.15 N·cm-1的力。在口腔内存在多个种植体的情况下,选择炎症情况下临床状况最差的种植体和健康情况下最易行探诊操作的种植体作为代表,记录每个种植体:1)6个位点的PPD,结果取6个位点均值;2)4个位点的BOP、牙龈指数(gingival index,GI)、改良菌斑指数(modified plaque index,mPLI),结果分别取4个位点的总和。
记录种植体周围骨水平变化:自基线(修复后即刻)至研究时间点拍摄的标准化全景放射照片,这一个周期间的植体边缘骨高度差异。种植体长度用于校正全景扭曲。
1.5 PICF的采集
取样之前,用无菌刮匙除去龈上菌斑,喷枪轻轻吹干植体颈部,隔湿,将尖端剪去2 mm的25号吸潮纸尖插入颊侧3个位点(近颊、颊面中央、远颊)的龈沟内,存在轻微阻力则停止,每间隔10 s插入下一个位点,放置30 s后取出吸潮纸尖(丢弃被血液染色、唾液污染的样本,另选其他种植体);间隔30 s后,按上述方法在舌侧作一次(近舌、舌面中央、远舌位点),然后将6条吸潮纸尖置于EP管中,-80℃冷冻保存。
1.6 样本检测
所有样本于同一日测试,实验前将保存于-80℃的PICF样本于室温下解冻,加入PBS缓冲液(pH=7.4),室温下震荡1 h。使用高速离心机以10 000 r·min-1在4℃离心10 min,取离心后的上清液分装于另外3个洁净的EP管中,登记编号。用MMP-7、MUC-4、MMP-8试剂盒测定其中MMP-7、MUC-4和MMP-8的含量。使用酶标仪(Biotek公司,美国)进行读数,波长设置为450 nm,校正设置为540 nm,以减去背景。低于检测限的样品设为0。
1.7 统计学分析
采用SPSS 23.0软件进行统计学分析,计量资料服从正态分布则采用均数±标准差表示,组间比较采用方差分析,两两比较采用LSD法;不服从正态分布采用中位数和四分位间距表示,组间比较采用非参数秩和检验;计数资料以频数和百分比表示,组间比较采用卡方检验或非参数秩和检验;指标间的相关性采用Spearman相关分析;采用ROC曲线分析MMP-8、MMP-7、MUC-4及其三者间对种植体周围炎症的诊断价值;检验水准为α=0.05,P<0.05差异具有统计学意义。
2 结果
2.1 一般情况
按照研究对象的纳入排除标准收集63名患者的基本信息,PI组男性13名(54.2%),女性11名(45.8%),平均年龄(49.08±12.41)岁;健康组男性22名(56.4%)和女性17名(43.6%),平均年龄(50.72±11.94)岁。统计分析显示,2组受试者年龄、性别等基本情况差异无统计学意义。PI组受试者的PPD水平大于对照组(P<0.001),BOP、GI的构成比在2组中差异均具有统计学意义(P<0.05);mPLI的构成比在2组中差异无统计学意义,具体情况见表1。

表1 组间数据对比Tab 1 The comparison between groups
2.2 MMP-7、MUC-4和MMP-8在PICF中的水平
MMP-7、MMP-8、MUC-4数值为计量资料,数据经正态检验,服从正态分布,故使用两独立样本的t检验。PI组和对照组MMP-7的测量结果分别为(20.27±6.16)、(16.67±3.19)pg·mL-1,MMP-8的 测量 结 果 分 别为(36.29±11.43)、(19.68±10.33) pg·mL-1,MUC-4的 测 量 结 果 分 别 为(3.11±1.51)、(5.79±3.31)pg·mL-1,PI组中MMP-7和MMP-8的表达水平高于对照组(t=-2.581,P<0.05;t=-5.882,P<0.001),但MUC-4的表达水平低于对照组(t=4.377,P<0.001)(图1)。

图1 PI组和对照组PICF样本中MMP-7、MMP-8和MUC-4的表达水平Fig 1 The level of MMP-7,MMP-8 and MUC-4 in PICF sam‐plesfrom patientswith peri-implantitisand control group
2.3 MMP-7、MMP-8和MUC-4水平与种植体周围探诊指数的相关性
样本中MMP-7的水平与PPD呈显著正相关(r=0.451,P<0.001);样本中MMP-8的水平与PPD(r=0.619,P<0.001)、BOP(r=0.478,P<0.001)、GI(r=0.332,P=0.009)呈正相关;样本中MUC-4的水平与PPD(r=-0.492,P<0.001)、BOP(r=-0.321,P=0.010)、GI(r=-0.396,P=0.001)呈负相关(表2)。

表2 MMP-7、MMP-8和MUC-4与临床指标的相关系数Tab 2 Coefficient of correlation between clinical parameters and MMP-7,MMP-8 and MUC-4
2.4 ROC曲线分析
MMP-7、MMP-8、MUC-4对PI组均具有一定的诊断效能,其中MMP-8对PI组的诊断效能最好,当MMP-8>21.21时,AUC为0.868,诊断PI的灵敏度为0.96,特异度为0.68;当MMP-7>21.56时,AUC为0.668,诊断PI的灵敏度为0.46,特异度为0.92;当MUC-4≤4.58时,AUC为0.772,诊断炎症的灵敏度为0.91,特异度为0.56;MMP-7、MUC-4并联诊断模型的诊断效能高于两种因子单独诊断,模型对炎症的诊断灵敏度为0.96,特异度为0.56(表3,图2)。
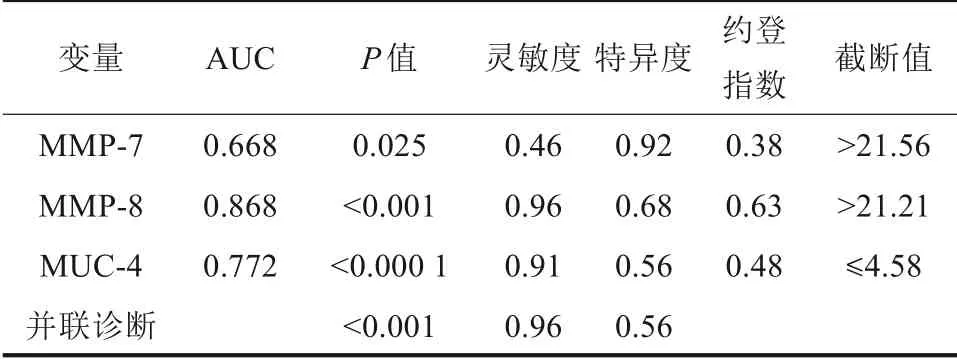
表3 ROC曲线分析MMP-7、MMP-8、MUC-4诊断炎症效能Tab 3 ROC analysis of MMP-7,MMP-8,MUC-4 in the diagnosis of inflammation

图2 ROC曲线分析MMP-7、MMP-8、MUC-4诊断炎症效能Fig 2 ROC analysis of MMP-7,MMP-8,MUC-4 in the diagno‐sis of inflammation
3 讨论
PD是一种多因素疾病,多种因素累加会加速炎症的进程。了解健康组织与炎症部位之间的免疫学差异,了解哪些因素与软组织炎症及骨质的流失相关很重要。本研究评估了PD患者PICF中MMP-7和MUC-4的水平。研究发现,相较对照组,PI组中的MMP-7水平升高,差异有统计学意义(P<0.05),提示MMP-7的表达可能随着炎症成分的增加而升高,说明检测PICF中的MMP-7可能提供一种鉴别炎症和对照组的诊断能力;其可能机制为:在牙周疾病中,牙周致病菌的脂多糖及其毒力因子可触发宿主吞噬细胞产生活性氧,引发牙周组织破坏级联反应,体外研究表明髓过氧化物酶可以利用活性氧,如过氧化氢利用活性氧生成次氯酸,次氯酸将pro-MMP-7转化为有活性的MMP-7[25-26],这一机制从一个角度解释了在PI组样本PICF中发现的MMP-7表达升高现象,说明MMP-7可能在PD的活动期起作用。本研究在相关性分析中发现MMP-7与PPD呈正相关(r=0.451,P<0.001),这与其他研究[27-28]结果一致,即MMP-7水平随着牙周病中PPD、牙齿松动和临床附着丧失等病变的进展而增加。本研究中AUC为0.668,结合组间比较结果后,判断MMP-7的诊断效能尚可。基于以上研究,MMP-7可以作为监测PD发生发展的一个参考指标,与PD的关系还有较大的探索空间。
本研究中,对照组的MUC-4水平高于PI组(P<0.001),与先前报道[23]关于牙周炎样本龈沟液和唾液中MUC-4水平下调的结果部分一致。PI组中MUC-4水平降低,可能导致凝集和清洁口腔病原体的能力降低,加速在牙齿上形成生物膜,持续PD患者的炎症反应。本研究中MUC-4与指数PPD、GI、BOP呈负相关(P<0.05),说明随着种植体周围炎症程度的加深,MUC-4的量下降。研究[29]发现,PPD与MUC-4的降低呈正相关,两研究间研究结果存在差异,其可能原因为纳入研究中的大部分人群常常还未等到炎症发展至中晚期便接近了随访时间,此时仅有探诊出血的出现,并不存在探诊深度的加深,因此预期MUC的分泌水平不会随着PPD而增加。焦鹏[30]对牙周治疗术前、术后的受试者进行了龈沟液和血清中的MUC-4水平测定,MUC-4水平受牙周状态影响,进行完善的牙周治疗后,随着牙周状况的改善,MUC-4在血清及龈沟液中的水平有所回升。提示MUC浓度的增加意味着口腔防御行为的发生。本研究中MUC-4的AUC为0.772,结合组间比较,MUC-4是种植体周围炎发生的一个负向影响因素,也可作为炎症诊断时的一个参考指标。
本研究选择MMP-8作为参照物,因为它突显出了很高的生物学潜能。有研究者[31]建议使用MMP-8检测作为唯一的诊断测试。它在PI组中的水平较对照组高(P<0.001),与此前研究[32]结果基本一致,在牙周炎和种植体周围炎的背景下,口腔液体如唾液、龈沟液和PICF中的MMP-8浓度增加到病理水平;结合MMP-8与牙周探诊指数的显著正相关结果来看,再次验证了MMP-8可以作为判断种植体周围组织状态的客观指标这一结论。本研究的ROC诊断实验中,MMP-8的AUC为0.868,灵敏度为0.96、特异度为0.68,在3个因子中体现出了最高的诊断效能。
本研究中,PI组MMP-7和MMP-8水平均升高,与其他研究[21]一致,MMP-7能激活pro-MMP-8,潜在地促进疾病进展,可能原因为炎症状态下牙周组织内的活性氧不仅可以激活与牙周组织破坏相关的主要MMP,即MMP-8和9,还可以激活MMP-7,并且MMP-7可进一步增强这种MMP激活网络[25-26],MMP-7可以激活其他MMP的前体(pro-MMP-8和9),从而增强蛋白水解级联反应[33];由此推想,在牙周、种植体周围疾病的进展过程中,MMP-7与MMP-8可能存在协同作用。
牙周炎中上调的基因主要与炎症、对创伤的反应和细胞凋亡有关,研究[23,30]证明,牙周炎患者的牙龈组织、血清、龈沟液中MMP-7、MUC-4的水平与健康组差异有统计学意义(P<0.05),且随着牙周炎症程度的加重,MMP-7的水平上升,MUC-4的水平下降。实施牙周治疗后,MMP-7的水平回落,MUC-4的水平回升,趋向于健康状态,说明它们与牙周疾病的炎症有一定的相关性,具体发病机制不明[30]。本研究中MMP-7水平随PPD的加深而增加,MUC-4的水平随着PPD的加深而下降,与先前研究结果一致,两者均与PPD有相关性,两者可以反映PD的进展,有作为监测PD发生发展标志物的潜力。MMP-7、MUC-4两者联合诊断的灵敏度为0.96,特异度为0.56,比各自单独诊断的效能有所提升,并未达到此前牙周炎研究中的水平,不过也体现出了一定的诊断价值,可以为后续相关研究提供一些参考。
相较此前同一种类的研究,本研究只采集了患者的PICF样本,考虑到唾液中不同种类的蛋白较多,可能影响对PICF中相对低浓度的MMP-7、MUC-4的监测,并未采集唾液进行研究;考虑到成本、受试者依从性等问题,并未采集到血清样本。本研究中MMP-7、MUC-4联合没有此前牙周炎研究[23]中的诊断效能突出,可能影响因素有代表性不强、混杂因素在两组中分布不均、检测方法有限等。但若研究条件发生了变化,如进行更大样本量、多中心、前瞻性的分期研究也许两者可以体现出更多的诊断价值。
利益冲突声明:作者声明本文无利益冲突。
