气质串联测定茶叶与土壤中联苯菊酯和溴虫腈残留
2022-02-14余霞奎李红莉白俊慧
余霞奎 李红莉 白俊慧



摘要 [目的]建立茶叶与土壤中同时测定联苯菊酯、溴虫腈农药的气质串联分析方法。[方法]茶叶或土壤样品经过加适量水充分浸润,乙腈提取,饱和氯化钠溶液分相初步净化,十八烷基小柱进一步除杂,氮吹浓缩定容后进样测试。[结果]2种农药的3个浓度水平的平均加标回收率为76.2%~86.7%,相对标准偏差(RSD)为5.8%~9.8%(n=6)。[结论]该方法操作相对简单省时,具有良好的灵敏度、准确度和精密度,完全能满足实验室农药残留限量检测需要,非常适合茶园对联苯菊酯、溴虫腈用药后的跟踪监测。
关键词 气质串联;茶叶;土壤;联苯菊酯;溴虫腈;农药残留
中图分类号 S 481+.8;TS 272.7 文献标识码 A 文章编号 0517-6611(2022)01-0200-03
doi:10.3969/j.issn.0517-6611.2022.01.054
Determination of Bifenthrin and Chlorfenapyr Residues in Tea and Soil by GC-MS
YU Xia-kui, LI Hong-li, BAI Jun-hui
(Experimental Center of Hangzhou Academy of Agricultural Sciences, Hangzhou, Zhejiang 310024)
Abstract [Objective]To establish a tandem analysis method for the simultaneous determination of bifenthrin and chlorfenapyr pesticides in tea and soil.[Method]Tea or soil samples were fully infiltrated with appropriate amount of water, extracted with acetonitrile, the saturated sodium chloride solution was purified by phase separation, further impurity removal by octadecyl SPE column,and nitrogen blowing concentration, solubilization, constant volume, and then injection test. [Result] The average recovery rates of the two pesticides at the three concentration levels were 76.2%-86.7%, and the relative standard deviation (RSD) was 5.8%-9.8%(n=6).[Conclusion]The method is relatively simple and time-saving, and has good sensitivity, accuracy and precision. It can fully meet the requirements of laboratory pesticide residue limit detection. It is very suitable for tracking and monitoring of bifenthrin and chlorfenapyr pharmacy in tea garden.
Key words GC-MS;Tea;Soil;Bifenthrin;Chlorfenapyr;Pesticide residues
基金項目 杭州市农业科学研究院科技创新与示范推广基金项目(2021HNCT-13)。
作者简介 余霞奎(1976—),男,浙江淳安人,高级工程师,从事农产品质量安全研究。
收稿日期 2021-04-22
我国是茶叶的故乡,中华民族对茶叶的饮用可以追溯到东汉时期,至今已有 3 000年的历史。截至目前,我国共有 19 个省份生产茶叶,主要分为江北、江南、西南和华南四大茶区[1]。为防治虫害,茶农会向茶叶中添加多种农药,如有机氯、有机磷和拟除虫菊酯类等。长期饮用含有残留农药的茶叶,农药被人体吸收后,可以分布到神经突触和神经肌肉接头处,直接损害神经元,导致神经系统的功能出现紊乱,使身体各器官的免疫力下降。残留的农药中常含有甲醛、硫、磷、氟、溴等化学物质,严重时可导致组织细胞发生癌变,从而引发癌症[2-4]。
联苯菊酯具有很强的触杀和胃毒作用,无内吸、熏蒸作用,广泛用于防治棉花、果树、茶树、蔬菜等作物上的鳞翅目幼虫,粉虱、蚜虫、瘿螨等害虫、害螨;联苯菊酯的杀虫谱广,作用迅速,在土壤中不移动,对环境较为安全,持效期较长[5]。
溴虫腈为结构新型的吡咯类杀虫剂,对鳞翅目、同翅目、鞘翅目等70余种害虫有良好防效,尤其对蔬菜抗性害虫中的小菜蛾、甜菜夜蛾、斜纹夜蛾等效果很好[6-8];溴虫腈在我国主要登记在甘蓝、芥蓝、茄子、黄瓜、苹果、茶树、杨树等作物上。
目前实验室参考使用的茶叶或土壤中联苯菊酯、溴虫腈常用的检测方法普遍存在烦琐耗时、步骤繁多、效率低下、试剂毒性、消耗量和环境影响大,或者不能兼顾2种农药,或者杂质干扰多、灵敏度差。该研究采用乙腈提取、饱和氯化钠溶液分相粗略净化,十八烷基小柱进一步除杂净化,氮吹浓缩定容后进样测试,采用气相色谱-串联质谱法MRM模式、外标法对样品联苯菊酯、溴虫腈进行定量。
1 材料与方法
1.1 仪器与试剂
Agilent 7890A-7000B气相色谱-串联质谱仪(GC/MS Triple Quard);Agilent DB-5MS色谱柱(30 m×0.25 mm,0.25 μm);
METTLER电子天平(感量0.01和0.000 1 g);Eppendorf 5810台式离心机;IKA磁力搅拌器和漩涡混匀器;eppendorf 20~200 μL、100~1 000 μL、Thermo 1~5 mL移液器。
标准物质溶液:联苯菊酯、溴虫腈,浓度各100 μg/mL(农业农村部环境保护科研监测所)。
乙腈(色谱纯,Fisher Chemical公司);乙酸乙酯(HPLC级,Thermo Fisher 公司);氯化钠(分析纯,国药集团)。
50 mL具盖塑料离心管;10 mL玻璃刻度离心管;15 mL塑料离心管;Thermo HyperSep C18小柱(规格1 g/6 mL)。
1.2 样品制备与前处理
1.2.1 试样的制备。
茶叶鲜叶:将新鲜茶叶充分拌混均匀后,取适量研磨或粉碎制备成检测样品。
茶叶干茶:将新鲜茶叶充分拌混均匀后,取适量鲜叶经微波杀青后置于鼓风干燥箱70 ℃烘干制备成检测干茶,再取适量干茶研磨或粉碎制备成检测样品。
土壤:剔除石块、植物枝叶等其他非泥固体后,捣成小块后混匀,制备成检测样品。
取捣匀后的空白检测样,作为空白试样;取捣匀后的空白检测样并添加适宜浓度的标准工作液,作为空白添加试样。
1.2.2 提取。
称取样品(干茶叶2.0 g,加水10 mL,鲜茶叶和土壤4.0 g,均加水8 mL)于50 mL具盖塑料离心管中,放入一颗陶瓷均质子,充分涡漩30 s,浸润30 min,而后加入20.0 mL乙腈,加入2.0 g硫酸镁、0.5 g氯化钠,涡漩30 s,超声提取30 min,4 200 r/min离心5 min,上清液小心转入另一预装有约4 g氯化钠的50 mL塑料具塞离心管中,盖紧后剧烈振荡2 min,轻微开盖,在室温下静置20 min,使乙腈相和水相充分分层。
1.2.3 净化。
从静置分层的50 mL塑料具塞离心管中准确吸取10.00 mL上层乙腈溶液于10 mL玻璃刻度离心管中,待过HyperSep C18柱净化。
将HyperSep C18柱先用约5 mL乙腈溶剂预淋(弃去预淋洗溶液),当溶剂液面到达柱吸附层表面时,立即加入刚才的待净化样品溶液,并用50 mL塑料离心管接收洗脱液。用4 mL乙腈溶剂将待净化液的离心管涮洗后淋洗小柱,并重复1次。将搜集淋洗液的离心管水浴50 ℃氮吹至近干(微带湿润),加乙酸乙酯准确定容,干茶样至1.0 mL,鲜茶叶和土壤至2.0 mL,漩涡混匀后转移至进样小瓶,供测。
1.3 标准溶液配制
将100 μg/mL联苯菊酯、溴虫腈标准物质溶液原液各自用乙酸乙酯稀释配制成20 μg/mL的标准物质中间储备液,再用乙酸乙酯配制成1.0 μg/mL的联苯菊酯与5.0 μg/mL溴虫腈浓度配比的混合标准溶液,接着用乙酸乙酯逐级稀释,配制成浓度分别为 0.01、0.02、0.04、0.05、0.10、0.20 μg/mL的联苯菊酯和0.05、0.10、0.20、0.25、0.50、1.00 μg/mL的溴虫腈系列混合标准溶液。
1.4 气相色谱质谱条件
1.4.1 气相色谱参考条件。
进样口温度250 ℃;柱温60 ℃保持1 min,30 ℃/min升至120 ℃,再以6 ℃/min升至290 ℃,300 ℃反吹5 min。载气为高纯He,流速1.0 mL/min;进样量1.0 μL,进样方式为不分流进样;色谱柱为DB-5MS柱(30 m×0.25 mm×0.25 μm)。
1.4.2 质谱参考条件。
传输线温度280 ℃;电离方式为电子电离源(EI);离子源温度230 ℃;四级杆MS1、MS2温度为150 ℃;溶剂延迟5 min;扫描模式为多反应监测(MRM)。其他条件见表1。
2 结果与分析
2.1 色谱/质谱参考条件优化
色谱部分:参考一般农药残留检测的气质串联方法的气相部分即可,使目标物尽可能相互分离,检测耗时尽可能短,系统污染尽可能少。
质谱部分:仪器通用条件参考一般农药残留检测的气质串联方法的质谱部分,联苯菊酯的MRM离子监测方式一方面参考GB 23200.113—2018方法中的联苯菊酯离子参数[9],另外和溴虫腈同时采用G9250AA-Agilent农药和环境污染物MRM数据库推荐的待測化合物3对离子对,其中1对离子对用于定量分析,另外1~2对离子对用于定性分析。根据试验色谱质谱条件,确定每种化合物的保留时间、离子对、最优碰撞能量、相对离子丰度比[10]。
2.2 样品前处理条件优化
乙腈作为普遍使用的农药残留分析提取溶剂,实践应用中的适用性是非常理想的,该研究直接就确定用乙腈作为提取溶剂,并参考农药残留检测方法的常用提取操作方式。
茶叶基质非常复杂,含有大量的色素、咖啡碱、茶多酚等,土壤成分则含有较多的不溶微粒和有机质,如果仅采用QuEChERS方法的吸附净化,效果很难理想,样品极易污染仪器系统,后续的仪器维护工作量也很大,因此有必要用SPE小柱净化。该研究比较了前处理常用的SPE小柱如Florisil柱、活性炭柱、NH2氨基柱、十八烷基柱等的回收和净化效果,用茶叶空白基质溶液配制成相同浓度的基质标液,分别经过不同的SPE小柱,结果表明,活性炭柱对2种目标农药的吸附均较强,导致回收率都低于40%,其余小柱对2种目标农药的吸附均较弱,回收率均高于70%,但十八烷基柱的整体净化效果更为理想,背景干扰相对更少。
2.3 基质效应
基质效应是指样本中除被测分析物以外的杂质,显著干扰到被测目标物的定性、定量结果准确性的特征。基质效应在农药残留检测过程中极为常见,不同样品、目标物及分析设备的表现不同。按照该试验茶叶、土壤的前处理获得空白基质,配制联苯菊酯、溴虫腈的基质标样与纯溶剂标样比较,发现联苯菊酯、溴虫腈的基质效应均在81.2%~113.0%,亦即这2种农药基质效应并不显著,如果没有足够的空白基质,可以不必基质匹配标准溶液进行定量分析。
2.4 方法准确度(回收率)、精密度(RSD)试验
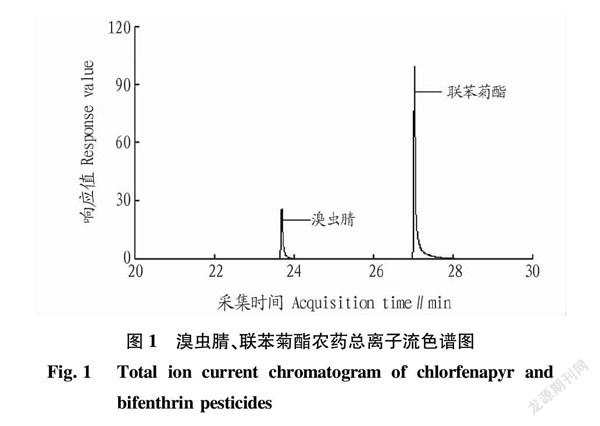
按照“1.2.2”准确称取目标物无干扰的空白样品于50 mL塑料具塞离心管中,分别不添加或添加低、中、高不同浓度的联苯菊酯、溴虫腈农药标准溶液制备成空白样或空白加标样,经上述方法提取和净化后,测得6组平行试验的统计结果见表2,联苯菊酯、溴虫腈农药混合标准样品0.05 ng/μL浓度总离子流色谱图见图1,联苯菊酯3组离子对响应值对比见图2,溴虫腈3组离子对响应值对比见图3。从表2的试验统计结果可以看出,各个浓度梯度加标回收试验的平均回收率均在76.2%~86.7%,表明该方法准确度(回收率)可行;所有平行结果间的相对标准偏差(RSD)均在5.8%~9.8%,表明该方法精密度(重复性)良好,且均能符合相应浓度对检测方法的技术要求[11]。
2.5 方法灵敏度(检出限、定量限)试验
配制联苯菊酯系列浓度0.01、0.02、0.04、0.05、0.10、0.20 μg/mL的标准工作溶液,以及溴虫腈系列浓度0.05、0.10、0.20、0.25、0.50、1.00 μg/mL的标准工作溶液,在“1.4”色谱条件和质谱条件下进行测定,联苯菊酯线性方程为y=291 958.078 2x-1 041.519 2(R2=0.998),溴虫腈线性方程为 y=21 396.816 9x-1 311.369 6(R2=0.992)。根据仪器响应的信噪比及方法的浓缩比进行测算,并经实际测试验证,该方法中,茶叶和土壤基质中联苯菊酯的检出限均为0.001 mg/kg、定量限均为0.003 mg/kg,溴虫腈的检出限均为0.01 mg/kg、定量限均为0.03 mg/kg。
2.6 样品实际分析试验
将该方法应用于对少量茶树进行联苯菊酯、溴虫腈预备性用药试验后的动态跟踪监测,分析测试了5个鲜茶叶、5个干茶叶、3个土壤,实测浓度为联苯菊酯0.52~10.10 mg/kg、溴虫腈2.61~30.70 mg/kg。
3 结论
从以上结果分析可以得知,该方法在显著节约时间和试剂消耗的基础上,完全能够满足日常的鲜茶叶、干茶叶和土壤中联苯菊酯、溴虫腈农药残留量的跟踪监测需要,可以极大地提高大批量检测鲜茶叶、干茶叶和土壤中联苯菊酯、溴虫腈农药残留量的工作效率。
另外,添加的目标物与样品中原有的目标物提取效果会有差异,因为添加物较原有物通常可能相对更容易提取出来,这些可能需要检测技术人员根据质控试验和经验积累来进行适当修正,使实际测得结果和样品中真实浓度能够更为接近。
参考文献
[1] 姜佳敏,王萱,徐嘉聪,等.海岛火山茶种植区气候土壤条件对茶树生长及茶叶品质的影响[J].浙江农业科学,2021,62(4):666-674.
[2] 曹艳平,杨路平,邵立君.气相色谱-质谱法测定茶叶中 23 种农药残留量[J].理化检验(化学分册),2015,51(5):647-650.
[3] 何艳芬,穆筱梅,郭晓丽,等.农药残留的检测[J].广东化工,2009,36(3):122-125.
[4] 吴迪,罗雪婷,潘洪吉,等.气相色谱法测定黄瓜、苹果中的溴虫腈残留量[J].食品科学,2010,31(10):268-271.
[5] 李新.拟除虫菊酯类杀虫剂研发及市场概况[J].农药,2016,55(9):625-630.
[6] YUAN J Z,LI Q F,HUANG J B,et al.Effect of chlorfenapyr on cypermethrin-resistant Culex pipiens pallens Coq mosquitoes[J].Acta tropica,2015,143:13-17.
[7] RAGHAVENDRA K,BARIK T K,BHATT R M,et al.Evaluation of the pyrrole insecticide chlorfenapyr for the control of Culex quinquefasciatus Say[J].Acta tropica,2011,118(1):50-55.
[8] 孫国强,陆贻通.溴虫腈农药的作用机理、应用及开发前景[J].安徽农学通报,2007,13(7):69-71.
[9] 中华人民共和国国家卫生健康委员会,中华人民共和国农业农村部,国家市场监督管理总局.食品安全国家标准 植物源性食品中208种农药及其代谢物残留量的测定 气相色谱-质谱联用法:GB 23200.113—2018[S].北京:中国标准出版社,2018:12.
[10] 张云,李登昆,刘祥萍,等.气相色谱-三重四极杆质谱法结合QuEChERs前处理同时测定茶叶中三氯杀螨醇、溴虫腈、6种拟除虫菊酯类农药[J].环境与职业医学,2020,37(8):812-817.
[11] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.实验室质量控制规范 食品理化检测:GB/T 27404—2008[S].北京:中国标准出版社,2008:26.
