基于网络药理学和分子对接技术探讨柴胡-黄芩药对治疗癌性发热的作用机制▲
2022-02-13谢虹亭谢飞宇龙思丹陈美池朱世杰
谢虹亭 谢飞宇 龙思丹 陈美池 薛 鹏 朱世杰
(1 北京中医药大学研究生院,北京市 100029;2 中国中医科学院望京医院肿瘤科,北京市 100102)
癌性发热是中晚期癌症患者常见的并发症之一,以持续低热、反复难愈为主要临床特点。发热会引起患者身心不适,严重影响患者的生活质量、营养状况及治疗效果。癌性发热是除感染外导致癌症患者体温升高的主要原因,在癌症相关性发热中占比高达41%[1]。癌性发热是由癌症本身引起的副肿瘤综合征,特指非感染性发热,其发病机制尚未完全明确。有学者认为癌性发热是由坏死的癌细胞和骨髓细胞释放的白细胞介素(interleukin,IL)、肿瘤坏死因子(tumor necrosis factor,TNF)、干扰素等细胞因子造成下丘脑体温调节中枢功能紊乱所致[2]。西医常用糖皮质激素或非甾体抗炎药对症治疗,这些药物虽然起效快,但药效持续时间短、发热易复发,还会引起胃肠道功能紊乱、肝肾功能损害等不良反应,不利于癌症患者的长期预后[3]。
中医的“整体观”“辨证论治”和中药的“多成分””多靶点”在癌性发热治疗中具有独特优势,能提高患者的生活质量[4]。癌性发热属于中医内伤发热病范畴,其基本病机是脏腑功能失调、气血阴阳失和。对于癌症患者,体内癥积影响气血运行,瘀血、痰湿、癌毒蕴郁而生,此类癥积产物导致气机升降失调、阴阳开合失司,因而发热。少阳胆为脏腑之枢,与肝共调全身气机升降;少阳三焦为气血津液之枢,乃营卫气血运行之通道也。因此,癥积引起的少阳枢机不利可用和解之法,解郁积、和阴阳,使阴平阳秘,癌热自消。小柴胡汤是和解少阳法的代表方剂,柴胡与黄芩是其核心药对。有文献报告以柴胡类方为代表的和解少阳法是治疗癌性发热的基本方法[5]。一项基于数据挖掘的癌性发热中医用药规律研究表明,柴胡-黄芩药对使用的支持度高达到32.52%[6]。可见柴胡和黄芩被广泛用于治疗癌性发热。但目前系统地阐释柴胡-黄芩药对治疗癌性发热的活性成分和作用机制的研究仍较少。网络药理学是以系统生物学和网络生物学为基础[7],从整体水平研究“药物-靶点-疾病”的复杂网络关系,进而指导新药研发及药理作用研究,其整体性和系统性与中医整体观和辨证论治不谋而合[8]。因此,本研究基于网络药理学和分子对接技术,探讨柴胡-黄芩药对治疗癌性发热的活性成分和作用机制,为进一步药理实验研究和临床应用提供理论依据。
1 材料与方法
1.1 柴胡-黄芩药对的活性化学成分及其相关靶点的筛选 在中药系统药理学数据库与分析平台(Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform,TCMSP;https://old.tcmsp-e.com/molecule.php)检索“柴胡”和“黄芩”两味中药的化学成分,并设置口服生物利用度(oral bioavailability,OB)≥30%、药物相似性(drug likeness,DL)≥0.18初步筛选活性化学成分,然后在该平台上检索活性化学成分对应的靶点,剔除无靶点的化学成分,获得柴胡、黄芩的活性化学成分及其对应靶点[9]。最后,在UniProt数据库(https://www.uniprot.org)中,将限定物种设置为人类,再对靶点进行标准基因名转换[10]。
1.2 癌性发热相关靶点的筛选 以“cancerous fever”和“neoplastic fever”为关键词,在GeneCards®数据库[11](https://www.genecards.org)、OMIM®数据库[12](http://www.omim.org)和TTD数据库[13](http://bidd.nus.edu.sg/group/cjttd)中进行癌性发热相关靶点的搜索,搜索时间为2000年1月1日至2022年1月1日。若GeneCards®数据库中靶点过多,则设定其“Score值”的中位数为阈值,筛选出大于阈值的疾病相关靶点作为目标靶点。综合3个数据库的靶点结果并删除重复项以获得最终的疾病相关靶点。
1.3 柴胡-黄芩药对治疗癌性发热相关靶点的获取及其蛋白质-蛋白质相互作用网络的构建 将柴胡、黄芩活性化学成分的相关靶点与癌性发热相关靶点上传Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)绘制韦恩图,从而获得交集靶点,即柴胡-黄芩药对治疗癌性发热的相关靶点。将交集靶点上传至STRING 11.0数据库(https://string-db.org),构建其蛋白质-蛋白质相互作用(protein-protein interaction,PPI)数据[14],然后使用CytoScape 3.7.2软件制作PPI网络图[15]。利用CytoScape 3.7.2软件中的MCODE插件,根据默认的紧密联系参数推测潜在蛋白质功能模块,并通过Metascape数据库分析模块中靶点参与的生物学进程,将其结果根据LgP进行由小到大排序,且以P≤0.01为筛选条件,选取符合条件的前3位生物学进程对其功能进行描述[16]。
1.4 交集靶点的功能富集和通路富集分析 基于Metascape平台(http://metascape.org/gp/index.html)对交集靶点进行基因本体论(Gene Ontology,GO)功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。GO功能富集分析包括生物过程、分子功能和细胞成分。将各分析结果根据P值进行由大到小排序,且以P≤0.01为筛选条件,选取符合条件的前20位GO功能、KEGG通路。运用微生信平台(http://www.bioinformatics.com)实现筛选结果的可视化。
1.5 药物成分-交集靶点-通路网络图的构建 将柴胡和黄芩的活性化学成分、交集靶点及筛选的前20条KEGG通路上传到CytoScape 3.7.2软件中,构建药物成分-交集靶点-通路网络图。利用CytoScape 3.7.2软件内置的Network Analyzer计算度值、介度值及紧密度值等拓扑参数,并根据度值进行由大到小排序,推断排名前5的药物活性化学成分、交集靶点和KEGG通路为柴胡-黄芩药对治疗癌性发热的核心活性化学成分、核心靶点和核心通路。
1.6 分子对接 将1.5得出的网络中排名前5的交集靶点作为受体蛋白,排名前5的药物活性化学成分作为配体蛋白。首先在RCSB-PDB数据库(https://www.rcsb.org/)中获取上述蛋白的“PDB”格式,并在TCMSP数据库下载5种药物成分的“MOL2”格式。利用AutoDock 1.5.6软件对受体蛋白及配体蛋白进行去水、加氢、计算电荷及寻找可旋转化学键等处理,再根据受体蛋白及配体蛋白大小设置合适的对接盒子,并使用“Genetic Algorithm”算法进行分子对接,最后在Pymol中进行可视化分析。
2 结 果
2.1 柴胡-黄芩药对的活性化学成分及相关靶点 基于TCMSP数据库,初步得到17种柴胡活性化学成分和36种黄芩活性化学成分,剔除无靶点的化学成分后,最终筛选出42种活性化学成分,其中豆甾醇为柴胡与黄芩的共同成分,故最终获得12种柴胡活性化学成分和31种黄芩活性化学成分,见表1。柴胡活性化学成分的相关靶点157个,黄芩活性化学成分的相关靶点80个,合并后删除重复值共得到相关靶点178个。

表1 柴胡-黄芩药对的主要活性化学成分
2.2 柴胡-黄芩药对治疗癌性发热相关靶点 从GeneCards®数据库获得癌性发热相关靶点7 142个,选择Score值≥10.37的靶点,最终获得1 145个癌性发热相关靶点。结合在OMIM®数据库、TTD数据库中获取的相关靶点,去重后合并,最终得到1 562个癌性发热相关靶点。通过绘制韦恩图,将178个主要活性化学成分相关靶点与1 562个癌性发热相关靶点取交集,共获得98个交集靶点,即柴胡-黄芩药对治疗癌性发热的相关靶点,见图1。

图1 柴胡-黄芩药对活性化学成分相关靶点与癌性发热相关靶点的韦恩图
2.3 柴胡-黄芩药对治疗癌性发热相关靶点的PPI网络 利于STRING 11.0及CytoScape 3.7.2构建柴胡-黄芩药对治疗癌性发热相关靶点的PPI 网络,见图2。运用CytoScape 3.7.2中的 MCODE 插件推测出PPI网络中的2个潜在蛋白质功能模块,见图3。使用Metascape数据库对潜在蛋白质功能模块中的靶点进行生物学进程分析,根据P值的对数值,保留模块中前3位的生物学进程并描述其功能。见表2。

图2 柴胡-黄芩药对治疗癌性发热相关靶点的PPI网络

图3 PPI网络中的潜在蛋白质功能模块

表2 PPI网络中潜在蛋白质功能模块的功能
2.4 柴胡-黄芩药对治疗癌性发热相关靶点的功能富集和通路富集结果 基于Metascape数据平台,对交集靶点进行GO功能富集分析(P≤0.01),得到1 730个生物过程条目、111个分子功能条目、72个细胞成分条目;进行KEGG通路富集分析(P≤0.01),得到291个KEGG通路。根据P值从大到小排序,分别取4种富集分析结果的前20个条目,利用作图平台进行可视化,见图4。其中,生物过程条目以对脂多糖、细菌、细菌源和脂质等的应答,以及对凋亡信号通路、血管形态形成等的调控为主;分子功能条目则以蛋白激酶结合、激酶结合和转录因子结合等为主;细胞成分条目主要涉及膜微区、膜筏、囊泡腔和细胞外基质等;KEGG通路涉及癌症相关通路、肝炎通路、TNF信号通路、细胞凋亡通路和IL-17信号通路等,其中癌症通路中包含膀胱癌、前列腺癌、胰腺癌等。
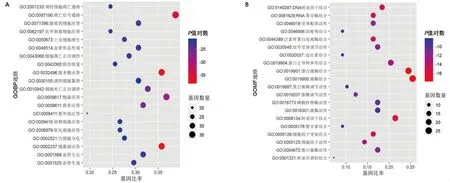
图4 柴胡-黄芩治疗癌性发热相关靶点靶点的功能和通路富集分析气泡图
2.5 药物成分-交集靶点-通路网络图 运用CytoScape 3.7.1构建药物成分-交集靶点-通路网络图(图5)后,通过CytoScape 3.7.1内置的Network Analyzer分析柴胡-黄芩药对治疗癌性发热网络拓扑学参数,推测柴胡的檞皮素(度值为0.63,介度值为83,紧密度值为0.40)、山奈酚(度值为0.43,介度值为28,紧密度值为0.40)、异鼠李素(度值为0.39,介度值为13,紧密度值为0.01),以及黄芩的汉黄芩素(度值为0.40,介度值为15,紧密度值为0.01)和黄芩素(度值为0.40,介度值为15,紧密度值为0.01)为柴胡-黄芩药对治疗癌性发热的核心活性化学成分。
前列腺素内过氧化物合成酶(prostaglandin endoperoxide synthase,PTGS)2(度值为0.50,介度值为34,紧密度值为0.11)为柴胡-黄芩药对治疗癌性发热的核心靶点,同时PTGS1(度值为0.48,介度值为24,紧密度值为0.05)、丝氨酸蛋白酶1(serine protease 1,PRSS1;度值为0.48,介度值为23,紧密度值为0.05)、Caspase-3(度值为0.47,介度值为21,紧密度值为0.02)、蛋白激酶Bα(protein kinase Bα,AKT1;度值为0.46,介度值为21,紧密度值为0.01)亦为柴胡-黄芩药对治疗癌性发热重要靶点。
柴胡-黄芩药对主要通过癌症相关通路(度值为0.48,介度值为52,紧密度值为0.09)治疗癌性发热,同时也涉及肝炎通路(度值为0.39,介度值为30,紧密度值为0.02)、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路(度值为0.38,介度值为26,紧密度值为0.01)、TNF通路(度值为0.41,介度值为23,紧密度值为0.01)和IL-17通路(度值为0.41,介度值为21,紧密度值为0.01)等。见图5。

图5 药物成分-交集靶点-通路网络图
2.6 分子对接技术结果 度值排名前5的交集靶点分别为PTGS2、PTGS1、PRSS1、Caspase-3、AKT1,度值排名前5的活性化学成分分别为槲皮素、山奈酚、汉黄芩素、黄芩素、异鼠李素。5种受体蛋白与5种配体蛋白的结合能见表4,结合能排名前6的分子对接技术可视化示意图见图6。
表4 5种受体蛋白与5种配体蛋白对接的平均结合能(kcal/mol)

PRSS1-槲皮素 AKT1-槲皮素
3 讨 论
癌性发热的病理机制仍未完全明确。有学者认为癌性发热是由于肿瘤细胞或肿瘤相关巨噬细胞释放的IL-1、IL-6、TNF-α和干扰素触发下丘脑体温调节中枢的血管内皮细胞和神经元生成前列腺素E2,从而重置视前区的热调节设定点,进而引起发热反应[2,17]。这些细胞因子在中医中被认为是癌症患者脏腑功能失调后产生的痰湿、瘀血和癌毒等病理产物,可阻滞人体内阴阳开阖,从而郁积生热。人体阴阳开阖以少阳为枢机,因而癌性发热可归结为机体少阳枢机不利而致“郁热”[18],多用和解少阳法调达枢机。柴胡与黄芩是和解少阳的经典配伍,《医方考》曰“柴胡、黄芩能和解少阳经之邪”,可见柴芩药对在方中起着和解少阳、运转枢机的主导作用。《药品化义》曰“所谓内热用黄芩,外热用柴胡,为和解要剂”,可见柴胡与黄芩合用可外散半表之热、内清半里之热。张洁等[19]、尚学彬等[20]和张辉等[21]使用柴胡类方治疗癌性发热,其有效率分别达82.7%、93.75%和80.0%。
本研究通过网络药理学方法筛选出柴胡-黄芩药对治疗癌性发热的核心活性化学成分,主要有檞皮素、山奈酚、异鼠李素、汉黄芩素和黄芩素等。其中,檞皮素不仅能阻断TNF-α对细胞内核因子κB(nuclear factor κB,NF-κB)的激活,减少IL-1、IL-6和TNF-α等细胞因子的产生[22],还能阻断磷脂酰肌醇-3-激酶(phosphatidylinositol 3-kinase,PI3K)通路,从而抑制环氧合酶(cyclooxygenase,COX)的生成,而COX是催化花生四烯酸转化为前列腺素的关键酶[22]。山奈酚则可通过抑制还原型烟酰胺腺嘌呤二核苷酸磷酸的活性从而抑制NF-κB的表达[23],同时对COX-1、COX-2均有明显的抑制作用[24]。异鼠李素能下调NF-κB的表达从而减少IL-6的释放,并能抑制MAPK通路以减少COX-2、IL-1、IL-6和TNF-α等炎症因子释放[25]。汉黄芩素能抑制COX-1的合成,从而抑制前列腺素的产生[26-27]。黄芩素能明显下调COX-2蛋白的表达,抑制IL-6、IL-1β和TNF-α等细胞因子的释放,并能抑制p38的磷酸化从而抑制NF-κB信号通路的激活,进而发挥解热的作用[28-30]。此外,上述成分除了发挥解热作用,还具有直接抗肿瘤功效,通过抑制肿瘤细胞的增殖达到治疗“癌因性”致热。檞皮素能抑制MAPK/细胞外调节蛋白激酶途径(extracellular regulated protein kinase,ERK)[31]、激活Caspase-3/7并抑制B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)的表达从而诱导肿瘤细胞凋亡[32]。山奈酚还能抑制PI3K/AKT通路从而抑制肿瘤细胞增殖[33]。异鼠李素则通过升高活性氧簇水平及降低细胞周期蛋白B1(cyclin B1)的表达从而诱导细胞周期阻滞[34]。黄芩素可选择性调控MAPK/ERK1、MAPK/ERK2 信号通路,从而可控制肿瘤细胞周期阻滞、凋亡和衰老的分子过程[35]。汉黄芩素则通过抑制NF-κB/Bcl-2通路的激活,促进Caspase-3和Caspase-9的裂解从而诱导细胞凋亡[36]。由此可见,檞皮素、山奈酚、异鼠李素、汉黄芩素和黄芩素不仅能通过减少IL-1、IL-6、TNF-α和COX的生成,从而抑制前列腺素的产生,发挥解热作用以治标,还能通过抑制MAPK/ERK通路、激活Caspase蛋白、降低细胞周期蛋白表达等途径抑制肿瘤细胞增殖,诱导肿瘤细胞凋亡。
本研究结果表明,柴胡-黄芩治疗癌性发热的核心靶点包括PTGS2、PTGS1、PRSS1、Caspase-3、AKT1。PTGS2和PTGS1分别是COX-2和COX-1的编码基因。COX是体内催化花生四烯酸合成前列腺素家族的关键酶,而前列腺素家族中的前列腺素2是内源性致热源引起发热的主要介质,其通过增加冷敏神经元放电并减少热敏神经元放电来升高体温调定点,从而引起发热,阻断前列腺素2合成的药物具有明显的解热作用[37-38]。PRSS1、Caspase-3和AKT1基因参与了肿瘤细胞增殖和凋亡的过程。PRSS1主要经非受体酪氨酸激酶/信号传导子和转录激活子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)通路调控细胞增殖[39];Caspase-3则参与死亡受体/死亡配体途径从而诱导细胞凋亡[40];AKT1是PI3K/AKT信号通路中核心因子,参与着肿瘤细胞增殖和血管生成[41]。目前尚缺乏研究证实檞皮素、山奈酚、异鼠李素、汉黄芩素和黄芩素对PTGS2和PTGS1具有直接的抑制作用,但这5种活性化学成分均能抑制COX的合成,故笔者推测这5种活性化学成分可能对PTGS2和PTGS1基因的表达有抑制作用,减少前列腺素释放,从而发挥解热作用。虽然上述5种成分直接作用于PRSS1、Caspase-3和AKT1的研究较少,但檞皮素、山奈酚、异鼠李素、黄芩素和汉黄芩素可参与调控上述靶点的信号通路,故笔者推测这5种成分能抑制它们的表达,从而发挥抗肿瘤作用。同时,本研究分子对接技术结果表明,PRSS1、AKT1与檞皮素,AKT1与山奈酚,PTGS1与黄芩素,Caspase-3、PTGS1与异鼠李素的对接结合能均<-5,提示筛选出的核心活性化学成分与核心靶点具有较好的结合活性。
本研究GO功能富集分析和KEGG通路富集分析的结果显示,柴胡-黄芩药对治疗癌性发热的作用机制主要涉及癌症相关通路、MAPK通路、干扰素通路、IL-17通路和肝炎通路,上述通路均参与肿瘤细胞的增殖和凋亡过程。肿瘤细胞的增殖过程呈异常代谢状态,凋亡基因表达被抑制,同时释放IL-1、IL-6、TNF-α和干扰素等细胞因子,其可诱发炎症并级联活化TNF通路[42]。TNF通路的下游信号传导途径主要有NF-κB激活的信号传导、c-Jun氨基末端激酶信号传导及细胞凋亡信号传导。NF-κB被激活后释放的IL-1、IL-6和TNF-α等细胞因子在癌性发热中起主要作用,这些细胞因子可直接刺激体温调节中枢引起发热[2,17]。此外,这些细胞因子还可促进肿瘤相关血管生成,保障肿瘤相关巨噬细胞的生长,并促进肿瘤的侵袭[43],这也为TNF通路提供了启动因子,形成恶性正反馈机制。IL-17信号通路主要包括IL-17A信号通路和IL-17F信号通路,IL-17A可直接激活NF-κB,并且下调miR-23b的表达水平,进一步放大IL-17A激活NF-κB信号的作用;IL-17A与TNF-α具有协同作用,能共同增强TNF-α所诱导基因的mRNA稳定性,增加TNF-α的释放,从而诱导发热[44]。檞皮素、山奈酚、异鼠李素、黄芩素及汉黄芩素一方面可以抑制癌症相关通路,抑制肿瘤细胞增殖、诱导细胞凋亡,从根源减少炎症因子释放;另一方面又能抑制TNF和IL-17两条信号通路,防止炎症因子介导的级联放大效应,进一步减少致热细胞因子的释放。因此,笔者推测柴胡-黄芩药对通过抗肿瘤和抗炎解热两方面来治疗癌性发热。
综上所述,柴胡和黄芩是柴胡类方的关键组成,是“和解少阳法”的基础配伍,药对中的檞皮素、山奈酚、异鼠李素、黄芩素和汉黄芩素能够抑制PTGS2、PTGS1基因表达从而减少前列腺素合成,并抑制PRSS1、Caspase-3和AKT1表达从而抑制肿瘤增殖;其通过抑制癌症相关通路、TNF通路和 IL-17通路的激活,从而减少IL-1、IL-6、TNF-α等致热细胞因子的释放。柴胡、黄芩能同时发挥抗肿瘤和抗炎解热两方面的作用以达到治疗癌性发热的目的。这为临床运用柴胡类方治疗癌性发热及肿瘤相关性发热提供了科学依据。然而本研究主要是以生物信息学与海量数据计算的结果为基础,后续将在此基础上进行动物或细胞实验加以验证,进而明确柴胡-黄芩药对治疗癌性发热的主要调控靶点。
