参苓白术散对脾虚湿困型UC大鼠结肠组织MKK/JNK通路的影响①
2022-02-13柴瑞婷贾育新张明雨范珉珏曹思齐甘肃中医药大学兰州730000
柴瑞婷 贾育新 张明雨 王 斑 范珉珏 曹思齐 (甘肃中医药大学,兰州730000)
溃疡性结肠炎(ulcerative colitis,UC)是一种常见多发的慢性非特异性炎症性肠病,临床多表现为反复发作的腹泻、腹痛、黏液脓血便,病变部位多在结肠黏膜及黏膜下层,逐渐向全结肠蔓延[1]。UC 的发病机制尚未完全明确,有研究表明,免疫、环境、遗传和外部感染等均可导致UC 发病,目前多数研究者认为黏膜免疫异常是引发肠道炎症的关键,而治疗UC 的主要原则是控制症状、减轻炎症反应、促进黏膜愈合、防止复发、防治并发症等[2]。西医学主要通过氨基水杨酸盐、免疫调节剂及糖皮质激素等治疗,然而长期用药存在明显的不良反应[3-4]。中医认为UC 多为素体脾气虚弱、饮食不调、感受外邪所致,病位在大肠,与脾、肝、肾密切相关,脾虚湿困证为其重要证型之一,治以参苓白术散[5]。本文拟研究参苓白术散对脾虚湿困型UC 大鼠血清和结肠组织中IL-2 和IL-17 含量、结肠组织中MKK4/7、JNK、AP-1 蛋白及mRNA 表达的影响,探讨参苓白术散对模型大鼠MKK/JNK 信号通路的干预作用,进一步挖掘参苓白术散治疗脾虚湿困型UC的可能机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 72 只2 月龄SPF 级健康Wistar大鼠(雌雄各半),体质量(220±10)g,由甘肃中医药大学医学实验中心提供,动物合格证号:SCXK(甘)2015-0002,于甘肃中医药大学SPF 级实验室常规饲养[动物设施使用许可证号:SYXK(甘)2015-0005-0001405],相对湿度45%~55%,室温22~25 ℃,自由进食饮水。实验动物处理遵守实验动物伦理原则(伦理审查编号:2019-166)。
1.1.2 药物 参苓白术散配方颗粒原料药材根据《中国药典》依法炮制,按原处方比例配伍(由人参:炒白术:白茯苓:甘草:薏仁:莲子:砂仁:白扁豆:桔梗:山药=4:4:4:4:2:2:2:3:2:4),由甘肃中医药大学附属医院制剂室加工提供;美沙拉秦肠溶片(黑龙江天宏药业股份有限公司,批号:20190202)。
1.1.3 主要试剂与仪器 2,4,6-三硝基苯磺酸(美伦生物,批号:D1010A);RIPA 裂解液PMSF(北京索莱宝生物科技有限公司,批号:20200701);脱脂奶粉(北京索莱宝生物科技有限公司,批号:224Q056);电泳凝胶制备试剂盒(北京索莱宝科技有限公司,批号:20171206);大鼠IL-2、IL-17 ELISA试剂盒(上海酶联生物科技有限公司,批号:07/2020、07/2020);逆转录试剂盒(批号:H2901291);实时荧光定量聚合酶链式反应(RT-PCR)试剂盒(批号:H8901070);一抗MKK4、MKK7、JNK、AP-1(美国Abcam 公司,批号:GR297166-6、GR294192-3、GR326430-1、GR156116-12);p-MKK4(Ser257)、p-JNK(Thr183/Tyr185)、p-AP-1(Ser73)(Cell Signaling Technology 公司,批号:4514T、4668T、3270T);p-MKK7(Thr275,Affinit公司,批号:#27x6428);GAPDH一抗(Immunoway 公司,批号:YM3215);辣根过氧化物酶标记的山羊抗兔IgG(博士德生物工程有限公司,批号:56j9956)。
SCIENTZ-48型高通量组织研磨器(宁波新芝生物科技股份有限公司);CT14RD 型高速低温离心机(上海天美生化仪器设备工程公司);Chemi DOC XRS+型凝胶成像分析系统、10705 型Benchmark Plus 酶 标 仪、CFX96 型Real-time PCR 仪、S1000TM型逆转录仪、SD 型Western blot 电泳及转印系统(美国Bio-Rad公司)。
1.2 方法
1.2.1 动物分组与模型制备 72 只Wistar 大鼠适应性喂养1 周后,随机分为空白组(12 只)和造模组(60 只),造模组采用病证结合综合法复建脾虚湿困型UC 大鼠[6-7]。按随机数字表法将造模组分为模型组、美沙拉秦肠溶片对照组和参苓白术散高、中、低剂量组,每组12只。
模型制备:造模组大鼠单日禁食不禁水,给予4 ℃冷水(2 ml/只)灌胃1 次,双日供应充足饲料,并给予猪油(4 ml/只)灌胃1次,如此交替,每日强迫大鼠站于2 cm 深水中8 h,连续20 d;第21 天禁食不禁水24 h 后,以10%水合氯醛腹腔麻醉(3 ml/kg),将16 号灌胃针头部涂抹凡士林后,插入大鼠肛门8 cm处,空白组以0.25 ml生理盐水灌肠,造模组以0.25 ml 100 mg/kg TNBS+50%乙醇混合试剂灌肠,倒提大鼠尾部静置1 min,使造模剂充分渗入大鼠肠腔,随后将大鼠头部倾斜向下躺至自然苏醒,自由饮食。观察大鼠体征是否出现脓血便、腹泻等,并随机抽取病检,确保造模成功。
1.2.2 给药方法与标本采集 参苓白术散高、中、低剂量组分别按颗粒剂[27.9、13.95、6.975 g/(kg·d)]灌胃,对照组以0.2 g/(kg·d)灌胃21 d(大鼠的等效剂量相当于70 kg成人剂量的6.3倍)。末次给药禁食不禁水24 h,麻醉采血,血样静置15 min,3 000 r/min离心15 min,取血清于-80 ℃保存;脱颈处死,取胸腺、脾脏称重,截取肛门上约8 cm 处结肠组织,部分置于4%多聚甲醛固定液待病检,部分于-80 ℃保存待测基因蛋白。
1.2.3 指标检测
1.2.3.1 观察指标 观察各组大鼠精神状态、毛色、活动情况及大便性状的改变;肉眼观察大鼠结肠组织黏膜损伤程度。
1.2.3.2 免疫器官指数 剥离胸腺和脾脏,生理盐水冲洗,滤纸滤干残血后称重。胸腺指数(mg/g)=胸腺重量(mg)/大鼠体质量(g);脾脏指数(mg/g)=脾脏重量(mg)/大鼠体质量(g)。
1.2.3.3 结肠组织病理检测 将病变明显的结肠组织固定于4%多聚甲醛,避光保存,石蜡常规包埋、切片,进行HE 染色,高倍显微镜下(×200)观察各组溃疡大小、炎症浸润。
1.2.3.4 ELISA 检测结肠组织和血清中IL-2、IL-17含量 取制备的组织上清及血清并平衡至室温,严格按照ELISA 试剂盒操作说明进行,酶标仪波长450 nm处读取OD值,计算样品含量。
1.2.3.5 RT-PCR 检 测 结 肠 组 织MKK4、MKK7、JNK、AP-1 mRNA 表达水平 称取结肠组织样本0.1 g,Trizol 法提取总RNA,微量分光光度计检测RNA 浓度及纯度。按逆转录试剂盒说明进行逆转录合成cDNA 并扩增。相对基因表达量采用2-ΔΔCt法计算。以GAPDH 为内参,引物由上海生工生物科技有限公司合成,引物序列见表1。

表1 PCR引物序列Tab.1 PCR primer sequences
1.2.3.6 Western blot 检测结肠组织MKK4、MKK7、JNK、AP-1 及其磷酸化蛋白相对表达量 称取结肠组织0.1 g置于离心管中,加入裂解液500 μl(10 μl PMSF+490 μl RIPA),剪碎、匀浆,充分裂解后,4 ℃、13 000 r/min离心10 min,收集上清液300 μl,加入4 倍上样缓冲液100 μl,100 ℃水浴10 min。根据MKK4、MKK7、JNK、AP-1 及其磷酸化蛋白相对分子量进行SDS-PAGE 电泳,湿转至PVDF 膜,5%脱脂奶粉封闭液室温封闭2 h,加入稀释的GAPDH(1:1 000)、MKK4(1:500)、p-MKK4(1:200)、MKK7(1:500)、p-MKK7(1:500)、JNK(1:1 000)、p-JNK(1:500)、AP-1(1:1 000)、p-AP-1(1:500)一抗4 ℃孵育过夜,TBST 洗涤3 次×10 min。加入稀释的二抗(1:10 000)室温孵育2 h,TBST洗涤3次×10 min,ECL显色液1:1 显影后采用Image J 图像分析软件进行目的条带的灰度光密度分析。磷酸化蛋白以总蛋白表达水平为参照,通过计算磷酸化蛋白和总蛋白比值显示蛋白活化情况。
1.3 统计学方法 采用SPSS25.0统计软件进行数据分析。计量资料符合正态分布以±s表示,组间差异的比较采用方差分析,若方差齐采用LSD 法,方差不齐采用Tamhane'sT2法,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠一般情况及免疫器官指数变化比较
2.1.1 参苓白术散对脾虚湿困型UC 大鼠一般状态的影响 空白组大鼠毛色光亮,精神状态良好,喜活动,大便呈完整颗粒状;模型组大鼠皮无泽易脱,精神倦怠,拱背扎堆,食水量较空白组明显减少,大便黏腻,出现脓血便,肛周污秽;药物干预后,与模型组相比,药物治疗各组大鼠上述症状均有明显好转,其中以参苓白术散高剂量组最为显著。
2.1.2 参苓白术散对脾虚湿困型UC 大鼠免疫器官指数的影响 与空白组相比,模型组大鼠胸腺指数明显降低(P<0.01),脾脏指数明显升高(P<0.01);与模型组相比,参苓白术散各组和美沙拉秦对照组大鼠胸腺指数均有所上升,脾脏指数均有所下降,其中参苓白术散高剂量组最为显著(P<0.01);与美沙拉秦肠溶片对照组相比,参苓白术散各剂量组免疫器官指数差异均无统计学意义(P>0.05,图1)。
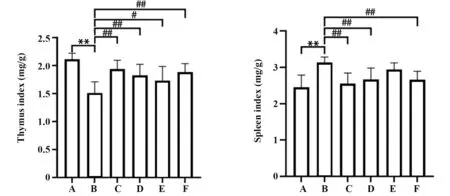
图1 参苓白术散对脾虚湿困型UC 大鼠胸腺指数和脾脏指数的影响Fig.1 Effects of Shenlingbaizhu Powder on thymus index and spleen index of UC rats with spleen deficiency and dampness
2.2 参苓白术散对脾虚湿困型UC 大鼠结肠组织病理形态的影响
2.2.1 结肠组织宏观观察 肉眼观空白组大鼠结肠组织肠壁完整光滑,纹理清晰,未见溃疡点、糜烂、充血、水肿等。模型组大鼠结肠黏膜明显水肿充血,肠壁增厚且凹凸不平,溃疡明显,可见黑褐色坏死组织。参苓白术散高剂量组结肠组织无明显水肿、充血等,表面相对完整,肠壁较空白组略厚,颜色略深。其他治疗组大鼠结肠组织不同程度地恢复(图2)。
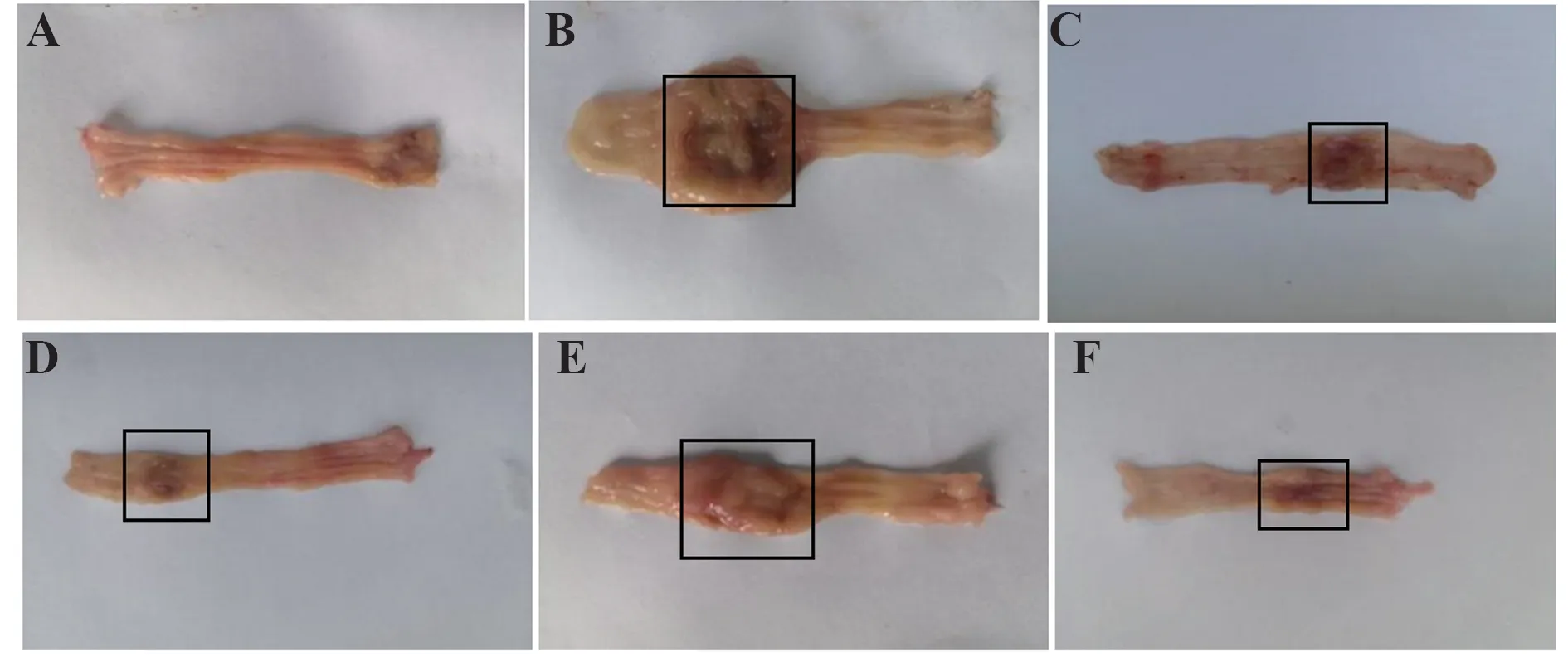
图2 参苓白术散对脾虚湿困型UC 大鼠结肠组织的影响(宏观)Fig.2 Effect of Shenlingbaizhu Powder on colonic tissue of UC rats with spleen deficiency and dampness(on macro)
2.2.2 结肠组织病理切片观察 镜下观察空白组大鼠结肠组织黏膜结构完整清晰,肠腺规则,隐窝无坏死,可见大量杯状细胞,无炎症细胞浸润。模型组大鼠结肠组织黏膜结构破坏,肠腺缺失,黏膜表面不平,形成隐窝脓肿,杯状细胞减少,细胞内黏液减少,固有膜间质内可见大量炎症细胞浸润,以淋巴细胞、浆细胞和单核细胞为主。参苓白术散高剂量组大鼠结肠黏膜结构基本恢复,肠腺破坏较轻,可见再生的黏膜上皮及肠腺,炎症细胞浸润明显减少。其他治疗组大鼠结肠组织黏膜少量恢复,仍有少量炎症细胞浸润(图3)。
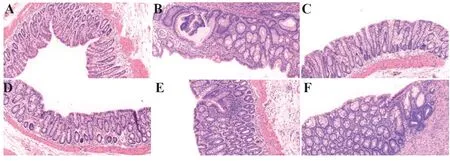
图3 参苓白术散对脾虚湿困型UC 大鼠结肠组织病理形态的影响(HE,×200)Fig.3 Effect of Shenlingbaizhu Powder on pathological morphology of colon in UC rats with spleen deficiency and dampness(HE,×200)
2.3 参苓白术散对脾虚湿困型UC 大鼠血清及结肠组织中IL-2、IL-17 含量的影响 与空白组相比,模型组大鼠血清中IL-2和IL-17含量升高(P<0.01),结 肠 组 织 中IL-2、IL-17 含 量 升 高(P<0.05,P<0.01);与模型组相比,参苓白术散各剂量组和美沙拉秦肠溶片对照组血清及结肠组织中IL-2、IL-17 含量均降低,其中以参苓白术散高剂量组差异最为显著(P<0.01);与美沙拉秦肠溶片对照组相比,参苓白术散低剂量组结肠中IL-17 含量差异有统计学意义(P<0.05),其余各组差异无统计学意义(P>0.05,图4)。
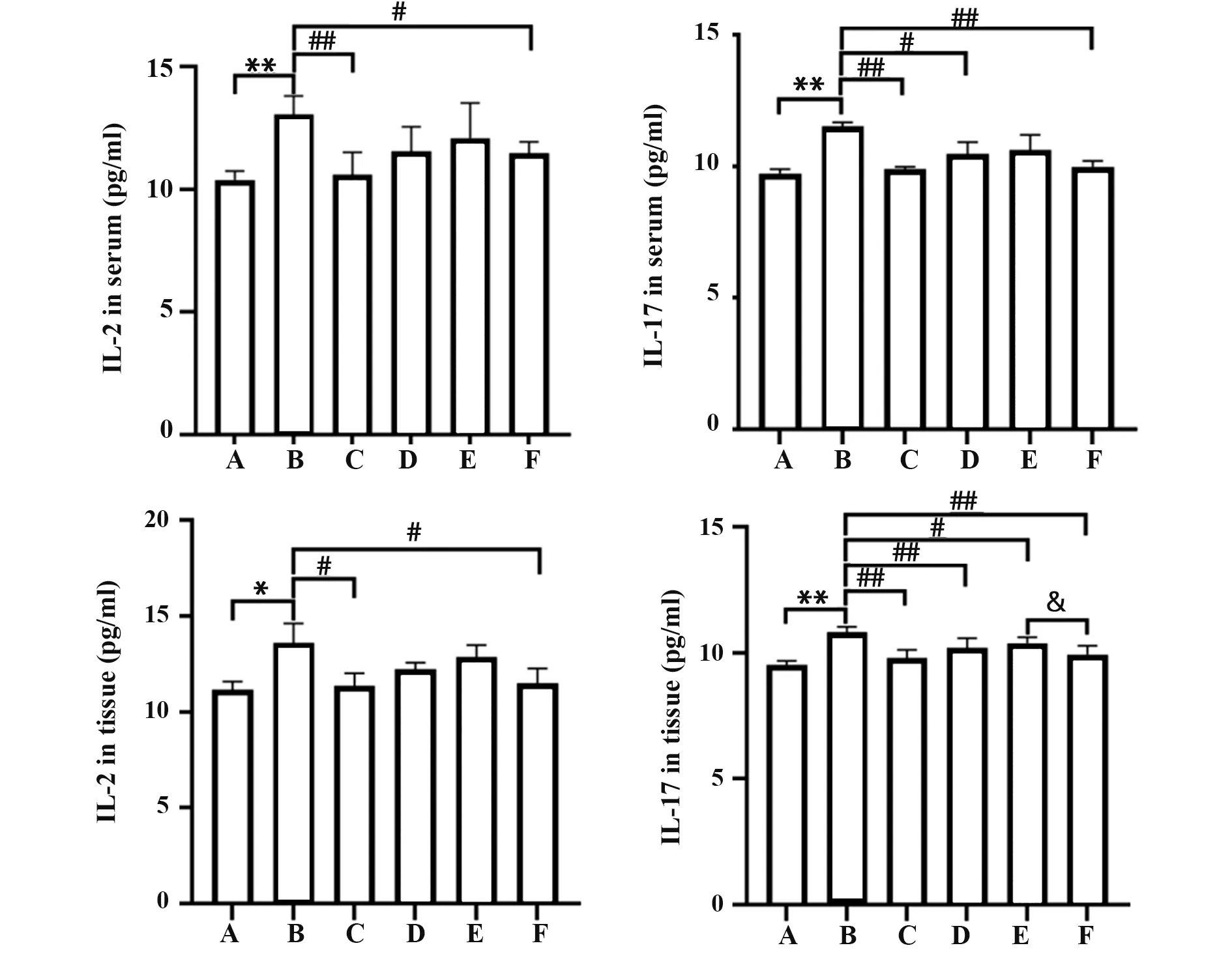
图4 参苓白术散对脾虚湿困型UC 大鼠血清和结肠组织中IL-2、IL-17含量的影响Fig.4 Effect of Shenlingbaizhu Powder on contents of IL-2 and IL-17 in serum and colon tissues of UC rats with spleen deficiency and dampness
2.4 参苓白术散对脾虚湿困型UC 大鼠结肠组织MKK4、MKK7、JNK、AP-1 mRNA 水平的影响 与空白组相比,模型组大鼠结肠组织MKK4、MKK7、JNK、AP-1 mRNA 水平显著升高(P<0.01);与模型组相比,各干预组大鼠结肠组织MKK4、MKK7、JNK、AP-1 mRNA表达水平均有不同程度降低,其中参苓白术散高剂量组效果最显著(P<0.01);与美沙拉秦肠溶片对照组相比,除参苓白术散高剂量组外,参苓白术散中、低剂量组差异均有统计学意义(P<0.05,P<0.01,图5)。
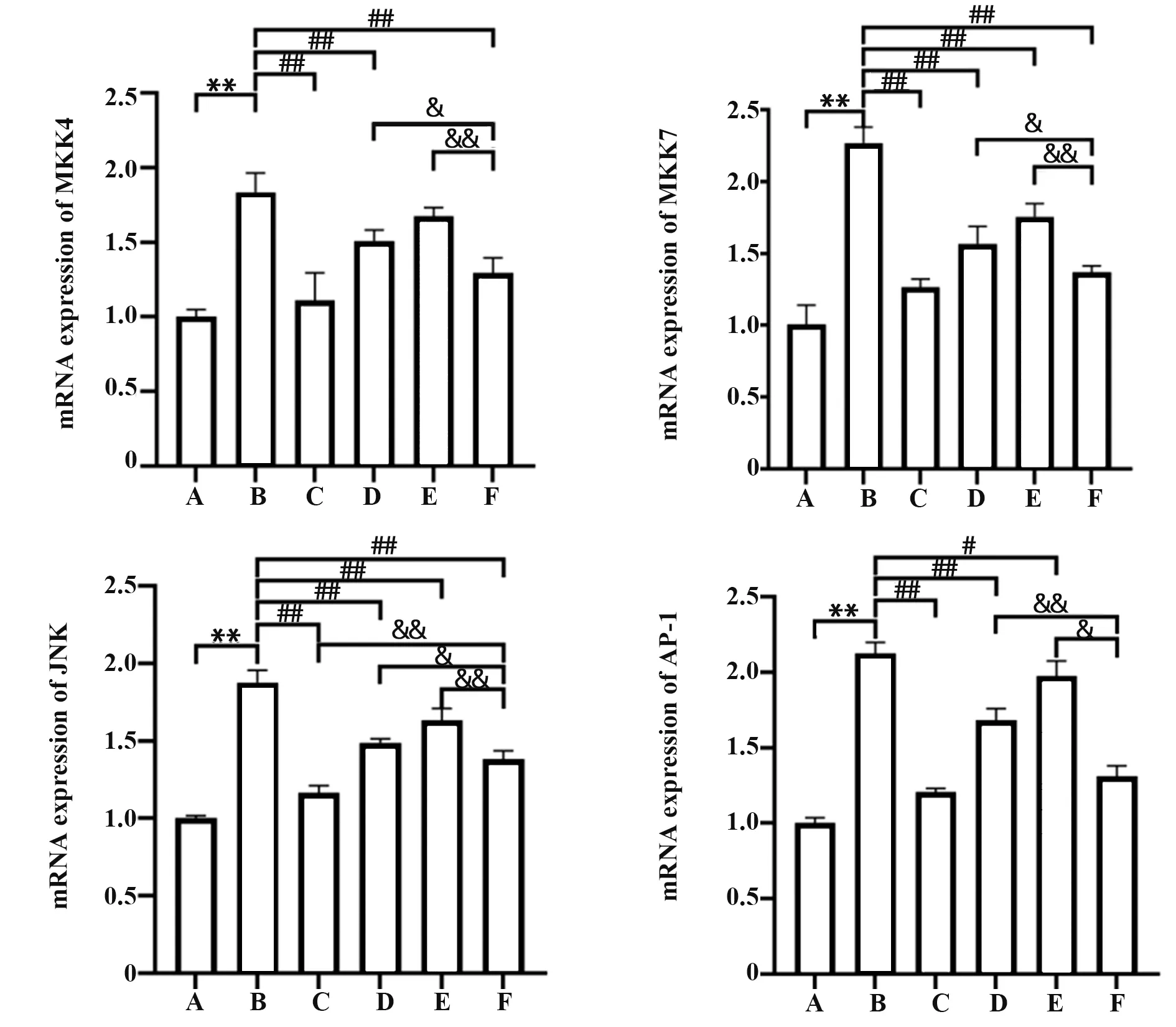
图5 参苓白术散对脾虚湿困型UC 大鼠结肠组织中MKK4、MKK7、JNK、AP-1 mRNA水平的影响Fig.5 Effect of Shenlingbaizhu Powder on MKK4,MKK7,JNK,AP-1 mRNA levels in colon tissues of UC rats with spleen deficiency and dampness
2.5 参苓白术散对脾虚湿困型UC 大鼠结肠组织MKK4、MKK7、JNK、AP-1 表达及磷酸化水平的影响 与空白组相比,模型组大鼠结肠组织p-MKK4/MKK4、p-MKK7/MKK7 和p-AP-1/AP-1 显著升高(P<0.01),p-JNK/JNK 亦升高(P<0.05)。与模型组相比,参苓白术散高剂量组p-MKK4/MKK4、p-MKK7/MKK7、p-JNK/JNK、p-AP-1/AP-1 均 有 所 降 低(P<0.05),参苓白术散中剂量组和美沙拉秦肠溶片对照组p-AP-1/AP-1 亦有所降低(P<0.05)。与美沙拉秦肠溶片对照组相比,参苓白术散各剂量组p-MKK4/MKK4、p-MKK7/MKK7、p-JNK/JNK、p-AP-1/AP-1差异均无统计学意义(P>0.05)。见图6、图7。
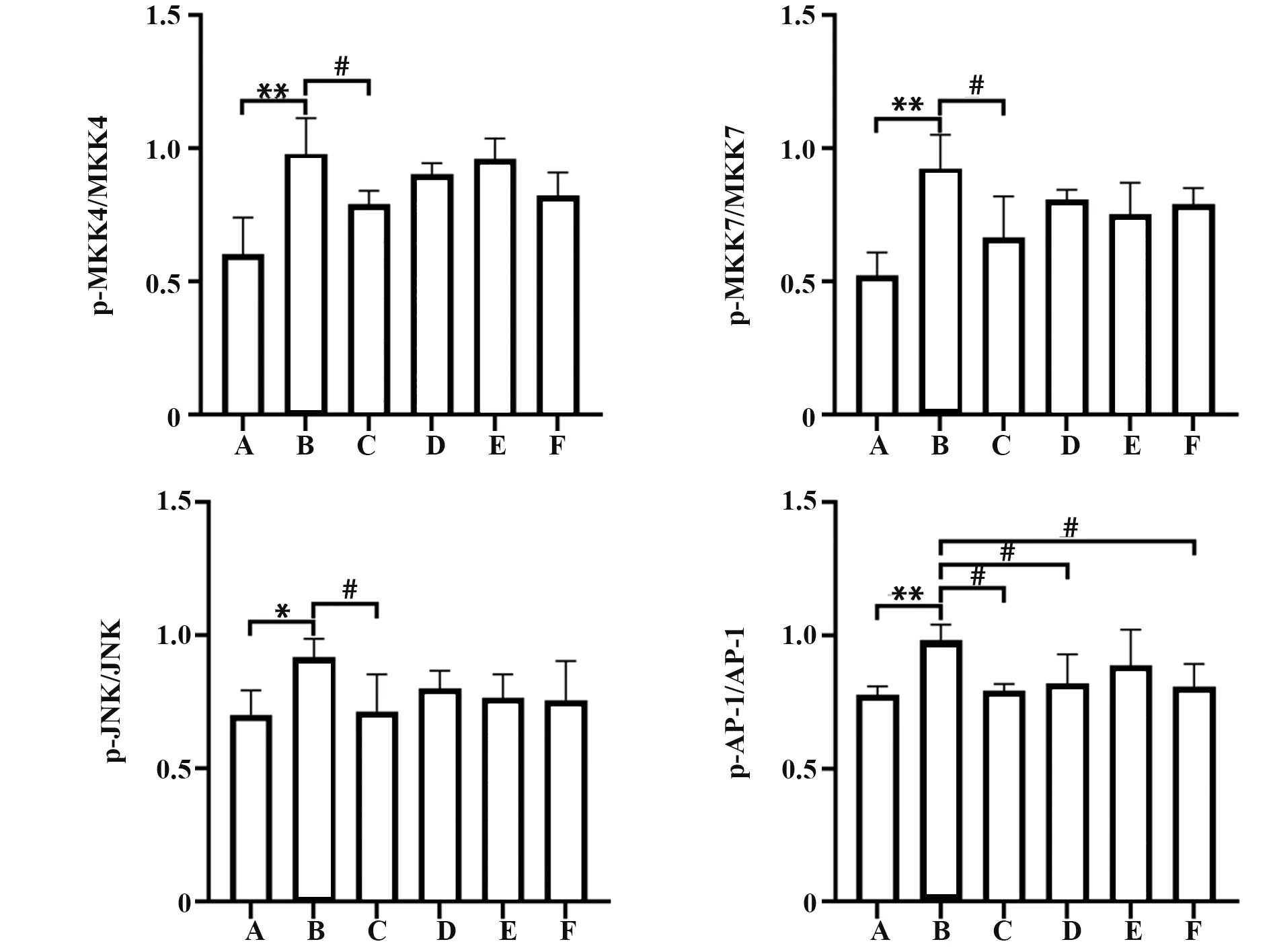
图6 参苓白术散对脾虚湿困型UC 大鼠结肠组织中MKK4、MKK7、JNK、AP-1蛋白表达及磷酸化的影响Fig.6 Effect of Shenlingbaizhu Powder on MKK4,MKK7,JNK,AP-1 protein expressions and its phosphorylation in colon tissues of UC rats with spleen deficiency and dampness

图7 各组大鼠结肠组织MKK4、MKK7、JNK、AP-1 及其磷酸化蛋白表达电泳图Fig.7 Electrophoresis diagram of expressions of MKK4,MKK7,JNK,AP-1 and their phosphorylated proteins in colon tissue
3 讨论
UC作为一种非特异性慢性炎症性肠病,发病机制尚未完全明确。UC 起病缓慢、病症轻重不一、病情反复,临床以反复腹泻、黏液脓血便、里急后重、腹痛等为主要表现[8]。湿热蕴肠为UC 活动期主要病因病机,而脾虚湿困则是导致UC 迁延反复的主要因素,为缓解期关键病因病机,其中脾虚为本、湿困为标,诚如张景岳云:“凡里急后重者……其病不在广肠而在脾肾也”“脾弱者,因虚所以易泻,因泻所以愈虚,盖关门不固,则气随泻去,气去则阳衰,阳衰则寒从中生,固不必外受风寒,始谓之寒也”,《杂病源流犀烛·泄泻源流》亦载:“湿盛则飧泄,乃独由于湿耳。不知风寒热虚,虽皆能为病,苟脾强无湿,四者均不得而干之,何自成泄”,皆强调了UC虽病位在肠,但脾胃虚弱乃根本原因。脾胃运化失职,津液不得转输,水谷亦不可运化,因而致体虚湿盛,治疗应标本兼顾。《医方考》言:“脾胃喜甘而恶秽,喜燥而恶湿,喜利而恶滞”,治以参苓白术散(《太平惠民和剂局方》),健脾益气、和胃渗湿。脾悦甘,用人参、甘草补益脾气,苡仁健脾渗湿,扁豆健脾和中,味之甘者也;土喜燥,用白术燥湿利水、茯苓渗湿利水,甘而微燥也;脾喜香,砂仁辛香而燥,用以开胃醒脾;心生脾,故用莲肉益心;土恶水,故以山药治肾,亦可补脾养胃;桔梗入肺经,宣肺利气,甘而微苦,甘则性缓,故为诸药之舟楫,苦则喜降,能通天气于地道,无否塞之忧也[9]。
本课题组前期研究表明,参苓白术散可有效改善模型大鼠的症状、体征、结肠病理改变、炎症因子和分子蛋白表达水平[10]。有研究表明,MKK/JNK 信号通路在炎症性肠病中发挥重要作用[11]。本研究采用环境与饮食因素干预复建脾虚湿困证型,结合TNBS 与乙醇复合物建立脾虚湿困型UC 大鼠模型。选取美沙拉秦作为阳性对照药物,临床上美沙拉秦是治疗UC 的主要药物,通过调节肠黏膜局部花生四烯酸代谢的多个环节,抑制前列腺素、白三烯合成,清除氧自由基,抑制免疫反应[12]。
UC发病的重要因素之一是免疫异常,肠黏膜损坏与炎症细胞因子的大量释放关系密切。研究表明,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路参与炎症和应激反应,所有MAPK家族成员均被TXY基序中的苏氨酸和酪氨酸残基由单一的双特异性激酶MAPK 激酶(MKK)催化 激 活[13-14]。作 为MAPK 重 要 的 激 酶,MKK4 和MKK7 能够特异性激活JNK 表达,JNK 作为MAPK超家族的重要成员,通过Thr183、Tyr185 特定的磷酸化位点激活,从而参与多种细胞增殖、分化过程[15]。在TNBS诱导的大鼠UC模型中,MKK/JNK 通路中作为关键激活因子的MKK4调控下游关键因子表达,MKK4 作为JNK 和p38 的直接激活因子,参与细胞凋亡、炎症和肿瘤发生的调控[16]。有研究表明,通过抑制MKK、JNK 等相关因子表达可进一步抑制炎症发展[17]。本研究结果显示,经药物干预后,参苓白术散可修复结肠组织受损黏膜,减少炎症细胞浸润,改善免疫器官指数表达,调控MKK4、MKK7、JNK、激活子蛋白1(AP-1)基因及蛋白表达水平。作为细胞内信号传导的第三信使,AP-1 是MAPK 激酶级联反应的靶点,其通过调节基因表达来应对多种刺激,包括细胞因子、生长因子、压力、细菌和病毒感染,因此AP-1 控制了许多细胞进程,包括分化,增殖和凋亡等[18];而作为重要免疫因子的IL-17 和IL-2 能通过中性粒细胞的聚集诱导炎症反应级联水平,并可通过多种途径调节免疫刺激和免疫抑制间的平衡,与炎症性肠病密切相关[19-23]。本研究结果表明,27.9 g/kg 参苓白术散能够降低模型大鼠结肠组织及血清中炎症因子IL-2 和IL-17 含量,抑制炎症因子异常表达。
综上所述,参苓白术散可能通过调控MKK/JNK通路关键分子表达,修复结肠组织受损黏膜,减少炎症细胞浸润,其在UC 等相关性疾病的治疗中具有一定的应用前景,但炎症因子的表达调控途径较多,中药复方作用机制复杂,其作用靶点仍需进一步探究。
