缺氧诱导因子1α联合c-myc预测三阴性乳腺癌病人术后生存
2022-02-13杨建国杨红利王乐
杨建国 杨红利 王乐
三阴性乳腺癌(triple-negative breast cancer,TNBC)是临床上一种特殊的乳腺癌分子亚型,占所有乳腺癌10%~20%[1]。因其雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone,PR)和人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)三者均为阴性表达,缺乏内分泌治疗及抗HER-2的分子靶向治疗的相应靶点,给治疗上造成了较大困难。TNBC具有组织学分级高、分期晚、肿瘤侵袭性强、早期复发风险高等临床特点,预后往往较差,5年生存率<30%[2-4]。TNBC的分子标志物表达仍不明确,寻找有效的生物标志物来筛选不良预后病人成为临床急需解决的问题。
既往多个研究表明,缺氧诱导因子1α(hypoxia inducible factor-1α,HIF-1α)在乳腺癌组织中处于高表达状态,与乳腺癌复发转移风险增加、放化疗抵抗、免疫逃逸、预后不良相关[5-6]。c-myc作为发现较早的原癌基因之一,在乳腺癌和其他肿瘤的许多研究中均为高表达[7-9],但c-myc在TNBC这一特殊亚型乳腺癌中的表达情况及其预后价值少见报道。因此,本研究检测HIF-1α及c-myc在TNBC中的表达,并探究其对临床病理参数的影响,基于列线图建立TNBC的术后生存预测模型。
对象与方法
一、对象
本研究选用包含161例TNBC病人临床及随访数据的组织芯片(芯片来源:中科光华智能生物科技有限公司,编号:BRC1657),随访时间为2016年7月至2019年12月。年龄30~81岁,平均(51.2±17.3)岁,中位年龄为52岁。肿瘤直径>2 cm者91例;术后病理组织学Ⅰ级10例,Ⅱ级87例,Ⅲ级64例;淋巴结阳性80例;TNM分期Ⅰ期34例,Ⅱ期99例,Ⅲ期28例。Ki-67占比<15%者15例,≥15%者146例。
二、方法
统计该组织芯片中病人手术时的年龄、肿瘤直径、组织学分级、淋巴结状态、肿瘤TNM分期、病理报告中Ki-67占比等资料。对芯片进行免疫组织化学(Immunohistochemistry,IHC)染色,以检测HIF-1α及c-myc蛋白的表达情况。若IHC阳性着色细胞数占比≤10%,则判定为阴性,>10%则判定为阳性。根据IHC结果,将病人分为HIF-1α阴性组和HIF-1α阳性组,或c-myc阴性组和c-myc阳性组。
三、统计学分析
采用SPSS 16.0和GraphPad Prism 7软件分析数据。采用χ2检验和Mann-Whitney秩和检验分析HIF-1α及c-myc蛋白的表达与TNBC病人临床病理参数之间的关系。分别采用Cox单因素和多因素回归分析找出影响其预后的影响因素和独立危险因素。基于Cox多因素分析结果分别绘制ROC曲线和列线图,从而建立预测模型。使用R版本3.5.0生成列线图。P<0.05为差异有统计学意义。
结果
1.HIF-1α及c-myc蛋白与TNBC病人临床病理参数的关系:免疫组织化学染色结果显示,乳腺癌组织中HIF-1α和c-myc蛋白的阳性表达率分别为45.3%(73/161)和59.0%(95/161)。χ2检验和Mann-Whitney秩和检验分析结果显示,HIF-1α表达与年龄、组织学分级、淋巴结状态、肿瘤TNM分期显著相关(P<0.05);c-myc表达与肿瘤直径、组织学分级、淋巴结状态、肿瘤TNM分期显著相关(P<0.05)。在高龄病人中HIF-1α表达量更高,而在组织学Ⅲ级、淋巴结阳性、TNM分期Ⅲ期的病人中,HIF-1α和c-myc均明显升高。这意味着,高表达的HIF-1α、c-myc与高恶性程度的TNBC密切正相关,但HIF-1α、c-myc的表达与Ki-67均未见显著关系(P>0.05),见表1。
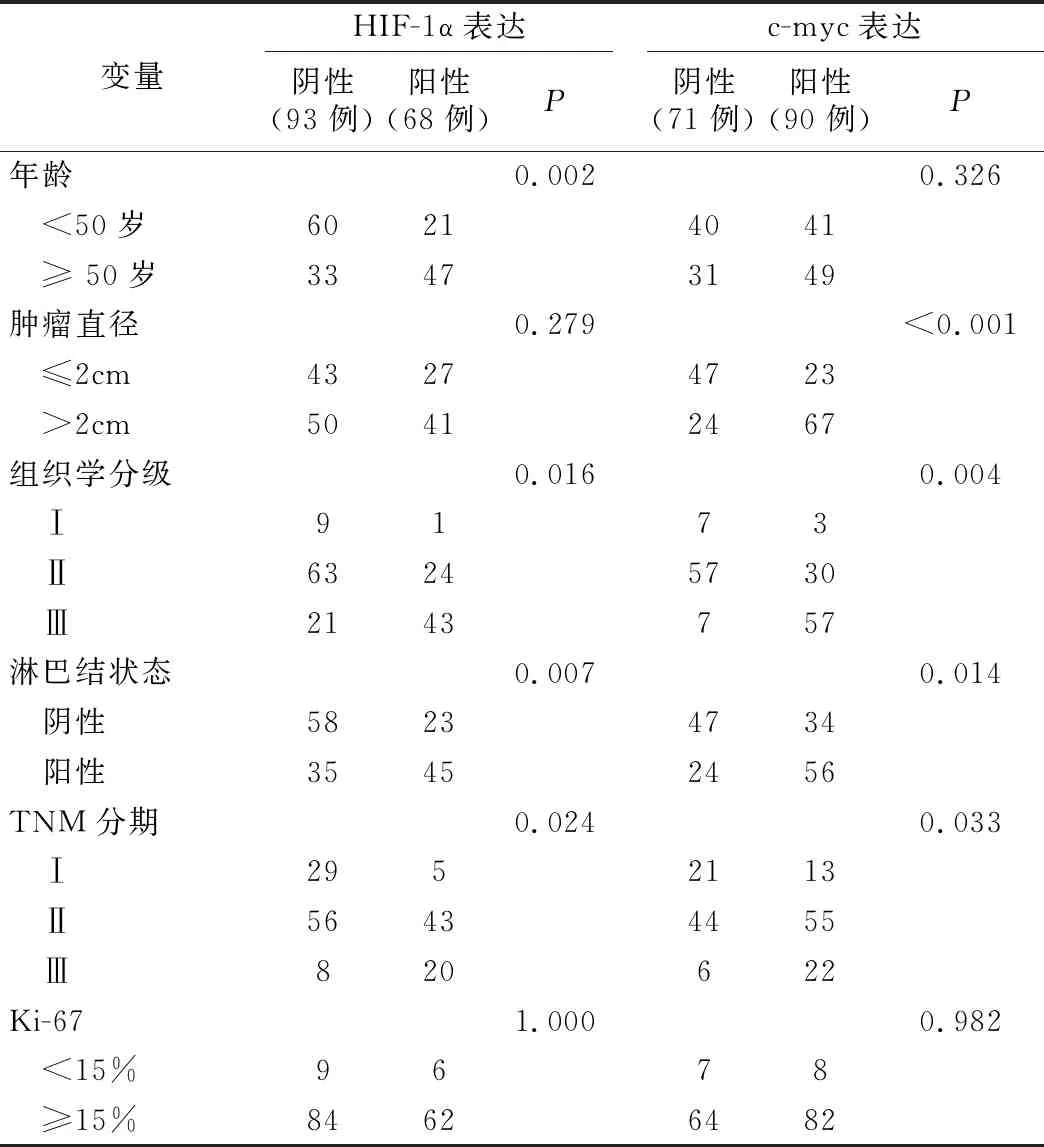
表1 HIF-1α及c-myc与乳腺癌临床病理特征的关系(例,%)
2.影响TNBC病人术后生存的Cox回归分析:所有病人随访4~42个月,平均随访(24.6±7.1)个月,中位随访时间为23个月。其中,有56例死亡,3年总生存率为65.2%(105/161)。总生存期为1.8~37.2个月,平均(29.5±3.9)个月,中位总生存期为31个月。Cox单因素及多因素回归分析中可知:组织学Ⅲ级(P=0.039)、淋巴结阳性(P=0.017)、TNM分期Ⅲ期(P=0.026)、HIF-1α及c-myc阳性(P<0.001)为三阴性乳腺癌病人术后生存的独立危险因素,可以用来预测3年预后。其HR值依次为:HIF-1α及c-myc(HR=3.057),淋巴结状态(HR=2.912),组织学分级(HR=1.785),TNM分期III期(HR=1.631),见表2。
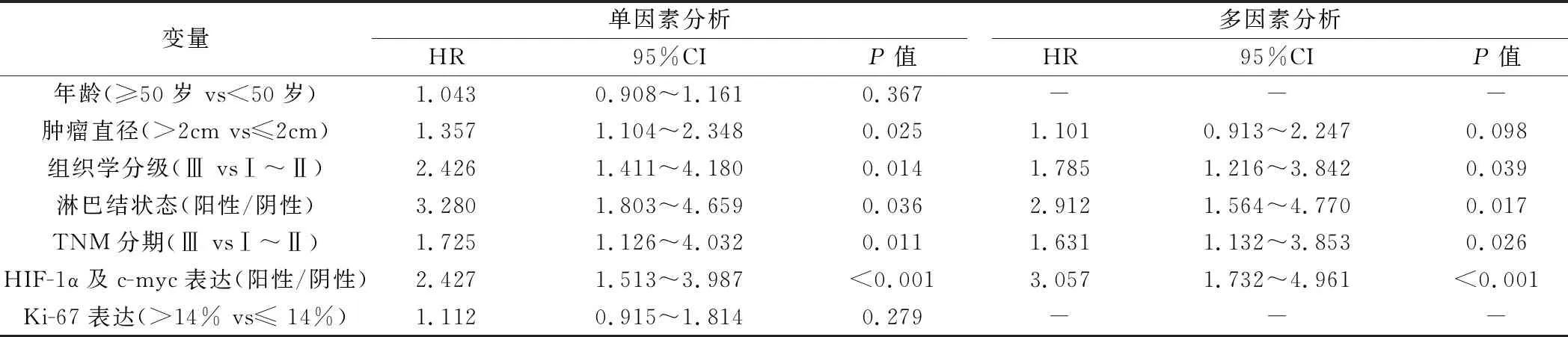
表2 TNBC术后生存的Cox回归分析
3.TNBC病人术后生存预测模型的ROC曲线:以Cox多因素回归分析个体死亡概率对结局变量“死亡”做ROC曲线,评估该模型的预测能力。ROC曲线下面积为0.820(0.796~0.854),说明该模型具有较高的预测价值,见图1。
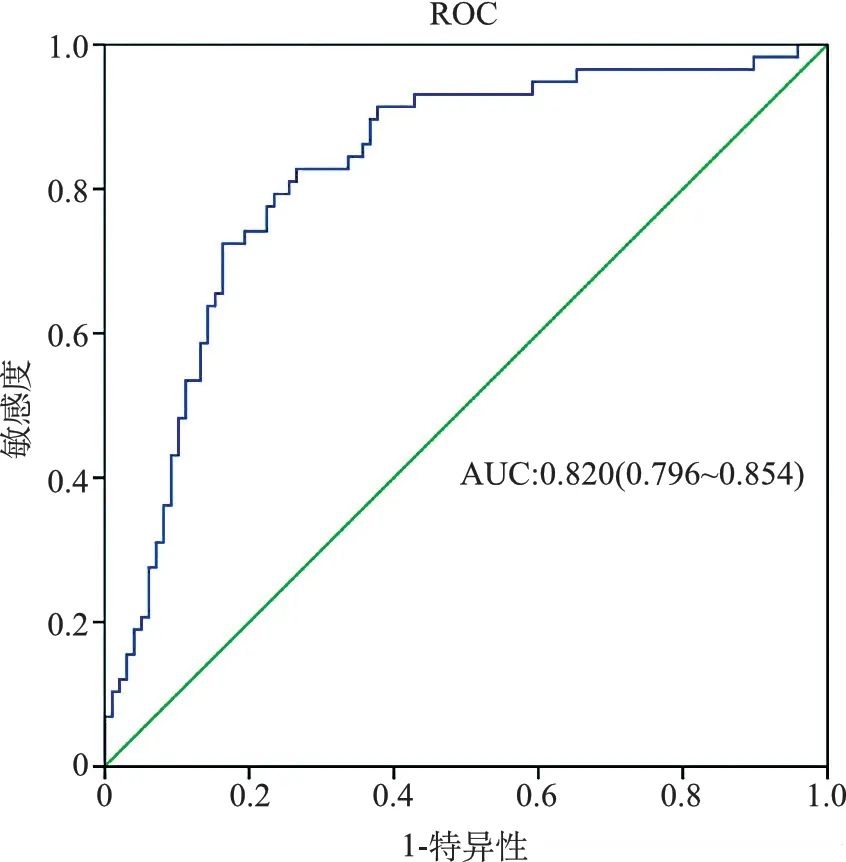
图1 TNBC病人术后生存预测模型的ROC曲线
4.TNBC病人术后生存预测模型的列线图:根据Cox多因素回归分析结果,可纳入组织学分级、淋巴结状态、肿瘤TNM分期、HIF-1α及c-myc表达等四个独立危险因素制作列线图。其中HIF-1α及c-myc表达可分为四种情况:HIF-1α和c-myc均阴性、HIF-1α阴性c-myc阳性、HIF-1α阳性c-myc阴性、HIF-1α和c-myc均阳性。
根据列线图上每一个参数对应的评分,计算出总评分,从而预测每例TNBC病人的死亡的概率。在列线图中,通过病人所有的变量值找到“评分”标尺上垂直直线对应的评分,累计所有变量值的评分,再在累计后的“总评分”标尺上找到对应的点,从而换算为“3年死亡概率”标尺上对应的概率,即为该病人的3年死亡概率。将每例病人临床信息纳入该列线图进行匹配分析,其敏感度为83.4%,特异性为76.8%,同样证明该列线图具有较高的预测价值,如图2。
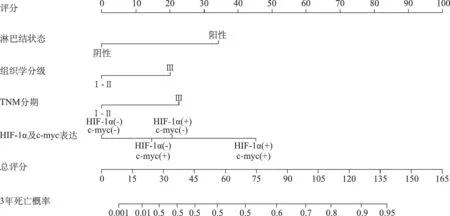
图2 TNBC病人术后生存预测模型的列线图
讨 论
TNBC具有发病年轻、低分化、侵袭性高、易转移等特点,预后极差,且当前无确切的分子靶向治疗手段,寻找有效的生物标志物来筛选不良预后病人成为当前研究的热点和难点[3-4]。
有文献报道,HIF-1α在包括乳腺癌在内的多种肿瘤中高表达,其可参与肿瘤细胞的凋亡、增殖、迁移、侵袭和新血管生成等过程[10]。作为肿瘤细胞对缺氧环境应激的转录因子,HIF-1α可调控多种下游基因,从而增加肿瘤的侵袭能力,并且使得肿瘤对外界治疗的抗性增加,可能是TNBC对放化疗不敏感和高度侵袭性的原因之一[11]。张燕等[12]发现,HIF-1α和PD-L1在TNBC中共同高表达提示预后不良,提示HIF-1α可能是TNBC术后生存的危险因素。
c-myc作为早期发现的原癌基因之一,是一种序列特异性转录因子[13]。和HIF-1α类似,c-myc基因在乳腺癌、前列腺癌、宫颈癌和结肠癌等肿瘤中高表达,并出现重排现象。c-myc与肿瘤细胞生长、凋亡、周期及肿瘤发生、进展有关[14]。Rao等[15]发现,在良性增生、非典型增生、乳腺癌中,c-myc的基因扩增是逐渐递增的,认为c-myc在肿瘤发生的早期已被激活并且参与了肿瘤发生、发展的整个过程。曾剑锋等[16]报道了c-myc与TNBC术后复发转移的关系,发现c-myc在高级别的TNBC中高表达,认为c-myc与TNBC病程进展有关,但c-myc对TNBC术后生存的影响并未研究。
本研究通过免疫组化的检测方法显示,乳腺癌组织中HIF-1α和c-myc蛋白的阳性表达率分别为45.3%和59.0%。χ2检验和Mann-Whitney秩和检验分析结果提示高表达的HIF-1α、c-myc与高恶性程度的TNBC密切正相关。Cox单因素和多因素回归分析结果显示,HIF-1α及c-myc阳性、组织学Ⅲ级、淋巴结阳性、TNM分期Ⅲ期为TNBC病人术后生存的独立危险因素,可以用来预测3年预后。具体而言,HIF-1α及c-myc均阳性的TNBC病人术后3年死亡风险是HIF-1α及c-myc均阴性病人的3.057倍,淋巴结阳性、组织学Ⅲ级、TNM分期Ⅲ期相对于淋巴结阴性、组织学Ⅰ~Ⅱ级和TNM分期Ⅰ~Ⅱ期术后3年死亡风险分别提高了1.912倍、0.785倍和0.631倍。以Cox多因素回归分析个体死亡概率对结局变量“死亡”做ROC曲线,曲线下面积为0.820,具有较高的预测价值。列线图可以根据每例TNBC病人的临床资料,计算出术后3年死亡的大致概率,其敏感度为83.4%,特异性为76.8%,同样证明该列线图具有较高的预测价值。对于临床医生来说,一旦接诊到具有上述独立危险因素的TNBC病人,需要对病人手术后的预后进行评估,尽早为病人制定科学合理的干预方案。
本研究表明,HIF-1α和c-myc高表达以及组织学Ⅲ级、淋巴结阳性、肿瘤Ⅲ期提示TNBC病人预后不良,可以用来预测其术后生存。
