肿瘤部位、体质量指数与结直肠癌病人根治术后预后的相关性分析
2022-02-13张晓南杭嘉敏毋茜苏翠萍呼艳飞张丽
张晓南 杭嘉敏 毋茜 苏翠萍 呼艳飞 张丽
结直肠癌(colorectal cancer,CRC)为全球发病率第三位的恶性肿瘤,其在我国的发病率及死亡率也呈现出不断增高趋势[1]。精准评估CRC病人预后利于指导临床采取针对性干预,改善病人预后。CRC按原发肿瘤部位不同可划分为左半结肠癌、右半结肠癌、直肠癌。将不同肿瘤部位CRC按照一种疾病治疗是不规范的[2]。有研究指出,不同肿瘤位置晚期CRC病人临床病理特征与预后存在差异[3]。多项研究证实,肥胖与甲状腺癌、乳腺癌、胰腺癌、食管癌等多种肿瘤发生、进展关系密切[4-5]。体质量指数(body mass index,BMI)为评定肥胖可靠指标。本研究探讨肿瘤部位、BMI与CRC病人根治术后预后相关性,明确肿瘤部位、BMI对病人预后的影响。
对象与方法
一、对象
2015年6月~2017年6月我院收治的CRC根治术病人102例。纳入标准:(1)符合《中国结直肠癌诊疗规范(2015版)》中CRC诊断标准[6],且经手术病理检查证实;(2)接受根治术治疗;(3)BMI≥18.5 kg/m2;(4)术前未采取放化疗;(5)临床资料齐全、随访信息完整。排除标准:合并肝、肾、脾、肺、心等重要脏器功能障碍;合并其他类型恶性肿瘤;合并肠梗阻、穿孔、出血;合并急性炎症性疾病、血液系统疾病、呼吸系统疾病、精神系统疾病;有肿瘤家族史;术后4~8周经复查显示癌细胞转移。本研究获医院医学伦理委员会审查同意,所有病人均签署知情同意书。
二、方法
1.基线资料采集:收集病人性别、年龄、吸烟史、饮酒史、病理分期、脉管瘤栓、肿瘤分化程度、淋巴结转移、肿瘤直径、肿瘤部位、BMI等资料。
2.治疗方法:对所有病人均行根治术治疗,临床分期Ⅰ~Ⅲ期病人采取原发灶与肠系膜淋巴结根治性切除术,Ⅳ期病人可切除转移灶同时行R0切除术。
3.随访:术后通过定期复查、门诊随访、电话随访方式随访5年,观察病人预后情况,每3个月采取1次门诊复查,对无法来院复查病人每3个月采取1次电话随访,随访至2022年6月30日或病人死亡,据此将病人分为死亡组、生存组。
三、统计学方法

结果
1.两组基线资料、肿瘤部位、BMI比较:本组102例行根治术治疗CRC病人5年死亡32例,归为死亡组;5年生存70例,归为生存组。两组性别、年龄、吸烟史、饮酒史、脉管瘤栓、肿瘤直径比较,差异无统计学意义(P>0.05);两组病理分期、肿瘤分化程度、淋巴结转移、肿瘤部位、BMI比较,差异有统计学意义(P<0.05)。见表1。
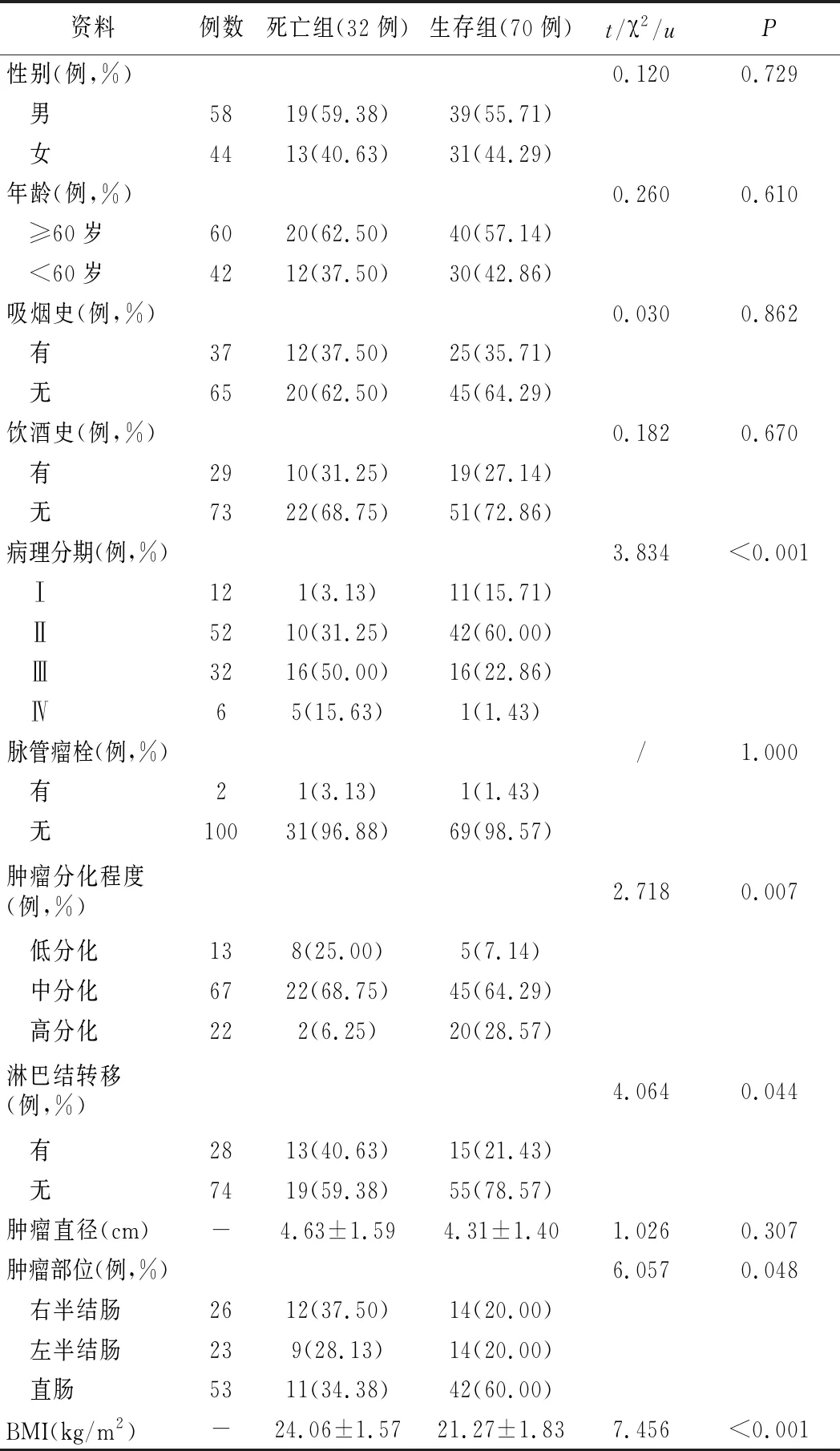
表1 两组基线资料、肿瘤部位、BMI比较
2.CRC病人根治术后预后有关影响因素分析:以CRC病人根治术后预后情况作为因变量,1=死亡,0=生存;将病理分期、肿瘤分化程度、淋巴结转移、肿瘤部位、BMI作为自变量,采取COX回归分析显示,病理分期、肿瘤分化程度、淋巴结转移、肿瘤部位、BMI均为CRC病人根治术后预后死亡的影响因素(P<0.05)。见表2。
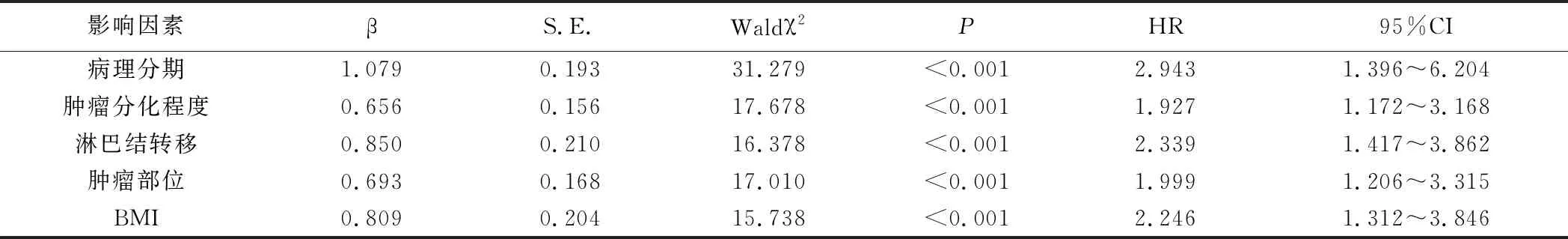
表2 CRC病人根治术后预后影响因素分析
3.矫正混杂因素后肿瘤部位、BMI与病人预后的关系:通过COX回归分析进一步矫正病理分期、肿瘤分化程度、淋巴结转移等混杂因素的影响后,肿瘤部位、BMI仍与病人预后死亡显著相关(P<0.05)。见表3。

表3 矫正混杂因素后肿瘤部位、BMI与病人预后的关系
4.肿瘤部位、BMI对病人5年预后的预测效能:阳性样本:死亡组;阴性样本:生存组;绘制肿瘤部位、BMI预测病人5年死亡的ROC曲线,结果显示,肿瘤部位、BMI联合预测时预测价值最高。见表4、图1。
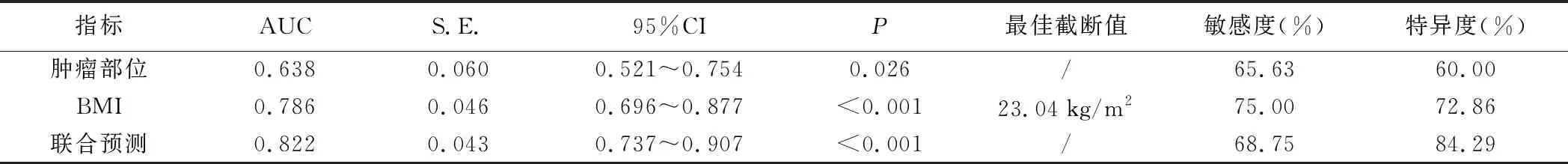
表4 ROC分析结果
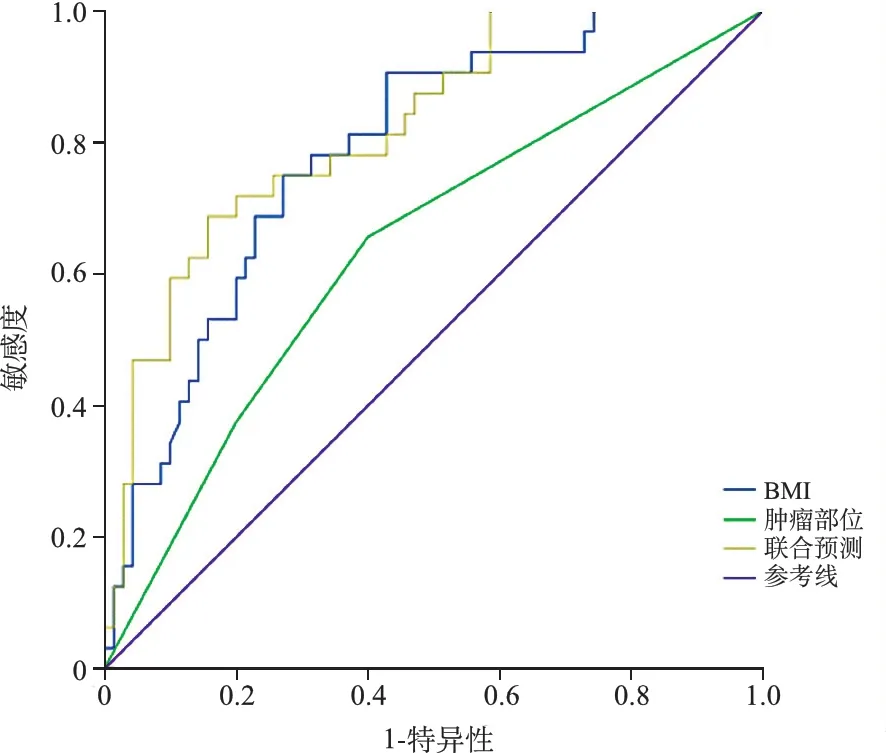
图1 肿瘤部位、BMI对病人5年预后的预测ROC曲线
5.不同肿瘤部位、BMI病人5年生存情况: 将病人分为直肠、右半结肠、左半结肠病人,并依据最佳截断值分为高BMI(≥最佳截断值)、低BMI(<最佳截断值)病人,行Kaplan-Meier曲线分析显示,肿瘤部位为直肠病人5年生存率高于右半结肠、左半结肠病人(Log-Rank χ2=7.530,P=0.023),肿瘤部位为左半结肠病人5年生存率高于右半结肠(Log-Rank χ2=5.362,P=0.042),低BMI病人5年生存率高于高BMI病人(Log-Rank χ2=24.043,P<0.001)。见图2,3。
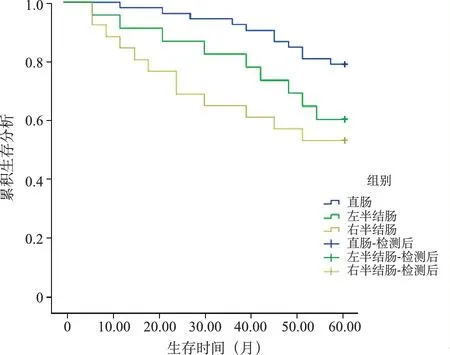
图2 不同肿瘤部位病人生存曲线
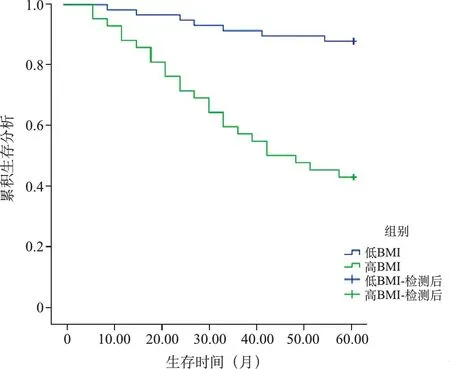
图3 不同BMI病人生存曲线
讨论
CRC按肿瘤部位可分为左半结肠癌、右半结肠癌、直肠癌,左半、右半结肠癌在血供、解剖结构、胚胎起源、临床病理特征等方面均存在区别,且结肠癌与直肠癌于发病机制、治疗方案方面也存在显著差异。陆丹等[7]研究表明,左半结肠、右半结肠、直肠癌中,右半结肠癌病人更倾向于低分化肿瘤、临床分期更晚、更易出现肠梗阻等并发症,直肠癌病人则分化程度最高、分期以Ⅰ期最多见、发生肠梗阻比例最低。有研究显示,与原发肿瘤位置为左半结肠病人比较,右半结肠病人表现出更低的总生存期(HR=1.224)[8]。本研究显示,死亡组肿瘤部位为右半结肠癌病人比例高于生存组,直肠癌病人比例低于生存组,且回归分析显示,肿瘤部位为CRC病人根治术后预后的影响因素,说明肿瘤部位与CRC病人根治术后预后有关。不同肿瘤部位CRC病人不仅具有不同的肿瘤病理特征,且其对靶向治疗药物的敏感度也不同。右半结肠起源中肠,血供丰富,利于肿瘤生长,肿瘤恶性程度更高,预后更差[9]。且右半结肠癌更易产生磷脂酰肌醇激酶-3催化亚单位 基因、鼠类肉瘤滤过性毒菌致癌同源体B1突变与超甲基化,导致病人对抗表皮生长因子受体治疗敏感度不佳,影响预后[10]。有研究表明,相较于左半结肠癌,右半结肠癌对西妥昔单抗治疗敏感性更低,预后更差[11]。本研究ROC曲线显示,肿瘤部位对预测病人5年死亡具有一定效能,与韩晶等[12]研究报道符合。临床应依据不同肿瘤部位所存在的生物学特征采取个体化精准治疗,对右半结肠癌病人加强干预。本研究生存曲线结果也直观显示出肿瘤部位与病人预后的密切关系。
近期研究发现,肥胖不仅会影响肿瘤发生进展,且会对病人远期预后产生影响[13]。国外研究显示,与正常BMI CRC病人相比,BMI较高病人死亡、复发风险更高,预后较差[14]。但也有研究报道,BMI过高与过低均为CRC术后预后不良的危险因素[15]。BMI过低会导致病人对手术等后续治疗耐受性降低,为减少混杂因素影响,本研究仅纳入BMI正常与较高病人。本研究显示,单因素分析死亡组BMI高于生存组,经COX分析明确BMI为病人预后的影响因素,表明BMI与病人预后有关。肥胖与高胰岛素血症、胰岛素抵抗具有密切关系,胰岛素处于高水平状态可导致胰岛素样生长因子的生物活性提高,刺激肿瘤细胞产生增殖与转移,且胰岛素可诱导血管生成,增强肿瘤侵袭性;肥胖还可经由慢性炎症途径促进癌症发生进展。研究报道,肥胖病人机体中多伴有免疫抑制现象,有关炎症因子可加剧全身炎症反应,致使疾病恶化风险提高,促进机体产生促炎与氧化环境,引起结直肠癌术后肿瘤复发或病灶再形成[16-17]。本研究ROC显示,BMI预测病人5年死亡的AUC为0.786,预测价值较高,与韦斌等[18]研究报道相符。对BMI较高病人应警惕预后不良的可能性,给予有效措施控制病人体重。本研究生存分析亦证实BMI与病人生存结局有关,有望作为预后评估指标。病理分期、分化程度及淋巴结转移为已知的、被大量研究证实的肿瘤预后影响因素,可能会影响研究变量(肿瘤部位、体质量指数)对病人预后结局的影响。因此,本研究将其列为了混杂因素,应用COX模型进一步将其进行控制,结果显示,肿瘤部位、BMI仍与病人预后死亡显著相关,进一步证实了肿瘤部位、BMI与病人预后的关系。ROC分析亦显示肿瘤部位联合BMI预测预后的AUC高于单一指标预测,提示肿瘤部位联合BMI为可用于预测CRC病人预后。
本研究也存在不足。病理分期、分化程度及淋巴结转移被大量研究证实的肿瘤预后影响因素。本研究采取COX回归分析显示,病理分期、肿瘤分化程度、淋巴结转移、肿瘤部位、BMI均为CRC病人根治术后预后的影响因素,与文献报道结果类似。进一步经矫正混杂因素分析,结果显示,病理分期、分化程度及淋巴结转移与CRC预后的关联被减弱,肿瘤部位与BMI与CRC病人根治术后预后密切关联。是否与纳入的案例较少、单中心研究及地域相关有关,仍需要进一步纳入更多案例进行验证。
综上,肿瘤部位、BMI与CRC病人根治术后预后密切相关,两者联合预测病人预后效能较高,临床可依据肿瘤部位、BMI为病人制定个体化治疗方案,改善预后。
