卵巢癌转移至十二指肠病例报告1例及文献复习
2022-02-13黄斌胡静李丽陈天鸣吴浦嫄吴玲祥任伟牛丰南徐新运汪强虎王立峰刘宝瑞钱晓萍
黄斌 胡静 李丽 陈天鸣 吴浦嫄 吴玲祥 任伟 牛丰南 徐新运 汪强虎 王立峰 刘宝瑞 钱晓萍
作者单位:210008 江苏省南京市,南京大学医学院附属鼓楼医院肿瘤中心,南京大学临床肿瘤研究所(黄斌,胡静,李丽,吴浦嫄,任伟,王立峰,刘宝瑞,钱晓萍);普外科(陈天鸣);病理科(牛丰南,徐新运);211166 江苏省南京市,南京医科大学生物医学工程与信息学院(吴玲祥,汪强虎)
卵巢癌很常见, 但转移到十二指肠比较少见[1]。十二指肠是一个很少被原发性和转移性肿瘤侵犯的器官[2]。现将我科近期临床中遇到的1例卵巢癌转移至十二指肠病例汇报如下,并结合文献进行相关知识复习。
1 病例资料
病人,女, 64岁,既往体健,因无明显诱因下出现腹胀1周于2020年1月16日在当地医院就诊,查腹部B超提示腹腔积液,胃镜提示十二指肠球部占位,活检病理提示腺癌,初步考虑十二指肠腺癌腹腔转移。病人2020年3月2日由门诊入院,入院时仍诉腹胀,查体腹水征阳性。2020年3月3日完善实验室检查,血清CA125:1125.90 U/mL,腹腔积液CA125:10174.40 U/mL,血清白蛋白:34.7 g/L,血清人睾丸分泌蛋白4(HE4):578.50 pmol/L。2020年3月4日查全腹部增强CT示:十二指肠球部占位,肝脏多发低密度影,网膜多发结节,腹膜后淋巴结肿大,双侧附件区囊实性占位(左:5.3 cm×3.3 cm,右:5.1 cm×3.8 cm),腹腔积液,增强后病灶不同程度强化(图1A)。2020年3月5日查妇科彩超:盆腔内混合性占位,子宫后方实性占位,子宫前方低回声占位,腹腔积液。2020年3月6日内镜显示十二指肠球部与降段交界处呈半球形突起病变,表面呈红色粗糙黏膜(图2A),内镜超声(EUS)显示低回声,横断面约为13.1 mm× 13.3 mm(图2B),病变起源于肌层,累及黏膜下层和黏膜层,未累及浆液层,多普勒未见明显血流信号,弹性成像评分为4分(图2C),腹腔内可见液性暗区及淋巴结低回声影,横断面约16.2 mm× 7.5 mm(图2D)。

注:图1A:化疗前查全腹部增强CT;图1B:4个周期(约12周)化疗后,多个病灶明显缩小;图1C:复查CT见多个病灶较前继续缩小;图1D:再次治疗4个周期(约12周)后复查CT未见明显病灶残留。

注:A:十二指肠球部与降段交界处呈半球形突起病变,表面显示红色粗糙黏膜(黑色箭头)。B:EUS示低回声改变,横断面约13.1 mm×13.3 mm。C:弹性成像评分4分。D:低回声淋巴结影,横断面约16.2 mm×7.5 mm。
十二指肠病灶活检病理 (图3A)、肝占位穿刺活检病理(图3B)、腹腔积液脱落细胞 (图3C)均提示低分化腺癌。
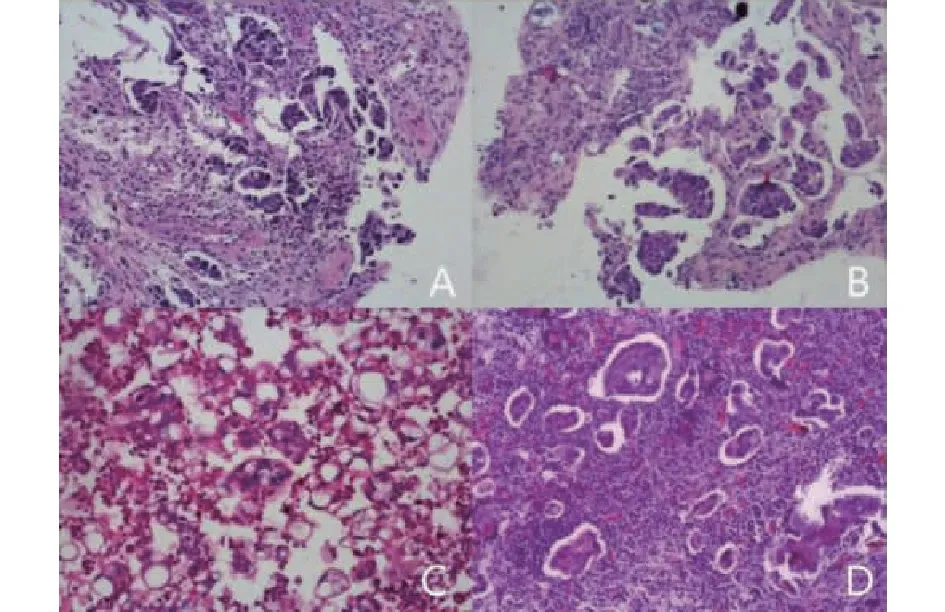
注: A:十二指肠病灶活检病理;B:肝占位穿刺活检病理;C:腹腔和盆腔积液脱落细胞;D:卵巢术后病理。
十二指肠病灶加做免疫组化Wilm’s tumor 1(WT-1)阳性(图4A), Paired box 8 (PAX8)阳性(4B),雌激素受体(ER)阳性(图4C),特异AT序列结合蛋白2(SATB2)阴性 (图4D)。肝占位病灶免疫组化WT-1阳性(图4E)、PAX8阳性(图4F)、CK19阳性(图4G)、CDX2阴性(图4H)。此外,腹腔积液脱落细胞WT-1阳性(图4I)、PAX8阳性(图4J)、ER阳性(图4K)、SATB2阴性(图4L)。卵巢术后免疫组化:WT-1 (图4M)、PAX8(图4N)、ER(图4O)、P53(图4P)均阳性。

注:十二指肠病灶: WT-1阳性(A),PAX8阳性(B),ER阳性(C),SATB2阴性(D)。肝占位病灶:WT-1阳性(E),PAX8阳性(F),CK19阳性(G),CDX2阴性(H);腹腔积液脱落细胞:WT-1阳性 (I),PAX8阳性(J),ER阳性(K),SATB2阴性(L);卵巢术后免疫组化:WT-1 (M)、PAX8(N)、ER(O)、P53(P)均阳性。
二代测序(NGS)提示TP53基因突变,但目前尚未有针对该靶点的有效靶向药物。结合临床病史、病理、免疫组化、影像学结果,考虑卵巢为原发灶。根据美国癌症联合委员会NCCN指南2020年第1版,该病人诊断为卵巢癌ⅣB (T3cN1M1b),治疗方案为第1天静脉滴注白蛋白紫杉醇100 mg,第1、8天腹腔灌注顺铂60 mg,每3周重复1次。治疗过程中,病人配合良好,腹胀逐渐缓解,无明显不良反应。治疗4个周期(约12周)后,病情明显好转,复查CT提示十二指肠病灶、肝转移灶、腹膜后肿大淋巴结均较前明显缩小,腹腔积液明显吸收,左侧附件区占位缩小为1.8 cm×0.9 cm、右侧缩小为2.9 cm×2.1 cm,疗效评价为部分缓解(PR)(图1B)。
病人于2020年6月22日行全麻下全子宫切除+双侧附件切除术+大网膜切除+腹腔肿瘤切除术,术后病理:双侧卵巢高级别浆液性癌伴化疗后改变(癌组织约占10%+)(图3D),癌组织突破双侧卵巢白膜并累及周围输卵管壁,神经未见癌组织侵犯,脉管内未见明确癌栓,子宫壁未见癌累及,宫颈及双侧宫旁标本切缘未见癌残留;网膜组织未见癌累及;盆腔病灶送检组织内见高级别浆液性癌累及;腹腔病灶送检组织内见高级别浆液性癌累及。2020年7月31日复查腹部增强CT:多个病灶较前继续缩小,未见子宫及双侧附件(图1C)。继续原方案治疗4个周期(约12周),血清CA125由2020年3月3日的1125.9 U/mL逐渐下降至2020年10月24日的4.8 U/mL,2020年12月7日复查CT未见明显病灶残留(图1D),疗效评价接近完全缓解(CR)。
2 讨论
小肠原发恶性肿瘤和转移性肿瘤都很罕见,早期症状不明显,多出现在晚期,预后很差[3-4]。确定小肠病变是原发性恶性肿瘤还是转移性肿瘤对制定治疗方案至关重要[5-6]。卵巢癌转移到肝、肺、腹腔较常见,但转移到十二指肠比较罕见。原发性肿瘤是起源于十二指肠还是起源于卵巢,应通过各种检查手段予以鉴别诊断[7]。
本例病人因腹胀、腹腔积液起病,外院胃镜提示十二指肠球部占位,活检病理提示腺癌,初步考虑十二指肠腺癌腹腔转移。然而,入院后查超声胃镜结合病理提示十二指肠病灶来源于肌层,并向黏膜层和黏膜下层侵犯,这和十二指肠腺癌来源于黏膜层不相符;肝占位病灶穿刺活检病理、腹腔积液脱落细胞病理结合免疫组化,尤其是WT-1、PAX8、ER均阳性,SATB2阴性,这些指标提示肿瘤为卵巢来源,最终诊断为卵巢癌ⅣB (T3cN1M1b)。经4个周期的白蛋白紫杉醇与顺铂联合化疗后,评价疗效为PR,进行了全子宫切除+双侧附件切除术+大网膜切除+腹腔肿瘤切除术,术后病理证实是卵巢高级别浆液性癌。术后继续原方案4个周期化疗后,影像学复查无明显残留病灶,疗效评价接近CR。
在该病例中,病人在明确诊断的基础上得到了有效的治疗,治疗效果令人满意。对于多发病变的肿瘤,应尽可能将病灶都进行病理、免疫组化和影像学检查,以提高诊断率。
