肌少症合并认知障碍对老年病人出院后不良预后的影响
2022-02-13张栌尹莫永珍欧阳晓俊王洁沈晓星朱海琼王小蓉陈娴
张栌尹 莫永珍 欧阳晓俊 王洁 沈晓星 朱海琼 王小蓉 陈娴
肌少症(sarcopenia,SP)指的是与年龄相关的骨骼肌肌量低下、肌力减退和(或)躯体活动能力下降[1],与老年病人的功能状态下降、跌倒、生活质量低下和死亡率增加等不良结局息息相关[2]。认知障碍(cognitive impairmnet,CI)的特征是认知功能的退化,介于正常衰老和痴呆之间。据报道,在有CI的老年人群中,每年有10%~15%的老年人会进展为痴呆[3]。CI与身体功能损害和生活质量下降有关,并与早期死亡率有关[4]。
SP和CI同为老年综合征,两者同时存在会对老年人造成更大危害。目前有研究显示,SP合并CI可增加老年病人出院后1年的死亡率[5],但是与其他的预后指标之间的关系尚未确定。本研究通过6个月的随访,探讨老年病人SP合并CI与死亡、跌倒、再入院、生活质量下降和自理能力减退之间的关系。
1 对象与方法
1.1 研究对象 连续纳入2019年10月至2020年1月在江苏省老年病医院住院的老年病人。纳入标准:(1)年龄≥60岁;(2)能够配合完成问卷调查、步速及握力测试。排除标准:(1)MRI或CT证实有脑梗死或脑出血;(2)有严重的心、脑血管疾病或肿瘤晚期;(3)装有心脏起搏器,不能进行生物电阻抗分析者;(4)临终状态,接受姑息治疗。
本研究已通过江苏省省级机关医院伦理委员会审批[批准文号:(2020)院伦审字第010号]。所有病人在入组前均签署知情同意书。
1.2 研究方法
1.2.1 研究分组:根据诊断结果把研究对象分为4组:无SP、无CI组;仅有SP组;仅有CI组;SP合并CI组。
(1)SP诊断:采用2019年亚洲肌少症工作组(Asian Working Group for Sarcopenia, AWGS)制定的标准[1]进行SP诊断。
(2)认知功能评估:使用MMSE量表评估研究对象的认知功能[6]。文盲(未受教育)组<17分,小学(受教育年限≤6年)组<20分,中学或以上(受教育年限>6年)组<24分为认知功能有缺陷。
1.2.2 基线资料收集:通过查阅病历和询问病史,记录所有研究对象的一般资料。包括社会人口学特征(年龄、性别)、BMI、日常用药是否>4种、近12个月有无跌倒、既往病史(高血压、糖尿病、脑血管疾病、心血管疾病、骨质疏松、肿瘤)、实验室检查结果(白蛋白、前白蛋白、CRP)以及住院天数。
1.2.3 量表评估:(1)营养:使用微型营养评定简表(mini-nutritional assessment short-form, MNA-SF)评估,总分14分。12~14分为正常营养状况,8~11分为有营养不良风险,0~7分为营养不良[7]。
(2)日常生活活动能力:分别应用基本日常生活活动能力量表(BADL)[8]以及工具性日常生活活动能力量表(IADL)[9]评估。BADL包括进食、洗澡、排便等10个条目,赋值 0~15分不等,总分100分。IADL包括打电话、做饭、使用交通工具等8 项内容,总分8分。得分越低,自理能力越差。
(3)生活质量:使用欧洲五维健康量表(EQ-5D-5L)评估[10],包含健康描述体系(EQ-5D)以及视觉模拟标尺(EQ-VAS)两部分。第一部分包括5个维度:行动能力、自己照顾自己能力、日常活动能力、疼痛或不舒服、焦虑或抑郁。每个维度又包含5个水平:没有任何困难、有轻微困难、有中等困难、有严重困难、有极其严重困难。使用基于中国人群的效用值转换体系计算EQ-5D指数,数值越高表示健康相关生活质量越好。EQ-VAS是一个长20 cm的垂直的视觉刻度尺。顶端为 100 分代表“心目中最好的健康状况”,底端为 0 分代表“心目中最差的健康状况”。
(4)共病程度:应用Charlson共病指数(CCI)评估。包含 19 种常见基础疾病,总分37分,分数越高代表共存疾病程度越高[11]。
(5)躯体功能:使用简易体能测试量表(SPPB)评估,包含平衡测试、步速测试、椅子坐起测试三部分,总分12分,得分越低表示躯体功能越差[12]。
1.2.4 随访资料收集:研究对象出院日期为随访第1天,每2个月进行一次电话回访,共3次,直至完成6个月的随访。前2次电话随访记录研究对象有无发生死亡、跌倒、再入院等不良事件,第3次电话随访增加生活自理能力以及生活质量的评估。在随访期间多次入院的病人,记录第1次再入院时间。随访窗口期为2 d,即计划随访时间与实际随访时间出入≤2 d即为按时完成随访。
2 结果
2.1 不同组别病人一般人口学及临床特征 本研究共纳入研究对象116例,年龄61~97岁,平均(81.14±9.67)岁。其中男66例,占总人数的56.90%。住院老年病人SP的检出率为34.38%(40/116);CI的检出率为42.24%(49/116);SP合并CI的检出率为18.10%(21/116)。
单因素分析结果显示,相较其他3组,SP合并CI组年龄更大,CRP水平更高,躯体活动能力得分、营养得分、生活质量得分、自理能力得分更差(P<0.05)。在仅有SP组中,BMI最小、骨质疏松比例最高(P<0.05);而住院天数在仅有CI的老年病人中最长(P=0.012)。见表1。

表1 4组间一般基线资料比较
2.2 自理能力和生活质量随访前后变化分析 将6个月随访后的EQ-5D、EQ-VAS、BADL、IADL得分减去随访前的得分,得到随访前后的差值。结果显示,相较无SP、无CI组和仅有SP组,SP合并CI组的BADL随访前后的差值更大,差异具有统计学意义(P<0.05),见表2。
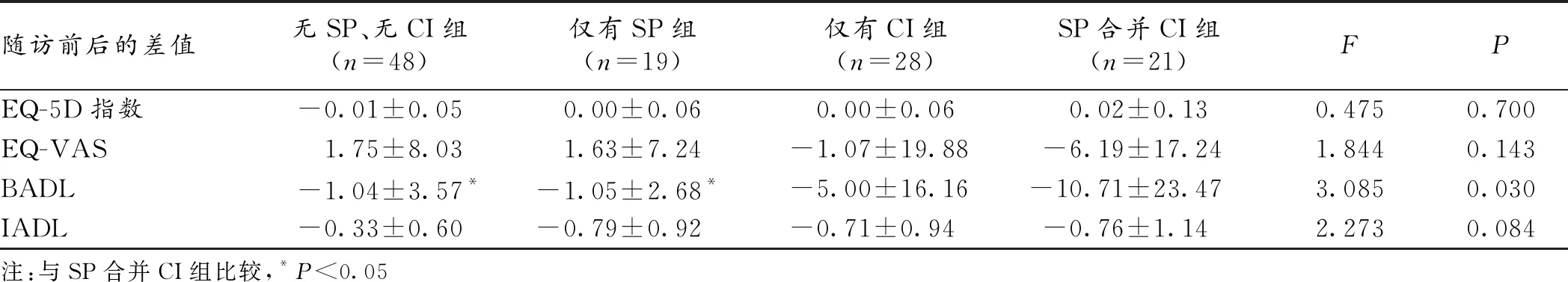
表2 4组自理能力和生活质量随访前后的差值比较
2.3 4组间死亡、跌倒、再入院情况比较 在6个月的随访期间,SP合并CI组的中位再入院时间明显短于其他组(χ2=9.283,P=0.026),见图1。4组病人间死亡率(χ2=5.971,P=0.113)和跌倒发生率差异无统计学意义(χ2=2.255,P=0.521)。
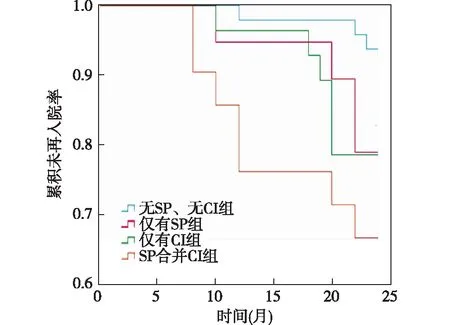
图1 4组随访期间再入院时间的Kaplan-Meier图
2.4 6个月后再入院的影响因素分析 Cox回归分析显示,SP合并CI为影响老年病人出院后6个月内再入院的独立因素(HR=6.57,95%CI:1.70~25.42,P=0.006)。即使在调节性别、年龄、多重用药、SPPB评分、IADL评分、BADL评分心血管疾病、脑血管疾病等变量后,这种关系仍然存在(HR=4.27,95%CI:1.01~18.02,P=0.048),见表3。
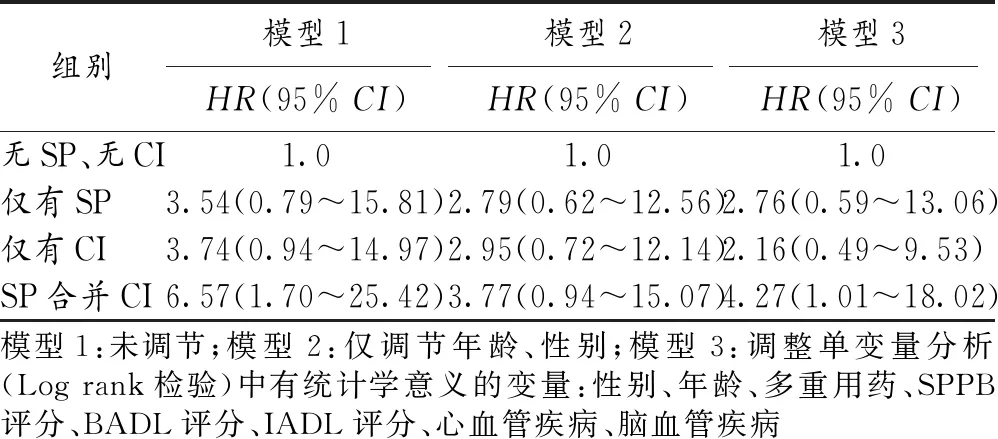
表3 6个月后再入院影响因素的Cox回归分析
3 讨论
本研究使用AWGS的诊断标准,得出住院老年人群SP的检出率为34.38%。由于诊断标准、研究人群的年龄、种族、社会和文化背景以及生活方式等方面的差异,不同的研究中SP的患病率也不同[13]。60岁及以上人群SP的检出率在9.9%~40.4%[14]。本研究使用MMSE量表筛查CI,检出率为42.24%。Maeda等[15]也同样使用MMSE量表作为老年住院病人认知功能的筛查工具,其得出CI的检出率为50.4%,高于本研究中住院老年病人CI的检出率,这可能是由于本研究的研究对象多为受教育程度较高的退休公务员。本研究中住院老年病人SP合并CI的检出率为18.10%,略高于意大利住院老年病人SP合并CI的检出率(14.26%)[5]。本研究结果提示,住院老年病人是SP、CI以及SP合并CI的高发人群,更加值得关注。
Gariballa等[16]在6个月的随访研究中发现,与SP病人相比,无SP病人的再入院风险明显降低(P=0.013)。同样,一项为期3年的随访研究显示,SP是出院老年病人3年内再入院的独立预测因子(HR=1.81,95%CI:1.17~2.80)[17]。与此同时,CI也被证明是老年病人出院后再入院的危险因素(OR=1.21,95%CI:1.04~1.40)[18]。本研究结果表明,在调整年龄、性别和其他混杂因素后,SP合并CI可以增加出院老年病人6个月再入院的风险(HR=4.27,95%CI:1.01~18.02)。
除此之外,本研究发现SP合并CI可以预测老年病人出院后6个月内日常生活自理能力的下降(P=0.030)。运动认知风险综合征(motoric cognitive risk syndrome,MCR)[19]被定义为同时存在步速下降和轻度CI,是一种与SP合并CI相似的综合征。有研究表明MCR可以预测日本老年人群失能的风险(HR=1.69, 95%CI:1.08~2.02)[20]。
因此,在临床工作中必须重视对住院老年病人SP和CI的早期筛查及干预。研究表明,有氧运动及抗阻运动可以增加SP病人的肌肉质量和力量[21-22],而抗阻训练更被证明是目前治疗SP最有效、最安全的方法[23]。同时,体育锻炼能够使CI病人的大脑区域产生结构性变化。有研究表明,1年中等强度有氧运动可使老年人海马体容量增加以及记忆力改善[24]。此外,有些营养成分可以同时干预SP和CI,如:B族维生素(尤其是叶酸)、类黄酮、抗氧化剂、维生素D和n-3脂肪酸等[25-26]。因此可以通过给予病人这些干预措施,达到事半功倍的效果。
本研究存在一些局限性:(1)入选的住院老年病人来自同一家医院,样本量较小,无法代表中国老年人群的总体水平。(2)本研究未收集研究对象出院后的营养状况、运动锻炼时间以及参与社会活动等因素,这些混杂因素可能会影响随访过程中老年病人发生不良预后的风险。(3)本研究随访时间较短,未来应在此基础上延长随访时间,探讨SP合并CI会对老年病人造成何种不良预后。
