贵州六盘水地区大白菜黑斑病病原菌鉴定及培养特性研究
2022-02-13龙巧芳蒋芹娜吴凤康杨友联张晓勇
龙巧芳 梁 文 蒋芹娜 吴凤康 李 倩 杨友联 张晓勇
(六盘水师范学院生物科学与技术学院,贵州六盘水 553004)
黑斑病又称黑霉病,是大白菜常见的重要病害之一,发病面积广,近年暴发呈上升趋势。黑斑病早期在大白菜上形成2~5 mm 的灰褐色近圆形斑,并有圆环状同心轮纹,外围呈淡黄色晕圈,病斑中央常见黑色霉状物;后期病斑逐渐扩大,病部干枯穿孔,严重时整株叶片枯死(董伟,2012)。黑斑病在早春发生最为严重,最适发病温度为13~15 ℃,低温、高湿和雨雾天气最适病害暴发和流行(邓奇,2011)。前人研究表明,链格孢属()多种真菌如芸薹链格孢、萝卜链格孢(马海霞 等,2013;云晓敏等,2015)、芸薹生链格孢、芜菁链格孢(张天宇,2003)、日本链格孢(Ren et al.,2012)、链格孢、细极链格孢(Dunbar et al.,2017;郭润婷,2018)、茄链格孢(Shi et al.,2021)等都可为害大白菜叶片并形成黑斑病症状,有时多种链格孢真菌复合致病,给病害的识别和防治造成一定困难。
前人对大白菜黑斑病病原菌已有一定研究,但该病的病原菌种类繁杂,存在明显的季节性和区域性,同时对病原菌的生物学特性研究也缺乏系统性,不利于该病的识别、传播规律调查及田间防治。本试验对贵州省六盘水地区4 个种植点的大白菜黑斑病病样进行病原菌分离,结合形态学和多基因分子生物学方法对病原菌进行鉴定,并研究了该病原菌的生物学特性和致死温度等,以期为六盘水地区大白菜黑斑病田间准确识别及防治提供理论及实践参考。
1 材料与方法
1.1 病原菌分离纯化
2019、2020 年春季分别在贵州省六盘水市钟山区明湖村、水城区野钟乡、六枝特区新场乡和盘州市大山镇4 个大白菜种植点进行田间病害调查和采样,每个种植点随机采集1 份病叶并单独装入保鲜袋中带回实验室,采用稀释涂布法分离、纯化 得 到BA20191205、BA20191215、BA190721、BA190629 等4 个菌株。菌株在PDA 试管斜面上培养10 d 后置于4 ℃冰箱保藏备用。
1.2 病原菌形态学鉴定
分别将4 个菌株接种于PDA 培养基平板上进行活化培养。打取直径6 mm 的菌落边缘小菌饼,接入另一PDA 平板中央,25 ℃、自然光照条件下培养10 d 后采用十字交叉法测量菌落直径,观察菌落特征。
同时将4 个菌株分别接种于马铃薯胡萝卜琼脂(PCA)培养基(20 g 去皮马铃薯和20 g 胡萝卜切成小块,加蒸馏水小火熬煮30 min 后双层纱布过滤得到滤液,加入18 g 琼脂,定容至1 000 mL 后灭菌备用)平板,20 ℃、自然光照条件下诱导产孢,然后刮取菌落表面分生孢子制成临时装片,采用奥林巴斯BX51 显微摄像系统对分生孢子形态特征进行观察和拍摄,并采用Spot32 v4.0.8 软件测量其显微尺寸。
1.3 病原菌分子鉴定
分别将4 个菌株接种于PDA 平板上,25 ℃恒温培养10 d 后刮取菌丝,采用改良的CTAB 法提取菌株DNA(张颖慧 等,2008)。扩增的目的序列分别为内部转录间隔区(ITS)、链格孢抗原相关蛋白基因(-)和翻译延长因子1α亚基基因(-)3 个基因片段。ITS 序列引物为ITS4(TCCTCCGCTTATTGATATGC)和ITS5(GGAAGTAAAAGTCGTAACAAGG),-序列引物为Alt-for(ATGCAGTTCACCACCATCGC)和Alt-rev(ACGAGGGTGAYGTAGGCGTC),-序列引物为EF1-526F(GTCGTYGTYATYGG HCAYGT)和EF1-1567R(ACHGTRCCRATACCAC CRATCTT)(Lawrence et al.,2013;Nishikawa &Nakashima,2020)。
PCR 反应体系及扩增程序参考Woudenberg 等(2013)的方法。扩增产物经1%琼脂糖凝胶电泳检测后,由北京擎科生物技术有限公司进行纯化和测序,所得序列已提交至GenBank。将所得序列输入GenBank 的BLAST 中进行同源序列检索,查找相似性较高的菌株(表1)。
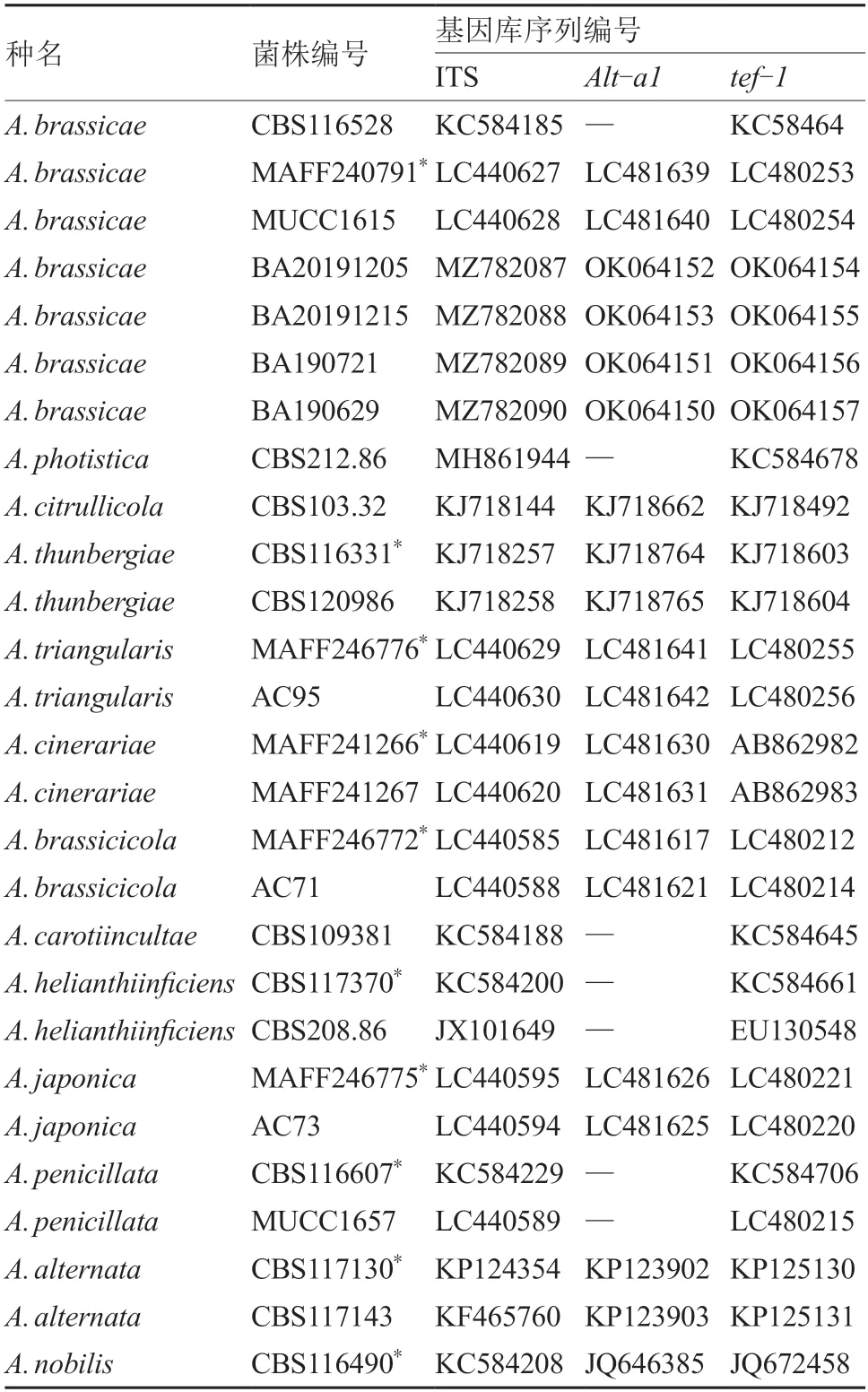
表1 参与分子系统学分析的序列
3 个基因序列利用Sequence Matrix 1.7.8 进行拼接,运用MEGA X 软件的极大似然法(maximum likelihood method,ML)构建系统发育树,确定菌株的分类地位。
1.4 菌株致病性鉴定
供试大白菜品种为中华青(市售),5 叶期选取健壮无病害的幼苗定植于装有灭菌草炭基质的花盆,置于20 ℃光照培养箱中,缓苗后使用75%的酒精棉球对叶片进行消毒,无菌水清洗4~5 次,无菌吸水纸吸去表面水分后用灼烧冷却的接种针对由内向外数第5 片叶形成微创伤口,用2 mm 打孔器打取菌株BA20191205 菌落边缘小菌块接种于微创伤口处(以菌丝面接触伤口),再将幼苗置于20 ℃、光照10 h/黑暗14 h 的光照培养箱中进行培养,7 d 后观察其致病效果。以接种直径2 mm 的无菌琼脂块为对照,每处理接种3 株,6 次重复。
如叶片发病,待病斑部位产生分生孢子后,刮取分生孢子用稀释涂布法进行分离纯化,并对分离的菌株与原菌株进行比较。
1.5 病原菌菌丝生长及孢子萌发最佳温度及pH测定
用6 mm 打孔器打取菌株BA20191205 菌落边缘菌饼,单点接种于PDA 平板中央,分别置于0、5、10、15、20、25、30、35 ℃等8 个温度条件下,每处理接种3 皿,3 次重复。10 d 后测量各处理的菌落直径。
利用1 mol·LNaOH 或HCl 调节PDA 培养基pH 值至4、5、6、7、8、9、10、11、12、13 等10 个梯度,制成平板;然后用6 mm 打孔器打取菌株BA20191205 菌落边缘菌饼,单点接种于PDA平板中央,每处理接种3 皿,3 次重复。25 ℃条件下培养7 d,测量各处理的菌落直径。
用灭菌解剖刀刮取菌株BA20191205 菌落表面的分生孢子悬浮于无菌水中,利用血球计数板统计孢子悬浮液中的孢子密度,并用无菌水稀释孢子悬浮液浓度至1 × 10个·mL。用移液枪吸取100 μL 孢子悬浮液加入PDA 平板,均匀涂布后分别置于0、5、10、15、20、25、30、35 ℃等8 个温度条件下,每处理接种3 皿,3 次重复。24 h 后将涂布平板置于奥林巴斯BX51 显微摄像系统下,随机选取10 个视野统计分生孢子萌发情况。
1.6 菌株生长最佳培养基、碳源及氮源筛选
设置5 种培养基处理:PDA 培养基、10%PDA 培养基、PCA 培养基、10% PCA 培养基、合成低营养琼脂(SNA)培养基(0.2 g KHPO,0.2 g KCl,1.0 g KNO,0.5 g MgSO·7HO,0.2 g 葡萄糖,15 g 琼脂,1 000 mL 蒸馏水,自然pH 值)(周晓榕 等,2006;张晓勇 等,2019)。用6 mm 打孔器打取菌株BA20191205 菌落边缘菌饼,单点接种于不同配方培养基平板中央,每处理接种3 皿,3次重复。25 ℃条件下培养7 d,测量各处理的菌落直径。
以查氏培养基(1 g KHPO,3 g NaNO,0.01 g FeSO,0.50 g KCl,0.50 g MgSO·7HO,30 g蔗糖,15 g 琼脂,1 000 mL 蒸馏水,自然pH 值)为基础培养基(周晓榕 等,2006),分别用相同质量的可溶性淀粉、甘油、麦芽糖、葡萄糖替代蔗糖,得到5 种含不同碳源的培养基;分别用相同质量的硝酸铵、氯化铵、蛋白胨、酵母浸粉、硝酸钾替代硝酸钠,得到6 种含不同氮源的培养基。用6 mm打孔器打取菌株BA20191205 菌落边缘菌饼,单点接种于不同碳源或氮源的培养基平板中央,每处理接种3 皿,3 次重复。25 ℃条件下培养7 d,测量各处理的菌落直径。
1.7 菌株致死温度测定
取1 000 μL 浓度为1 × 10个·mL的菌株BA20191205 孢子悬浮液,加入1.5 mL 无菌离心管中,分别放入35、40、45、50、55、60、65、70 ℃水浴中,每处理3 管,3 次重复;精确计时10 min,各处理分别取100 μL 孢子悬浮液均匀涂布于水琼脂(WA)培养基平板上(刘一贤 等,2015),25 ℃条件下培养24 h,然后在奥林巴斯BX51 显微摄像系统下随机选取10 个视野,统计分生孢子萌发情况。
1.8 数据处理
运用DPS v7.05 软件对试验数据进行方差分析和多重比较。
2 结果与分析
2.1 病原菌形态学及致病性鉴定
大白菜黑斑病主要发生在叶片上,初期形成轮纹状黑斑,严重时造成穿孔(图1-A)。经分离纯化,在PDA 平板上25 ℃培养10 d 后菌落直径为(44.6 ± 2.7)mm,边缘整齐,菌丝呈褐色,并且分泌黑褐色素,菌落表面淡黄色,背面褐色且有明显轮纹(图1-B、C)。在PCA 平板上形成的分生孢子多为单生,少数形成2~3 个孢子的短链(图1-D);孢身直立或略弯曲,淡灰褐色至褐色,倒棒状,(74.2~148.8)μm ×(16.7~35.5)μm,具横隔膜4~15 个,纵、斜隔膜0~6 个(图1-E~H);喙柱状,长28.80~84.95 μm,淡灰褐色,多有分隔。基于形态特征分析,初步将4 个菌株鉴定为芸薹链格孢(Berk.)Sacc(Wiltshire,1945)。
将菌株BA20191205 接种于健康大白菜叶片上,20 ℃培养7 d 后与对照相比,接种处形成5~10 mm 的灰褐色病斑,并有显著的圆环状同心轮纹,与田间大白菜黑斑病早期症状相似(图1-I)。再次挑取黑色霉层进行分离纯化,所得菌株菌落及分生孢子形态特征与原菌株一致。

图1 大白菜黑斑病发病症状及病原菌形态特征
2.2 病原菌分子生物学鉴定
将本试验中分离得到的4 个菌株的ITS、-和-序列与从GenBank 中下载的22 个同源性较高的序列(表1),以CBS116490 作为外类群(Nishikawa &Nakashima,2020),利用MEGA X 软件构建ML 系统发育树(图2)。结果表明,4 个菌株都与芸薹链格孢以100% 的高支持率聚为一支,即这4 个菌株均为芸薹链格孢(Berk.)Sacc。
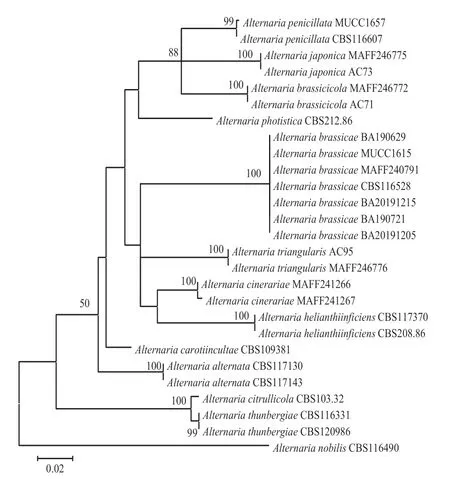
图2 基于ITS、Alt-a1 和tef-1 序列构建的ML 系统发育树
2.3 不同碳源、氮源和不同培养基对病原菌菌丝生长的影响
不同碳源、氮源和培养基配方对病原菌菌丝生长的影响达到显著水平(图3)。该病原菌在PDA培养基中的菌丝生长速度显著高于其他培养基,说明该病原菌最适生长培养基为PDA(图3-A)。相同条件下,菌株在以葡萄糖为碳源的培养基中的菌落直径显著大于其他处理,说明葡萄糖为该病原菌最佳生长碳源(图3-B);菌株在以酵母浸粉和蛋白胨为氮源的培养基中生长最佳(图3-C),菌落直径显著大于其他处理。

图3 不同碳源、氮源和不同培养基对病原菌菌丝生长的影响
2.4 不同培养温度和pH 对病原菌菌丝生长及孢子萌发的影响
不同培养温度对病原菌菌丝生长速度及孢子萌发率的影响均达到显著水平(表2)。在5~30 ℃范围内,该病原菌菌丝均可生长,孢子均能萌发,25 ℃处理的菌丝生长速度最快,孢子萌发率最高,在20~30 ℃范围内孢子萌发率差异不显著;当温度低于0 ℃或超过35 ℃后菌丝即停止生长,孢子萌发率也急剧下降。

表2 不同培养温度对病原菌菌丝生长及孢子萌发的影响
不同pH 培养基处理对病原菌菌丝生长的影响也达到了显著水平(图4),pH 值在6~8 范围内该病原菌生长良好,最佳pH 值为7。
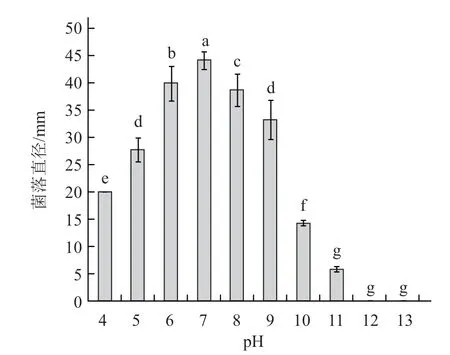
图4 不同pH 对病原菌菌丝生长的影响
2.5 病原菌致死温度测定
由图5 可知,随着处理温度的升高,病原菌孢子萌发率显著降低;当处理温度达到55 ℃后,孢子萌发率降为0。说明病原菌致死温度为55 ℃处理10 min。

图5 病原菌致死温度的测定
3 结论与讨论
近年来,大白菜黑斑病在贵州六盘水地区为害区域呈扩大趋势,前期田间调查发现,所选择的大白菜种植点在3—4 月均有黑斑病发生,严重的地块发病率达到80%~100%,给大白菜的产量和品质造成严重损失。本试验采用形态学结合ITS、-、-多基因序列分析,确定六盘水地区4个菌株均为芸薹链格孢。芸薹链格孢是世界性分布的弱寄生病原菌,其寄主专化性不强,除了常导致大白菜、萝卜、甘蓝、芥菜等芸薹属植物的叶部病害,以及芦荟(Ghosh &Banerjee,2014)、辣 根(Blagojevi et al.,2015)、龙 葵(Caesar &Lartey,2009)和 柚 木(Borges et al.,2018)等多种非芸薹属植物叶斑病,还可引起叶用莴苣(生菜)等植物的根腐病(石延霞 等,2019),对多种农作物的生产造成影响。
大白菜黑斑病病原菌较为复杂,其分布存在明显的区域性。郭润婷(2018)调查发现,大白菜黑斑病病原菌在内蒙古主要为细极链格孢,在山东主要为芸薹生链格孢,在北京主要为链格孢。同时,大白菜黑斑病病原菌分布还存在明显的季节性和周期性,秋冬季一般由芸薹链格孢引起,而春夏季主要由芸薹生链格孢引起(李明远,2004;王风敏 等,2007)。本试验中,芸薹链格孢在20~25℃下菌丝生长速度和孢子萌发率都较高,前人报道芸薹链格孢在14.6 ℃时附着胞形成率最高(马海霞 等,2013),而芸薹生链格孢最适生长温度为25~30 ℃(王春明 等,2020),说明芸薹链格孢是低温型病原菌,芸薹生链格孢是高温型病原菌,大白菜黑斑病病原菌的区域性和季节性变化是由其生物学特性决定的。本试验中早春在六盘水地区采集的大白菜黑斑病材料的病原菌均为芸薹链格孢,未发现芸薹生链格孢,与上述研究结果一致。
早期链格孢属真菌分类主要是基于分生孢子结构,Simmons(1992)依据分生孢子成链特性、孢身结构、喙的有无和喙形态等制定了详细的链格孢形态学分类标准。但链格孢种内和种间孢子形态变化幅度大,种间形态特征常常会交叉,形态鉴定无法保证准确性(张天宇,2003),且分生孢子形态会受到培养条件的影响,因此现在普遍采用PCA培养基来进行链格孢产孢诱导,以方便比较种间菌落形态、分生孢子成链特性及显微结构,以提高链格孢形态鉴定的准确度(Simmons,2007)。分子生物学方法是链格孢鉴定有力的补充,现广泛用于链格孢属真菌鉴定的基因主要有ITS、、、-、、-等(Nishikawa &Nakashima,2020)。
芸薹链格孢对环境适应性极强。该病原菌主要在植物残体和土壤中越冬,成为翌年的初侵染源(邓奇,2011)。本试验结果表明,芸薹链格孢在pH 值4~11 范围内均能生长,但对碱性条件相对较为敏感;分生孢子在55 ℃下处理10 min 即完全失去萌发能力,比李明远和柯常取(1991)测得的菌丝致死温度高5 ℃,可能是由于分生孢子耐热性高所致。因此,生产上可采用撒施石灰配合夏季高温闷棚或土壤火焰消毒等措施降低土壤初侵染菌量来预防病害的发生。芸薹链格孢分生孢子不耐干旱,需要相对湿度在75%时才能在叶片上萌发(李明远和柯常取,1991),因此生产中在持续低温、高湿条件下要重点监测和预防黑斑病。本试验中,以含蛋白质较高的酵母浸粉、蛋白胨作为氮源可显著促进芸薹链格孢生长,所以生产中要合理施肥,避免偏施氮肥,以减轻黑斑病的发生。
