lncRNA-NORAD 表达对食管癌Eca-109 细胞生物学行为的影响及其机制
2022-02-12周超锋周世繁李洪霖马纯政
周超锋, 周世繁, 田 青, 王 赛, 李洪霖, 马纯政
(河南省中医院 河南中医药大学第二附属医院肿瘤科,河南 郑州 450002)
食管癌是一种高侵袭性肿瘤。目前食管癌主要有2 种组织学类型,即食管鳞状细胞癌(esophageal squamous cancer,ESCC) 和食管腺癌(esophageal adenocarcinoma,ECA)。ESCC 作为食管癌的主要组织学类型主要发生在亚洲,占食管癌的90% 以上。由于缺乏可行的诊断策略,目前确诊时的食管癌患者多为晚期,其5 年生存率非常低[1]。长链非编码RNA (long non-coding RNA,lncRNA) 是一个长度为200 个核苷酸的非编码RNA 转录体家族,与各种类型癌症的病理发展有关[2]。研究[3]显示:lncRNA 生物学功能丰富,广泛参与生物体各类重要生理过程。研究[4]表明:lncRNA 参与了食管癌的发生发展,lncRNA-尿路上皮癌胚抗原1 (urothelial carcinoma antigen 1,UCA1) 在食管癌中作为性别决定基因相关HMG盒基因4 (sex determination gene associated with HMG box gene 4,Sox4) 的竞争性内源RNA(competing endogenous RNA,ceRNA) 促进细胞增殖。lncRNA- 浆细胞瘤转化迁移基因1(plasmacytoma variant translocation 1,PVT1) 的高表达通过诱导上皮- 间质转化(epithelialmesenchymal transition,EMT) 促进食管癌的侵袭[5]。DNA 损伤诱导的非编码RNA (non-coding RNA activated by DNA damage,NORAD) 是一种保守的lncRNA,在不同癌症发生发展过程中发挥重要的生物学功能。NORAD通过抑制miR-202-5p参与结直肠癌进展[6],通过调控miR-214/蛋白激酶B (protein kinase B,PKB) /哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)轴促进胃癌细胞增殖,抑制胃癌细胞凋亡[7]。近年来越来越多的研究[8-9]显示: miR-26a-5p 参与了胰腺导管腺癌、肝癌和结直肠癌等的发展,而且在骨肉瘤U2OS 细胞和骨髓干细胞中NORAD 与miR-26a-5p 具有靶向作用。然而,NORAD 与miR-26a-5p 在食管癌中的研究甚少,且NORAD是否通过miR-26a-5p 发挥作用尚不清楚。本文作者分析NORAD 在食管癌细胞中的表达模式和生物学功能,探讨食管癌的发病机制,为寻找食管癌有价值的治疗靶点提供理论依据。
1 材料与方法
1.1 组织标本来源收集在本院行手术治疗的45 例食管癌患者癌组织和40 例食管癌患者的癌旁正常组织标本。研究对象纳入标准:术前未接受放化疗等任何形式的抗肿瘤治疗,且经过病理诊断确诊为食管癌的患者,排除有食管癌家族史和经过放化疗等治疗的患者。本研究通过本院伦理委员会审批(审批号:20190723016),所有研究对象均签署知情同意书。
1.2 细胞、主要试剂和仪器食管癌Eca-109 细胞和人正常食管鳞状上皮Het-1A 细胞购于北京龙跃生物科技发展有限公司。青-链霉素购于北京拜尔迪生物技术有限公司(货号:30-002-CI),MTT检测试剂盒购于上海碧云天生物技术有限公司(货号:C0009S),DMEM 培养基购于武汉普诺赛生命科技有限公司(货号:PM150210B),NORAD小干扰RNA (small interfering RNA,siRNA)、pcDNA-3.1 (+)、 pcDNA-NORAD 和Unc-51 样自噬激活激酶1 (Unc-51 - like autophagy activates kinase 1,ULK1) siRNA 质粒由北京擎科生物公司合成,模拟物对照(mimics NC)、 抑制剂对照(inhibitor NC)、 miR-26a-5p 抑制剂(miR-26a-5p inhibitor) 和miR-26a-5p 模拟物(miR-26a-5p mimics) 购于上海GenePharma 公司,ULK1 抗体购自英国Abcam 公司(货号:229909)。荧光定量PCR 仪购于美国Bio-Rad 公司(货号:CFX96)。
1.3 双荧光素酶报告基因实验检测NORAD 与miR-26a-5p 的靶向关系采用miRanda 数据库检测NORAD 与miR-26a-5p 的结合位点,将NORAD 结合位点的野生序列(NORAD WT) 和突变序列(NORAD MUT) 双荧光素酶报告载体pmirGLO分别与miR-26a-5p mimics 和mimics NC 共转染至Eca-109 细胞,检测各组细胞荧光素酶活性。
1.4 双荧光素酶报告基因实验检测miR-26a-5p 与ULK1 的靶向关系采用TargetScan 数据库检测miR-26a-5p 与ULK1 的结合位点,再将含有ULK1结合位点的野生序列(ULK1 WT) 和突变序列(ULK1 MUT) 双荧光素酶报告载体分别与miR-26a-5p mimics 和mimics NC 共转染至Eca-109细胞,检测各组细胞荧光素酶活性。
1.5 细胞培养和转染取出4 ℃放置的DMEM 培养基培养的食管癌Eca-109 细胞和人正常食管鳞状上皮Het-1A 细胞,所有培养瓶中均加入10% 胎牛血清及100 U·mL-1青-链霉素,于37 ℃、5% CO2和饱和湿度条件下培养。将培养皿中长满的Eca-109 细胞按照5×104/孔的密度接种到12 孔细胞培养板中,于37 ℃、5% CO2和饱和湿度条件下培养12 h,弃培养基,用无胎牛血清的DMEM 培养基覆盖细胞,按照Turbofect 试剂说明书步骤,将不同的质粒分别转染至Eca-109 细胞,转染48 h 后采用实时荧光定量PCR (real-time fluorescence quantitative PCR,RT-qPCR) 法检测细胞转染效率,收集有效细胞用于后续实验。
根据实验目的和转染质粒的不同,Eca-109 细胞分为siRNA NC 组 和NORAD siRNA 组,inhibitor NC 组和miR-26a-5p inhibitor 组;双荧光素酶报告基因实验检测NORAD 与miR-26a-5p 的靶向关系后,将Eca-109 细胞分为pcDNA-3.1(+) + mimics NC 组、pcDNA-NORAD+mimics NC 组、pcDNA-3.1 (+) +miR-26a-5p mimics 组和pcDNA-NORAD+miR-26a-5p mimics 组; 双荧光素酶报告基因实验检测miR-26a-5p 与ULK1 的靶向关系后,将Eca-109 细胞分为siRNA NC 组和ULK1 siRNA 组,siRNA NC+inhibitor NC 组、NORAD siRNA+inhibitor NC 组、 siRNA NC+miR-26a-5p inhibitor 组和NORAD siRNA+miR-26a-5p inhibitor 组。
1.6 RT-qPCR 法检测食管癌患者癌组织、癌旁正常组织和不同细胞中NORAD mRNA、miR-26a-5p和ULK1 mRNA 表达水平取癌组织和癌旁正常组织,收集各组对数生长期细胞,采用TRIzol 技术提取组织和细胞中总RNA,紫外分光光度法检测RNA 质量和水平,利用反转录试剂盒将RNA 反转录为cDNA,实验重复3 次,以GAPDH 为内参,采用2-△△Ct法计算目的基因mRNA 相对表达水平。引物序列:NORAD 上游引物5′-TCCCATCACCATCTTCCAGG-3′(237 bp),NORAD下游引物5′-CCGTTGTCGTCAGGACTAGGTAGG-3′(224bp);miR-26a-5p 上游引物5′-ATGGTTCGTGGGTTCAAGTAATCCAGGATAGGC-3′ (168 bp) ,miR-26a-5p 下游引物5′-GCAGGGTCCGAGGTATTCG-3′ (153 bp); GAPDH 上游引物5′-CAAGGACCTCTACGCCAACAC-3′ (135 bp),GAPDH 下游引物5′-TGGAGGCGCGATGATCTT-3′(126 bp)。
1.7 MTT 法检测各组细胞活性将各组细胞按照1×105mL-1的密度分别接种于96 孔细胞培养板,培养48 h后,每孔加入MTT溶液20 μL,继续培养4 h,弃上清后,再向孔内加入DMSO 150 μL,震荡10 min,结晶充分溶解后,采用酶标仪测定波长570 nm 处的吸光度(A) 值,计算各组细胞活性。细胞活性=实验组A 值/对照组A 值×100%。
1.8 Transwell 法检测各组细胞中侵袭细胞数收集各组对数期转染成功的Eca-109 细胞,调整细胞悬液密度为1×105mL-1,采用基质凝胶涂覆Transwell 上室,静置12 h,Transwell 上室中加入细胞悬液(不含胎牛血清),Transwell 下室中加入培养基(含20% 胎牛血清),在培养箱中常规培养24 h,取出上室,用PBS 缓冲液洗涤后置于4% 多聚甲醛中固定10 min,再用PBS 缓冲液洗涤3 次,结晶紫溶液染色,用蒸馏水漂洗,倒置显微镜下随机选取5个视野,计数细胞数,取平均值,即侵袭细胞数。
1.9 Western blotting 法检测各组细胞中E-钙黏蛋白(E-cadherin)、N-钙黏蛋白(N-cadherin)和ULK1蛋白表达水平采用裂解液裂解各组细胞,提取各组细胞蛋白,测定所提取的蛋白浓度。采用沸水使细胞蛋白充分变性,冷却后取适量的蛋白凝胶进行SDS-PAGE 电泳实验,电泳结束后,通过湿转仪器将蛋白转印到PVDF 膜上,利用PBST (含5%脱脂奶粉) 在4 ℃条件下孵育,膜上加入一抗,孵育2 h,在PVDF 膜上加入稀释的二抗,1 h 后用TBST 清洗后加入ECL 显影,采用Image J 软件进行灰度值分析,计算目的蛋白表达水平。目的蛋白表达水平=目的蛋白条带灰度值/GAPDH条带灰度值。
1.10 统计学分析采用SPSS 19.0 统计软件进行统计学分析。不同组织和各组细胞中NORAD mRNA、miR-26a-5p 和ULK1 mRNA 表达水平,各组细胞活性、侵袭细胞数、细胞荧光素酶活性及E-cadherin、N-cadherin 和ULK1 蛋白表达水平均符合正态分布,以x±s表示,多组间样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,2 组间样本均数比较采用t检验。以P<0.05 为差异有统计学意义。
2 结 果
2.1 食管癌组织和细胞中NORAD mRNA、miR-26a-5p 和ULK1 mRNA 表达水平食管癌组织中NORAD 和ULK1 mRNA 表达水平(2.12±0.35和2.18±0.34) 明显高于癌旁正常组织(1.11±0.65 和1.09±0.66)(P<0.01),Eca-109 细胞中NORAD 和ULK1 mRNA 表达水平(2.07±0.34和1.93±0.25) 明显高于Het-1A 细胞(1.31±0.21 和1.35±0.27)(P<0.01)。食管癌组织中miR-26a-5p 表达水平(0.49±0.48) 明显低于癌旁正常组织(1.16±0.44)(P<0.01),Eca-109 细胞中miR-26a-5p 表达水平(0.51±0.15) 明显低于Het-1A 细胞(1.28±0.46)(P<0.01)。
2.2 沉默NORAD 实验各组细胞中NORAD mRNA 表达水平、细胞活性、侵袭细胞数和细胞中E-cadherin 及N-cadherin 蛋白表达水平与siRNA NC 组比较,NORAD siRNA 组细胞中NORAD mRNA 表达水平和细胞活性明显降低(P<0.01),侵袭细胞数明显减少( P<0.01 ),细胞中E-cadherin 蛋白表达水平明显升高(P<0.01),N-cadherin 蛋白表达水平明显降低(P<0.01)。见表1 和图1 及2。
表1 沉默NORAD 实验各组细胞中NORAD mRNA 表达水平、细胞活性和侵袭细胞数Tab.1 Expression levels of NORAD in cells,cell viabilities and number of invasion cells in various groups in silencing experiment (n=9,±s)

表1 沉默NORAD 实验各组细胞中NORAD mRNA 表达水平、细胞活性和侵袭细胞数Tab.1 Expression levels of NORAD in cells,cell viabilities and number of invasion cells in various groups in silencing experiment (n=9,±s)
*P<0.01 compared with siRNA NC group.
Group SiRNA NC NORAD siRNA NORAD mRNA 1.18±0.57 0.50±0.43*Cell viability(η/%)68.53±3.68 42.75±6.25*Number of invasion cells 80.56±7.58 35.82±8.26*

图1 沉默NORAD 实验Transwell 法检测各组细胞侵袭情况(结晶紫, ×200)Fig.1 Invasion of cells in various group detected by Transwell assay in NORAD silencing experiment(Crystal violet,×200)
2.3 NORAD 与miR-26a-5p 的靶向关系采用miRcode 数据库预测NORAD 与miR-26a-5p 的结合位点(图3)。与NORAD WT+mimics NC 组比较,NORAD WT+miR-26a-5p mimics 组细胞荧光素 酶 活 性 明 显 降 低(P<0.01); 与NORAD MUT+mimics NC 组 比 较,NORAD MUT+miR-26a-5p mimics 组细胞荧光素酶活性差异无统计学意义(P>0.05)。表明NORAD 与miR-26a-5p之间具有靶向关系。见图4。

图3 NORAD 与miR-26a-5p 的结合位点Fig.3 Binding sites of NORAD and miR-26a-5p

图4 双荧光素酶报告基因实验检测NORAD 与miR-26a-5p 靶向关系时各组细胞荧光素酶活性Fig.4 Luciferase activities of cells in various groups in dual luciferase reporter gene assay for detecting target relationship between NORAD and miR-26a-5p
2.4 沉默miR-26a-5p 实验各组细胞中miR-26a-5p表达水平、细胞活性、侵袭细胞数和细胞中E-cadherin 及N-cadherin 蛋白表达水平与inhibitor NC 组比较,miR-26a-5p inhibitor 组细胞中miR-26a-5p 表达水平明显降低(P<0.01),细胞活性明显升高(P<0.01),侵袭细胞数明显增加(P<0.01),细胞中E-cadherin 蛋白表达水平明显降低(P<0.01),N-cadherin 蛋白表达表达水平明显升高(P<0.01)。见表2 和图5 及6。

图2 沉默NORAD 实验Western blotting 法检测各组细胞中E-cadherin 和N-cadherin 蛋白表达电泳图(A)和直条图(B)Fig.2 Electrophoregram(A) and histogram (B) of expressions of E-cadherin and N-cadherin proteins in cells in various groups detected by Western blotting methods in NORAD silencing experiment
表2 沉默miR-26a-5p 实验中各组细胞中miR-26a-5p 表达水平、细胞活性和侵袭细胞数Tab.2 Expression levels of miR-26a-5p in cells,cell viabilities and number of invasion cells in various groups in miR-26a-5p silencing experiment (n=9,±s)

表2 沉默miR-26a-5p 实验中各组细胞中miR-26a-5p 表达水平、细胞活性和侵袭细胞数Tab.2 Expression levels of miR-26a-5p in cells,cell viabilities and number of invasion cells in various groups in miR-26a-5p silencing experiment (n=9,±s)
*P<0.01 compared with inhibitor NC group.
Group Inhibitor NC MiR-26a-5p inhibitor miR-26a-5p 1.16±0.28 0.52±0.26*Cell viability(η/%)62.86±4.53 85.28±5.36*Number of invasion cells 50.58±7.26 98.29±6.56*

图5 沉默miR-26a-5p 实验Transwell 法检测各组细胞侵袭情况(结晶紫, ×200)Fig.5 Invasion of cells in various groups detected by Transwell assay in miR-26a-5p silencing experiment(Crystal violet ,×200)

图6 沉默miR-26a-5p 实验Western blotting 法检测各组细胞中E-cadherin 和N-cadherin 蛋白表达电泳图(A)和直条图(B)Fig.6 Electrophoregram (A) and histogram (B) of expressions of E-cadherin and N-cadherin in cells in various groups detected by Western blotting method in miR-26a-5p silencing experiment
2.5 上调NORAD 和miR-26a-5p 实验各组细胞活性、侵袭细胞数和细胞中E-cadherin 及N-cadherin蛋白表达水平与pcDNA-3.1(+)+mimics NC组比较,pcDNA-NORAD+mimics NC 组细胞活性明显升高(P<0.01)、 侵袭细胞数明显增加(P<0.01),pcDNA-3.1 (+) +miR-26a-5p mimics 组细胞活性明显降低(P<0.01)、侵袭细胞数明显减少(P<0.01);与pcDNA-3.1 (+) +miR-26a-5p mimics 组 比 较,pcDNA-NORAD+miR-26a-5p mimics 组细胞活性明显升高(P<0.01),侵袭细胞数明显增加(P<0.01)。与pcDNA-3.1 (+) +mimics NC 组比较,pcDNA-NORAD+mimics NC组细胞中E-cadherin 蛋白表达水平明显降低(P<0.01)、 N-cadherin 蛋白表达水平明显升高(P<0.01),pcDNA-3.1 (+) +miR-26a-5p mimics 组细胞中E-cadherin 蛋白表达水平明显升高(P<0.01)、 N-cadherin 蛋白表达水平明显降低(P<0.01);与pcDNA-3.1 (+) +miR-26a-5p mimics组比较,pcDNA-NORAD+miR-26a-5p mimics 组细胞中E-cadherin 蛋白表达水平明显降低(P<0.01),N-cadherin 蛋白表达水平明显升高(P<0.01)。见表3 和图7 及8。

图7 上调NORAD 和miR-26a-5p 实验Transwell 法检测各组细胞侵袭情况(结晶紫, ×200)Fig.7 Invasion of cells in various groups detected by Transwell assay in up-regulated NORAD and miR-26a-5p experiment(Crystal violet ,×200)
表3 上调NORAD 和miR-26a-5p 实验中各组细胞活性和侵袭细胞数Tab.3 Cell viabilities and number of invasion cells in various groups in up-regulated NORAD and miR-26a-5p experiment(n=9,±s)

表3 上调NORAD 和miR-26a-5p 实验中各组细胞活性和侵袭细胞数Tab.3 Cell viabilities and number of invasion cells in various groups in up-regulated NORAD and miR-26a-5p experiment(n=9,±s)
*P<0.01 compared with pcDNA-3.1(+)+mimics NC group ;△P<0.01 compared with pcDNA-3.1(+)+miR-26a-5p mimics group.
Group PcDNA-3.1(+)+mimics NC PcDNA-NORAD+mimics NC PcDNA-3.1(+)+miR-26a-5p mimics PcDNA-NORAD+miR-26a-5pmimics Cell viability(η/%)45.36±5.63 82.48±6.58*23.46±6.36*60.82±6.72△Number of invasion 60.82±6.72 120.56±7.85*30.58±7.83*62.65±7.25△
2.6 miR-26a-5p 与ULK1 的靶向关系采用TargetScan 数据库预测miR-26a-5p 与ULK1 的结合位点见图9。与ULK1 WT+mimics NC 组比较,ULK1 WT+ miR-26a-5p mimics 组细胞荧光素酶活性明显降低(P<0.01);与ULK1 MUT+mimics NC 组比较,ULK1 MUT+miR-26a-5p mimics 组细胞荧光素酶活性差异无统计学意义(P>0.05)。表明miR-26a-5p 与ULK1 之间具有靶向关系。见图10。

图9 miR-26a-5p 与ULK1 的结合位点Fig.9 Binding sites of miR-26a-5p and ULK1
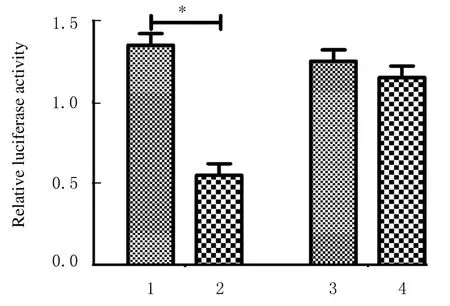
图10 双荧光素酶报告基因实验检测miR-26a-5p 与ULK1 靶向关系时各组细胞荧光素酶活性Fig.10 Luciferase activities of cells in various groups in dual luciferase reporter gene assay for detecting target relationship between miR-26a-5p and ULK1
2.7 沉默ULK1 实验各组细胞中ULK1 mRNA 表达水平、细胞活性、侵袭细胞数和细胞中E-cadherin及N-cadherin 蛋白表达水平与siRNA NC 组比较,ULK1 siRNA 组细胞中ULK1 mRNA 表达水平和细胞活性明显降低(P<0.01),侵袭细胞数明显减少(P<0.01),细胞中E-cadherin 蛋白表达水平明显升高(P<0.01),N-cadherin 蛋白表达水平降低(P<0.01)。见表4 和图11 及12。
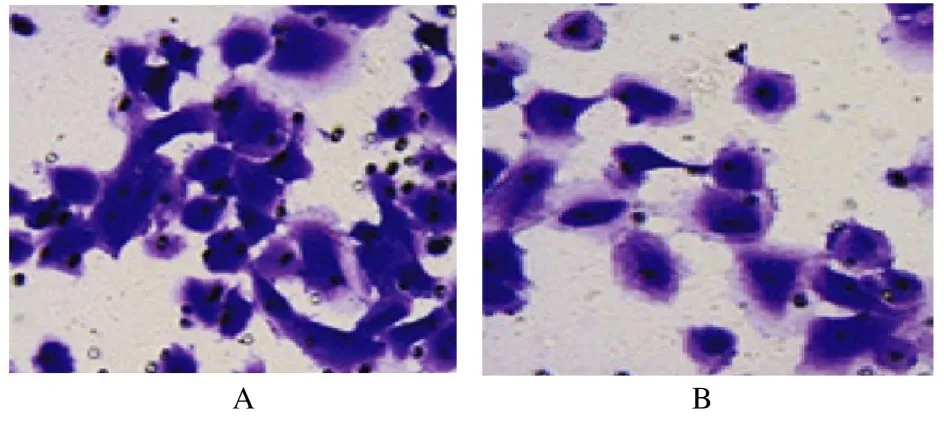
图11 沉默ULK1 实验Transwell 法检测各组细胞侵袭情况(结晶紫,×200)Fig.11 Invasion of cells in various groups detected by Transwell assay in ULK1 silencing experiment (Crystal violet, ×200)
表4 沉默ULK1 实验各组细胞中ULK1 mRNA 表达水平、细胞活性和侵袭细胞数Tab.4 Expression levels of ULK1 mRNA in cells, cell viabilities, and number of invasion cells in various groups in ULK1 silencing experiment (n=9,±s)

表4 沉默ULK1 实验各组细胞中ULK1 mRNA 表达水平、细胞活性和侵袭细胞数Tab.4 Expression levels of ULK1 mRNA in cells, cell viabilities, and number of invasion cells in various groups in ULK1 silencing experiment (n=9,±s)
*P<0.01 compared with siRNA NC group.
Group SiRNA NC ULK1 siRNA ULK1 mRNA 1.26±0.44 0.54±0.32*Cell viability(η/%)82.56±4.52 43.89±6.27*Number of invasion cells 70.62±5.75 38.65±6.28*

图8 上调NORAD 和miR-26a-5p 实验Western blotting法检测各组细胞中E-cadherin及N-cadherin蛋白表达电泳图(A)和直条图(B)Fig.8 Electrophoregram(A) and histogram(B) of expressions of E-cadherin and N-cadherin in cells in various groups detected by Western blotting method in up-regulated NORAD and miR-26a-5p experiment
2.8 上调NORAD 下调miR-26a-5p 实验各组细胞中ULK1 mRNA 和蛋白表达水平与siRNA NC+inhibitor NC 组(0.96±0.05 和0.72±0.05) 比较,NORAD siRNA+inhibitor NC 组细胞中ULK1 mRNA 和蛋白表达水平(0.48±0.08 和0.23±0.02) 明显降低(P<0.01),siRNA NC+miR-26a-5p inhibitor 组细胞中ULK1 mRNA 和蛋白表达水平(1.75±0.62 和1.48±0.31) 明显升高(P<0.01); 与siRNA NC+miR-26a-5p inhibitor 组比较,NORAD siRNA+miR-26a-5p inhibitor 组细胞中ULK1 mRNA 和蛋白表达水平(0.89±0.06 和0.75±0.28) 明显降低(P<0.01)。见图13。
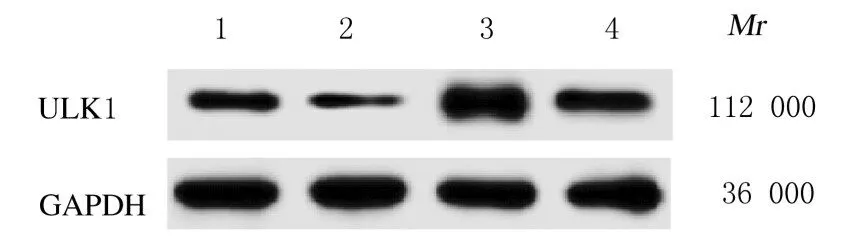
图13 上调NORAD 下调miR-26a-5p 实验Western blotting 法检测各组细胞中ULK1 蛋白表达电泳图Fig.13 Electrophoregram of ULK1 protein in cells in various groups detected by western blotting method in up-regulated mRNA down-regulated miR-26a-5p experiment
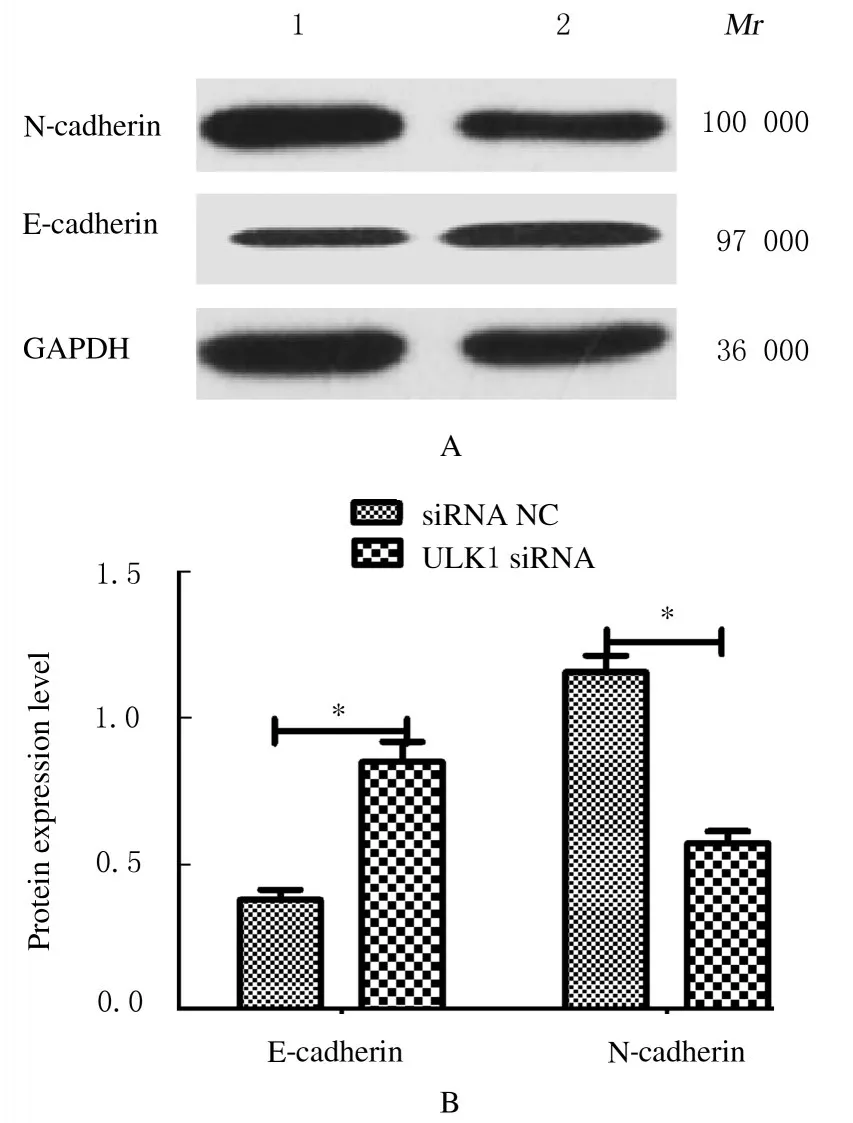
图12 沉默ULK1 实验Western blotting 法检测各组细胞中E-cadherin 及N-cadherin 蛋白表达电泳图(A)和直条图(B)Fig.12 Electrophoregram(A) and histogram(B) of expressions of E-cadherin and N-cadherin in cells in various groups detected by Western blotting method in ULK1 silencing experiment
3 讨 论
lncRNA 是一类转录本长度超过200 个核苷酸且无蛋白编码功能的RNA 分子,在基础转录机制中对基因转录、RNA 剪接和表观遗传等调控方面均发挥不同的作用。近年来,在肿瘤的发生发展过程中发挥重要作用的lncRNA 已被发现,并成为肿瘤诊疗研究的热点[10-12]。研究[13]显示: lncRNA-肌动蛋白丝相关蛋白1-反义RNA1 (actin filamentassociated protein 1-antisense RNA1,AFAP1-AS1)过表达促进胃癌细胞增殖和侵袭。也有研究[14]显示: lncRNA- 烟酰胺核苷酸转氢酶反义RNA1(nicotinamide nucleotide transhydrogenase-antisense RNA1,NNT-AS1) 通过NNT-AS1/miR-3666/E2F 转录因子2 (E2F transcription factor 2,E2F2)轴调控肺癌的进展。同源盒A11 反义RNA(homeobox A11 antisense RNA,HOXA11-AS) 能通过与miRNA 和zeste 2 多梳抑制复合物2 亚基增强子(enhancer of zeste 2 polycomb repressive complex 2 subunit,EZH2) 蛋白等相互作用促进肿瘤增殖和转移等恶性生物学行为[15]。研究[13-15]表明:lncRNA 与肿瘤的发展有密切关联。NORAD在非小细胞肺癌、结直肠癌、宫颈癌和胃癌等发生发展过程中起重要的作用。有研究[16]表明:NORAD 参与了结直肠癌和胃癌的进展,且食管鳞状细胞癌中NORAD 的表达与不良预后有关联。但NORAD 调控Eca-109 细胞的作用机制目前尚未见相关报道。本研究结果显示:NORAD 在Eca-109细胞和食管癌组织中的表达水平明显升高,与NORAD 在结直肠癌和胃癌等组织中的表达一致,均在癌细胞中出现了高表达,考虑到NORAD 在其他癌症中发挥的癌基因作用,推测NORAD 在食管癌中也可能具有同样的生物学功能。本研究进一步探讨NORAD 对Eca-109 细胞增殖、 侵袭和EMT的影响及其作用机制,结果显示:采用siRNA 技术沉默NORAD 可以明显抑制Eca-109 细胞的增殖,NORAD 在食管癌发展过程中作为癌基因发挥重要作用,是一个潜在的治疗靶点。
lncRNA 通过ceRNA 与miRNA 相互作用,在肿瘤的发生发展过程中发挥重要作用,进而调控癌症进展[17]。lncRNA-核仁小分子RNA 宿主基因1(small nucleolar RNA host gene 1,SNHG1) 通过海绵化miR-145-5p 上调异黏蛋白(metadherin,MTDH) 表达,促进非小细胞肺癌进展[18]。lncRNA- 癌症易感性候选基因11 (cancer susceptibility 11,CASC11) 通过miRNA-150 促进膀胱癌细胞增殖[19]。异丙酚通过减轻lncRNAHOXA11 基因反义RNA (HOXA11 antisense RNA,HOXA11-AS) 对miRNA let-7i 的抑制,促进结直肠癌细胞凋亡[20]。本文作者研究了NORAD 与miR-26a-5p 的关系,通过miRcode 数据库分析确定了NORAD 与miR-26a-5p 之间具有结合位点,进一步证明miR-26a-5p 是NORAD 的下游靶向基因。为了研究NORAD 与miR-26a-5p之间的调控关系,推测NORAD 可以海绵化miR-26a-5p,降低miR-26a-5p 的作用。本研究结果表明: NORAD 的生物学功能是通过调控miR-26a-5p实现的,过表达NORAD通过miR-26a-5p影响Eca-109 细胞的增殖、侵袭和EMT。研究[21]显示:lncRNA-H19/miR-194/ PFTAIRE 蛋白激酶1 (PFTAIRE protein kinase 1,PFTK1) 轴调控胰腺癌细胞增殖和迁移。本研究结果表明:miR-26a-5p与ULK1 具有靶向关系。ULK1 是自噬相关基因,也是哺乳动物细胞自噬通路的关键基因,通过上游信号传导,与其他下游自噬相关蛋白相互耦合,形成不同复合体对自噬进行调节,在肿瘤的发生发展过程中起着重要作用。研究[22]显示:磷酸腺苷激活蛋白激酶(AMP-activated proteinkinase,AMPK) /ULK1 通路介导了胃癌细胞的自噬。自噬蛋白ULK1 在人肝癌细胞中调控叉头框蛋白M1(forkhead box M1,FOXM1) 信号通路[23]。本研究结果显示:ULK1 在Eca-109 细胞中表达水平升高,下调ULK1 能够抑制Eca-109 细胞的增殖、侵袭和EMT,表明沉默NORAD 通过miR-26a-5p/ULK1 轴抑制食管癌细胞增殖。
综上所述,本研究证明了NORAD 通过miR-26a-5p/ULK1 轴调节Eca-109 细胞的增殖、侵袭和EMT,从而促进食管癌的进展。本研究对食管癌进展的分子机制有了新的认识,为食管癌患者的治疗提供了一个潜在的治疗靶点。
