基于SEER数据的原发性小肝癌肝切除术后生存率列线图模型的构建及验证
2022-02-12唐豪佑黄孝彬邓大炜李建水
唐豪佑, 刘 胜, 曾 新, 黄孝彬, 杨 洋, 邓大炜, 李建水
川北医学院附属医院 肝胆外二科, 四川 南充 637000
肝细胞癌(HCC)是世界上最常见的消化系统恶性肿瘤之一,每年约85万新发患者[1]。同时,HCC也是世界上导致癌症相关死亡的第二大恶性肿瘤[2]。小肝癌(单个肿瘤≤5 cm,多个但不超过3个肿瘤且最大直径≤3 cm)[3-4]的治疗主要是手术切除、肝移植、射频消融等方法,但相较于其他肝癌而言,小肝癌具有手术切除率高、分化较好等特点[5-6]。尽管已有研究[7]认为,孤立性小肝癌患者更应该接受肝移植治疗,但是肝移植手术费用及供肝短缺的影响,所以临床上首选手术切除来治疗小肝癌。虽然目前已有相关肝癌术后生存率列线图模型的研究[8],同时也有利用美国在线数据库建立小肝癌生存率模型的研究[4],但是并未单独分析肝切除术后的生存率模型,同时肝癌的发病率及预后种族差异较大[9],所以是否适用于中国本土尚值得商榷。而且将复杂的回归方程可视化的列线图,可以使模型结果更具有可读性、简洁性,方便临床医生对患者进行更快速的评估[10]。本研究旨在利用美国在线癌症数据库的大样本数据结合中国本土数据建立小肝癌患者肝切除术后1、2、3年生存率的列线图模型,给临床工作者提供简洁的辅助工具。
1 资料与方法
1.1 研究对象 使用国际肿瘤学编码第三版(ICD-0-3)中形态学编码(8170/3-8075/3)提取2004年—2015年美国国立癌症研究所SEER数据库所登记的HCC患者69 135例。筛选纳入标准:(1)原发性肝脏肿瘤;(2)符合小肝癌(单个肿瘤≤5 cm,多个但不超过3个肿瘤且最大直径≤3 cm);(3)临床资料完整者。排除标准:(1)非原发性肿瘤;(2)非HCC;(3)相关甲胎蛋白(AFP)、肿瘤大小、肿瘤个数等临床信息不完整者;(4)总生存时间、生存结局不完善者。最终共纳入例患者1809例患者作为建模组。
选取2010年—2017年在川北医学院附属医院接受肝切除术的小肝癌患者进行回顾性研究。纳入标准:肿瘤直径≤5 cm;术后活检证实为HCC;首次接受肝脏切除手术;随访资料、随访结局、临床治疗完整者。排除标准:再次切除;术前已行射频消融、经肝动脉化疗栓塞(TACE)、化疗、放疗等处理;其他组织学类型的肿瘤;肿瘤分化、转移等信息不完整。最终,158例患者被纳入本研究作为外部验证组。
1.2 相关定义 Seer分期:L期为肿瘤局限于其原发器官,没有播散证据;R期为肿瘤已经扩散原发器官蔓延到邻近淋巴结或组织器官;D期为肿瘤已经蔓延到其原发器官远处的组织、淋巴结、器官。总体生存期(overall survival,OS):术后至死亡或随访结束,无论何种原因导致的死亡。
1.3 随访 建模组最后随访时间为2019年11月。验证组患者出院后,对患者进行随访,直至2019年12月或死亡。随访内容包括血液检查(血细胞、肝功能、AFP水平)和影像学检查(内脏超声检查、计算机断层扫描或磁共振成像)。
1.4 伦理学审查 本研究方案经川北医学院附属医院伦理委员会的批准,批号: 2020ER(A)069。
1.5 统计学方法 采用SPSS 25.0软件对所收集的数据进行综合统计学分析,采用Kaplan-Meier计算建模组及验证组累积生存率,采用单因素Cox风险回归分析小肝癌患者肝切除术后OS的影响因素,将有统计学意义的指标纳入lasso回归及交叉验证法中进一步筛选,避免一定程度过度拟合,将再次筛选出的指标纳入多因素Cox回归分析确定小肝癌切除术后OS的独立危险因素。将有统计学意义的多因素Cox回归风险模型的指标利用R 3.6.3中rms、glmnet、survival、timeROC等构建列线图模型,再计算一致性指数(C指数)、绘制校准曲线(采用1000次Bootstrap自动抽样法)及ROC曲线检验模型的可靠性。利用Kaplan-Meier生存分析和log-rank检验分析高、低风险组间的生存差异(根据所建立的列线图总分的ROC曲线得出的最佳截取值分为高风险组及低风险组)。P<0.05为差异有统计学意义。
2 结果
2.1 建模组和验证组的一般资料及建模组单因素及多因素Cox回归分析 建模组中位随访时间为49个月,死亡924例,1、2、3年累积生存率分别为87.7%、79.0%、70.4%;验证组中位随访时间为29个月,死亡65例,1、2、3年累积生存率分别为87.1%、68.5%、60.3%。建模组和验证组的一般资料见表1。单因素Cox回归分析排除年龄、N分期、肿瘤个数(P>0.05),对剩余的7个变量进行lasso回归分析及交叉验证,避免一定程度的过度拟合(图1),未发现进一步排除因素,多因素Cox风险回归分析发现性别、Seer分期、肿瘤直径、脉管侵犯或转移、AFP是小肝癌患者肝切除术后OS的独立危险因素(P值均<0.05)(表2)。

表1 建模组和验证组一般资料
2.2 小肝癌患者肝切除术后OS列线图的建立及验证 将上述多因素Cox分析有意义的指标纳入R软件中建立小肝癌患者肝切除术后OS列线图(图2),用来预测小肝癌患者1、2、3年的OS模型,建模组C指数为0.621,验证组C指数为0.718;说明该模型有一定的准确度,校准曲线(图3)进行外部验证表明模型预测1、2、3年的OS与实际的OS有较好的一致性。建模组1、2、3年ROC曲线下面积分别为0.666(95%CI:0.628~0.704)、0.678(95%CI:0.647~0.708)、0.663(95%CI:0.635~0.690)。验证组的1、2、3年ROC曲线下面积分别为0.695(95%CI:0.593~0.797)、0.781(95%CI:0.706~0.856)、0.759(95%CI:0.669~0.848) (图4a、b)。根据列线图模型计算小肝癌肝切除术后OS的总分,并利用ROC曲线得出总分的最大约登指数对应的最佳截取值为45分,以≥45分为高风险组,<45分为低风险组,Kaplan-Meier生存分析显示:建模组和验证组的低风险组的预后均明显优于高风险组(P<0.01)(图4c、d)。
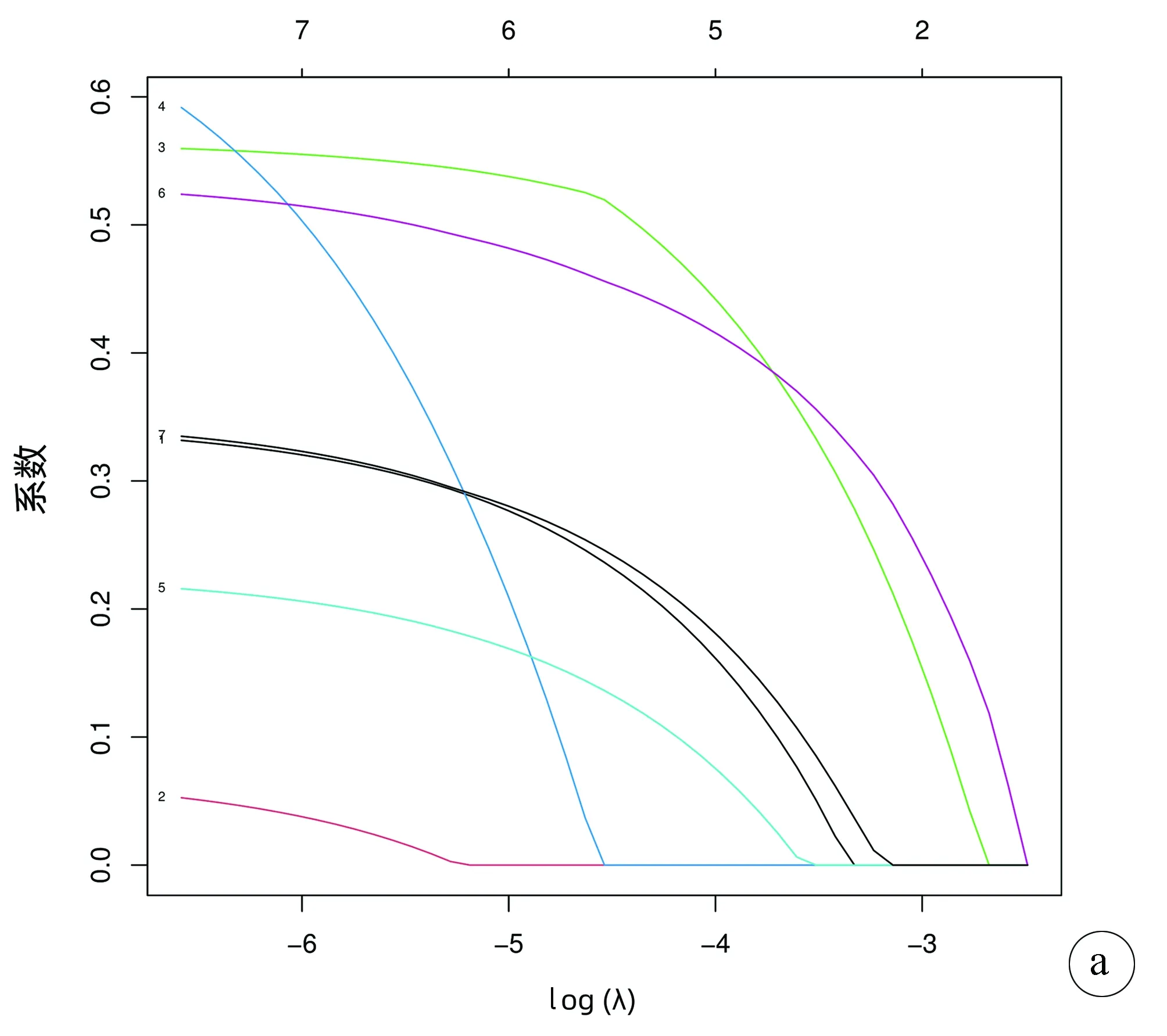
注:a,lasso回归路径图;b,交叉验证图。图1 lasso回归分析及交叉验证

表2 建模组OS的单因素及多因素Cox分析结果
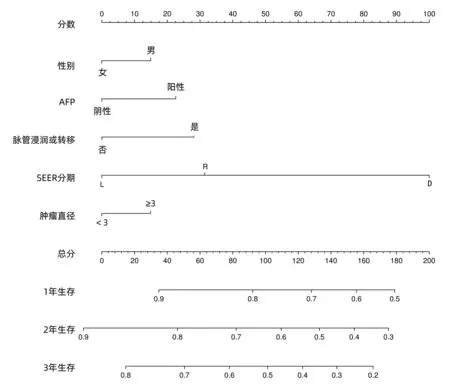
图2 小肝癌患者肝切除术后OS列线图预测模型
3 讨论
随着现代医疗技术的迅猛发展,各种检查设备的更新迭代及人们健康意识的增强,使小肝癌更容易被检出,可以使患者得到很有效的救治,尽管小肝癌的最佳治疗方式一直存在争议,但现代医疗优秀的外科技术、良好的围手术期管理仍然使手术治疗小肝癌成为主要手段[11]。目前尚无大样本数据模型来预测小肝癌肝切除术后生存率模型,所以本研究利用大数据及中国数据外部验证建立直观、明了、简洁用于预测小肝癌生存率模型,以利于临床诊疗中对患者的评估。
流行病学统计发现,全球2020年男性肝癌患者的发病率及死亡率是女性患者的2倍以上[12],我国肝癌的性别分布也符合上述特征[13],陈康等[14]也发现女性肝癌肝切除术后生存率优于男性,本研究也分析发现,男性是小肝癌肝切除术后影响生存率的独立危险因素。AFP自60多年前被发现以来,至今仍然是最广泛被接受及使用的肝癌血清学标志物[15-16]。 Graham等[17]研究发现在小肝癌中,AFP阳性组的3年生存率明显低于AFP阴性组的3年生存率,本研究也发现AFP阳性是小肝癌肝切除术后影响生存率的独立危险因素;有研究[18-19]表明 AFP可以促进肿瘤细胞增殖,还可以刺激部分肝癌细胞系的细胞运动和侵袭性生长,相关小鼠模型中也证明了AFP可以促进肿瘤的转移。Seer分期是SEER数据库特有的简易分期方式,是按肿瘤的扩散距离进行分期,很好的结合肿瘤临床特征,且兼具简洁性等特点,李传红等[4]通过提取SEER数据库中小肝癌数据构建小肝癌生存率的列线图模型,证实了Seer分期是影响小肝癌生存的独立影响因素,但是该研究并未使用中国本地数据进行外部验证,该研究模型是否使用于国内尚存争议,同时该研究没有单独分析小肝癌肝切除术后的生存率,存在一定的局限性。肿瘤的侵犯转移属于肿瘤基本特征,并且脉管侵犯或者转移一直被认为影响肝癌术后的重要影响因素[20-22]。现有研究[23]证实,≥3 cm的小肝癌血管浸润风险高、肿瘤分级更低,相较<3 cm的小肝癌肝切除术后患者预后更差,与本研究相符。
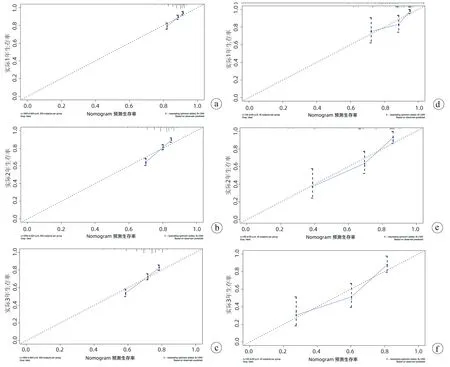
注:a、b、c为建模组;d、e、f为验证组。图3 建模组和验证组预测小肝癌患者肝切除术后1、2、3生存率的校准曲线

注:a、b分别为建模组和验证组模型预测1、2、3年OS的ROC曲线;c、d分别为建模组和验证组模型的高风险组及低风险组生存分析。图4 模型预测1、2、3年OS的ROC曲线及高风险组和低风险组生存分析
目前使用较广泛的肿瘤分期系统为TNM及BCLC分期系统,但是TNM分期只考虑肿瘤负荷对肝癌预后的影响,未考虑患者本身状态、肿瘤标志等对患者的影响,可能造成偏差[24]。BCLC分期系统较全面,但分期较复杂,有研究[25]表明BCLC以预测非手术治疗的长期预后为主,短期预后的预测能力低于TNM等分期系统。目前,尚无小肝癌肝切除术后生存率的预测模型,Wen等[26]利用放射组学结合临床血液指标建立预测小肝癌术后复发的模型,取得较好的效果,但该研究仅纳入≤3 cm的肝癌且为单中心研究,具有一定局限性。本研究中,通过SEER数据库大样本数据建立了将性别、AFP、Seer分期、脉管侵犯及转移、肿瘤直径相结合的新型的预测小肝癌肝切除术后生存率的列线图模型,兼顾肿瘤患者自身特征、肿瘤标志物、肿瘤负荷等因素,具有简单、明了、直观等优点。该模型建模组及外部验证组这两个独立队列的C指数分别为0.621和0.718,显示该模型具有一定的辨别能力,校准曲线、ROC曲线验证其有预测效果,根据该模型进一步分层,低风险组的预后均明显优于高风险组,说明其具有良好的区分度。而且本研究通过中国本土的数据进行外部验证,更加证实了其可用性。但本研究仍存在一定局限性:外部验证数据量较少且缺少相关血液学及肝脏本身情况数据,同时外部验证只收集了单中心小肝癌数据,对中国整体代表性较差,而且肝癌发病率及死亡率存在明显人种差异[27],造成研究结论可能存在偏倚。同时SEER数据库的局限性,导致在模型中无法纳入乙型肝炎等对患者术后生存可能具有影响的病因数据,导致偏倚,同时上述研究还需更大样本、多中心、前瞻性研究进行进一步验证。
综上,建立的原发性小肝癌肝切除术后生存率模型可以用于预测1、2、3年OS,并且根据模型可以准确的进行风险分层,以利于国内临床应用。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:唐豪佑、刘胜、李建水负责课题设计,资料分析,撰写论文;曾新、黄孝彬、杨洋参与收集数据,修改论文;李建水、邓大炜负责拟定写作思路,指导撰写文章并最后定稿。
