不同HBeAg状态慢性乙型肝炎患者停用核苷(酸)类似物后肝炎复发致慢加急性肝衰竭的病情转归差异分析
2022-02-12沈佳聪李小鹏程晓宇车媛梅周观林张伦理
沈佳聪, 李小鹏, 程晓宇, 车媛梅, 雷 弯, 周观林, 张伦理
1 浙江省绍兴市人民医院 感染科, 浙江 绍兴 312000; 2 南昌大学第一附属医院 感染性疾病诊疗中心,江西省肝细胞再生医学重点实验室, 南昌 330006; 3 南昌大学第一附属医院 科技处, 南昌 330006;4 江西省赣州市第五人民医院 肝病科, 江西 赣州 341099
慢加急性肝衰竭(ACLF)是慢性肝病患者的常见终末期肝病。在我国,HBV相关ACLF(HBV-ACLF)患者数量约占肝衰竭患者总数的80%以上[1-2]。核苷(酸)类似物(NUC)是临床常用的乙型肝炎抗病毒治疗药物。通过长期NUC抗病毒治疗,可以降低患者发生肝衰竭、肝硬化或肝细胞癌的风险,从而改善患者的长期预后,延长生存期[3]。随着NUC在我国广泛应用,抗病毒治疗疗程延长,除了部分患者按照指南的建议停药,更多患者因经济因素、依从性欠佳等原因自行停药,从而导致肝炎复发。据统计[4],NUC抗病毒治疗过程中停药导致的肝炎复发率高达35%~80%,复发病情往往较重,部分进展为HBV-ACLF,危及患者生命[5]。HBeAg作为一种具有免疫调节作用的非结构性病毒蛋白,既可参与调节免疫反应,也可维持HBV持续感染,且与肝损伤程度相关[6]。本研究旨在探讨HBeAg阳性与HBeAg阴性慢性乙型肝炎(CHB)患者停用NUC抗病毒治疗后致HBV-ACLF的临床病情转归的差异及可能的原因,从而为判断NUC停药致HBV-ACLF的预后提供一定证据。
1 资料与方法
1.1 研究对象 选取2017年1月—2018年12月于南昌大学第一附属医院收治的停用NUC后致HBV-ACLF的CHB患者。按照HBeAg状态分为HBeAg阳性组和HBeAg阴性组。HBV-ACLF诊断标准参考中华医学会《肝衰竭诊治指南(2018年版)》[2]:在CHB的基础上,因停用NUC(停药时所有患者血清HBV DNA均<500 IU/mL)引起的以急性黄疸进行性加深、凝血功能障碍为主要表现的综合征,可并发有感染、肝性脑病、腹水、电解质紊乱、肝肾综合征等。患者黄疸短时间内进行性加深,血清TBil≥10倍正常值上限或每日上升≥17.1 μmol/L;有出血倾向,PTA≤40%(或INR≥1.5)。排除标准:(1)住院资料不完全者;(2)合并因毒物、药物、遗传代谢性疾病、自身免疫等其他因素所致肝功能异常;(3)合并其他急性嗜肝或非嗜肝病毒感染;(4)合并肝脏或其他系统恶性肿瘤;(5)妊娠或哺乳期妇女;(6)合并严重循环、呼吸系统疾病。
1.2 研究方法
1.2.1 观察指标 收集记录患者入院时各项临床数据,包括性别、年龄、临床表现及体征,TBil、DBil、ALT、AST、PT、活化部分PT(APTT)、PT/INR、HBV DNA定量检测结果,以及并发症(肝性脑病、肝肾综合征、自发性腹膜炎等)情况。
1.2.2 病情转归评估标准 结合患者病情记录、出院记录以及出院前复查肝功能结果与之前结果对比趋势,将病情转归定义:(1)好转(生存),即患者临床症状(如乏力、纳差、腹胀、出血倾向等)较前缓解,或黄疸、腹水、消化道出血、感染等体征较前减轻或消失,或胆红素、PTA等实验室检查指标较前改善并出院;(2)恶化(死亡),即患者临床症状(如乏力、纳差、腹胀、出血倾向等)持续不能缓解,或黄疸、腹水、消化道出血、感染等体征加重,或胆红素、PTA等实验室检查指标持续恶化,患者死亡或患者家属放弃治疗自动出院。
1.2.3 HBV前基因组RNA(HBV pgRNA)检测 为了探讨长期NUC治疗后不同HBeAg状态患者停药后肝炎复发致HBV-ACLF不同预后的原因,选取持续NUC抗病毒治疗>2年且HBV DNA<20 IU/mL的CHB患者,收集并检测其血清HBV pgRNA水平。HBV pgRNA检测流程:(1)核酸的提取或纯化。采用核酸提取或纯化试剂(广州海力特生物科技有限公司)从血清中提取总RNA。取600 μL样本中加入872 μL工作液(包括800 μL裂解液+60 μL蛋白酶K+12 μL载体RNA),56 ℃孵育15 min;然后将所有液体分2次转移至离心柱中,10 000 r/min离心1 min,弃滤液;后向离心柱中加入500 μL洗涤液1,再次10 000 r/min离心1 min,弃滤液;再向离心柱中加入500 μL的洗涤液1,再次10 000 r/min离心1 min,弃滤液;然后向离心柱中加入500 μL的洗涤液2,转速13 000 r/min离心3 min,弃滤液;再次13 000 r/min离心1 min;然后将离心柱转移至1.5 mL离心管中,向离心柱膜中央加入60 μL洗脱液;室温放置1 min后,10 000 r/min离心1 min,丢弃离心柱。该1.5 mL管中收集到的液体即为提取的核酸。(2)HBV pgRNA定量检测。采用pgRNA检测试剂盒(广州海力特生物科技有限公司)进行。首先使用该检测试剂盒中的酶切体系对提取到的核酸进行处理,向每份提取的核酸中加入1 μL DNaseⅠ和5 μL Buffer D,先37 ℃孵育30 min,后又立即80 ℃孵育2 min。向30 μL反应液中加入20 μL酶切后的核酸(总反应体积为50 μL),通过SLAN 96P实时荧光定量PCR(上海宏石医疗科技有限公司)测定HBV pgRNA水平。程序设置为:45 ℃×45 min,95 ℃×2 min;95 ℃×15 s,66 ℃×15 s,72 ℃×20 s,循环3次;95 ℃×15 s,63 ℃×15 s,72 ℃×20 s,循环9次;95 ℃×15 s,60 ℃×45 s(仅在此处采集荧光信号),循环40次。该试剂盒标准品为包含重组目的序列的假病毒,通过将信号与标准曲线比较来量化样本中的HBV pgRNA。试剂盒的最低检出下限为15 拷贝/mL,定量范围为5.0×101~1.0×108拷贝/mL。
1.3 伦理学审查 本研究方案经由南昌大学第一附属医院伦理委员会审批,批号:(2020)医研伦审第(7-189),所纳入患者均签署知情同意书。
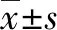
2 结果
2.1 一般资料 共纳入停用NUC后肝炎复发致HBV-ACLF的CHB患者108例,其中HBeAg阳性组57例(52.8%),HBeAg阴性组51例(47.2%)。HBeAg阳性组与HBeAg阴性组在性别、年龄以及是否合并有肝硬化病史方面的差异无统计学意义(P值均>0.05)(表1)。
2.2 病毒学、生化学指标 以500拷贝/mL为界分HBV DNA阴/阳性。HBeAg阳性组入院时HBV DNA水平明显高于HBeAg阴性组(P=0.002),ALT、AST、TBil、DBil、PT、APTT、INR指标两组差异均无统计学意义(P值均>0.05)(表2)。
2.3 HBeAg状态和HBeAg、抗-HBe及抗-HBc水平与病情转归的关系 以1 COI为界分HBeAg阴/阳性。HBeAg阳性组好转率49.1%,HBeAg阴性组好转率74.5%。生存/好转组入院时HBeAg阴性患者明显多于死亡/恶化组(P=0.006);生存/好转组与死亡/恶化组HBeAg、抗-HBe水平、抗-HBc水平差异均无统计学意义(P值均>0.05)(表3)。

表1 两组患者一般资料比较
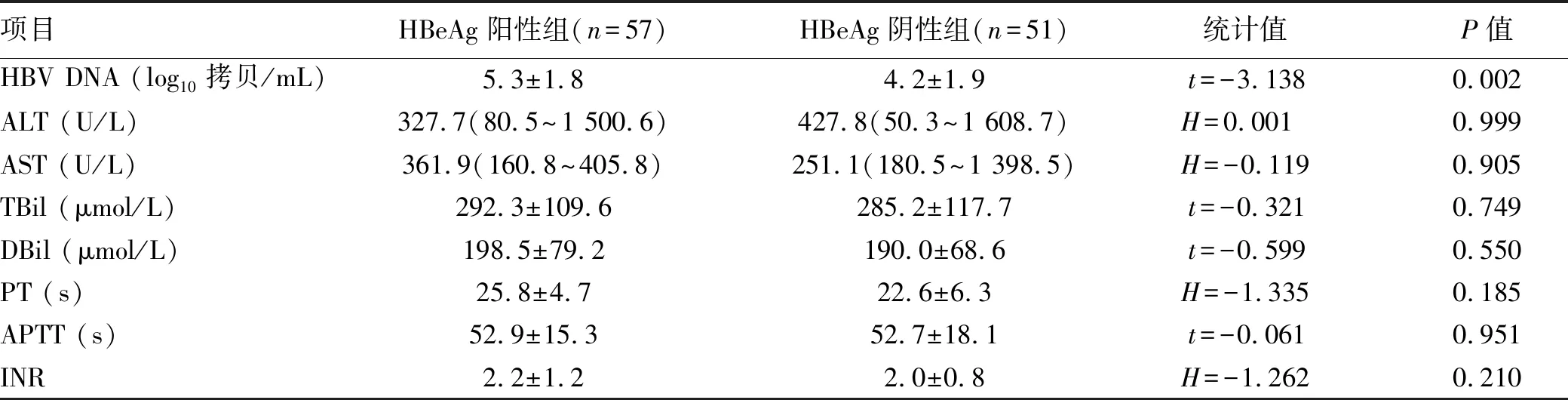
表2 两组患者病毒学、生化学指标比较
2.4 长期NUC治疗后HBeAg阳性/阴性组患者HBV pgRNA水平 在48例长期NUC抗病毒治疗达到病毒学应答的CHB患者中,HBeAg阳性/阴性组间性别、年龄、HBsAg水平、HBV pgRNA检出率差异均无统计学意义(P值均>0.05)。HBeAg阳性组HBV pgRNA载量明显高于HBeAg阴性组(P=0.049)(表4)。
3 讨论
慢性HBV感染是一个全球性的健康问题,长期慢性感染可引起肝硬化、肝细胞癌和肝病相关死亡等高风险[7-8]。抗病毒治疗是目前临床上治疗CHB最重要和最有效的方法,大量临床研究和临床实践表明,通过长期抗病毒治疗,可以抑制HBV复制,显著改善肝生化学指标,缓解或逆转组织学炎症和纤维化,延缓疾病进展为肝硬化,降低肝细胞癌发生率,提高患者长期生存率[9-11]。一线NUC因其具有较好的疗效、安全性及较低的耐药性等优点而广泛应用于临床,但因其主要机制作用是对于病毒复制的抑制,而不能完全清除肝细胞核内半衰期较长的HBV共价闭环DNA(cccDNA),故可能出现病毒持续感染及停药后肝炎复发[12]。在应用NUC抗病毒治疗中未达停药指标而自行停药导致的肝炎复发率高达80%。停药复发肝炎病情往往较重,部分进展为HBV-ACLF,可危及生命[5]。HBeAg是一种由HBV DNA前C和C区编码合成的分泌性蛋白[13],是临床检测慢性HBV感染的常用血清学指标[6]。为了探讨NUC治疗停药后肝炎复发致HBV-ACLF患者血清HBeAg的不同状态对疾病转归的影响及可能的原因,本研究对108例停用NUC后肝炎复发致HBV-ACLF患者进行回顾性分析,结果发现,HBeAg阴性组患者的病情好转(生存)率明显高于HBeAg阳性组,HBeAg阴性组HBV DNA水平明显低于HBeAg阳性组,提示HBV DNA水平和HBeAg状态是CHB患者停用NUC后致HBV-ACLF的预后影响因素。为了探明原因,笔者团队选取48例长期NUC抗病毒治疗达到病毒学应答的患者,分析其不同HBeAg状态时血清HBV pgRNA水平的差异,结果发现,HBeAg阴性组患者HBV pgRNA载量明显低于HBeAg阳性组。HBV pgRNA作为一种新型的血清标志物,可以间接反映肝细胞内cccDNA的转录活性。获得血清学转换的CHB患者常伴随cccDNA水平降低,提示HBV DNA复制程度降低[14]。因此,本研究结果提示,在停用NUC后肝炎复发致HBV-ACLF患者中,HBeAg阴性患者的好转率高于HBeAg阳性患者,其可能的原因是:HBeAg阴性患者血清HBV pgRNA处于较低水平,间接反映了其肝细胞内HBV cccDNA的转录活性较低,复制能力下降,其停药肝炎复发后血清HBV DNA水平也较低。而停药后肝炎复发是否诱导HBV-ACLF的发生与停药后HBV DNA是否快速反弹至高病毒载量水平,诱导机体产生过强地针对HBV的免疫反应[15],从而造成感染HBV的肝细胞大量坏死,导致肝衰竭有关。长期NUC治疗后HBeAg仍然阳性的患者血清HBV pgRNA仍处于高水平,提示HBV仍具有较强复制能力,一旦停药极易复发,且其HBV DNA极易反弹至较高水平,从而造成免疫性攻击的肝细胞坏死更为严重,导致预后更差。当然,影响停用NUC肝炎复发致HBV-ACLF的病情转归因素较多,例如是否合并继发感染等并发症。但不可否认的是,停药后HBV DNA反弹所诱导的针对肝细胞的免疫攻击的强度是决定肝细胞损伤坏死程度并影响预后的关键因素。而HBeAg阳性患者由于其HBV cccDNA生物活性更强,HBV DNA反弹更高,因此激发的免疫攻击更强,造成的肝坏死更为严重,对病情转归及预后的负面影响更大。
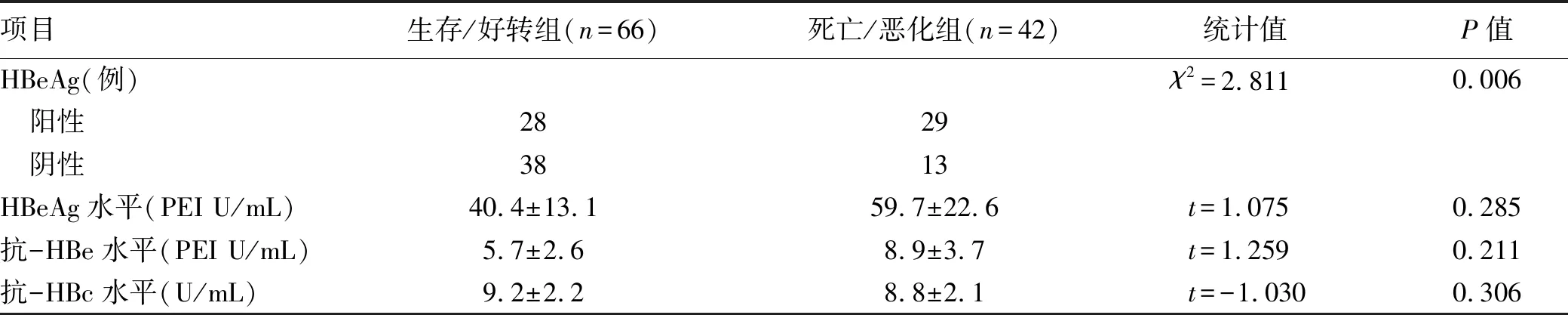
表3 不同临床转归患者入院时血清学指标比较
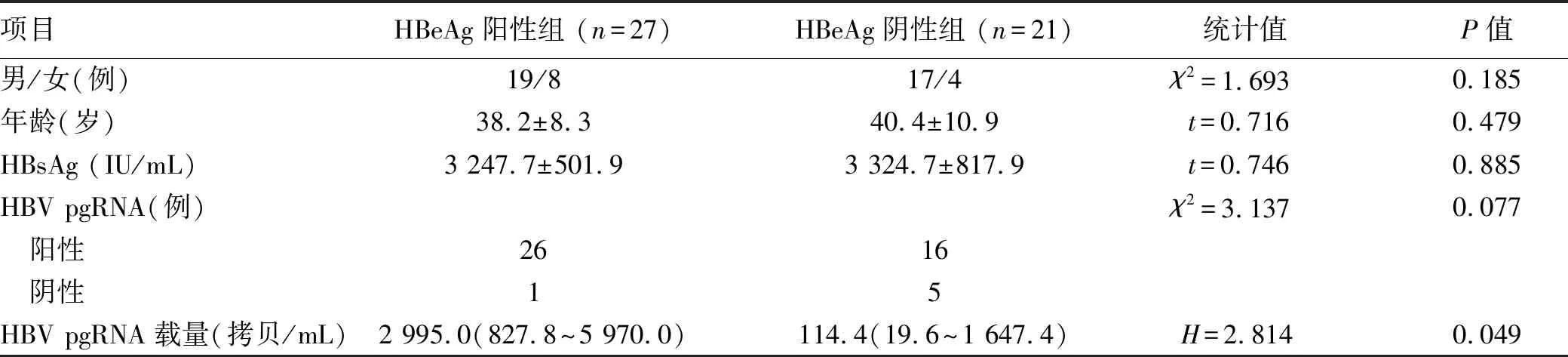
表4 长期NUC治疗后不同HBeAg状态患者HBV pgRNA水平比较
综上所述,长期使用NUC 抗病毒治疗停药后肝炎复发导致HBV-ACLF的HBeAg阴性的患者其临床转归优于HBeAg阳性患者。因此,针对HBeAg阳性患者,积极劝阻其擅自停药且在停药后密切监测,对降低HBV-ACLF的发生率至关重要。
利益冲突声明:本研究不存在研究者、伦理委员会成员、受试者监护人以及与公开研究成果有关的利益冲突。
作者贡献声明:沈佳聪、李小鹏、张伦理负责课题设计,资料分析,撰写论文;程晓宇、车媛梅、雷弯参与收集数据,修改论文;周观林、张伦理负责拟定写作思路,指导撰写文章并最后定稿。
