草鱼TBK1基因荧光定量PCR检测方法的建立
2022-02-11张林张浪周剑光甘金华张涛何力
张林,张浪,周剑光,甘金华,张涛,何力
(中国水产科学研究院长江水产研究所,农业农村部淡水鱼类种质监督检验测试中心,湖北 武汉 430072)
草鱼(Ctenopharyngodonidella)是鲤科、草鱼属鱼类。草鱼是典型的草食性鱼类,栖息于平原地区的江河湖泊,一般喜居于水的中下层和近岸多水草区域。性活泼,游泳迅速,常成群觅食。草鱼幼鱼期则食幼虫、藻类等,草鱼也吃一些荤食,如蚯蚓、蜻蜓等。分布广,在中国分布于黑龙江至云南元江(西藏、新疆地区除外)。已移殖到欧、美、非等各洲,是世界上广泛养殖,且产量最高、最重要的淡水经济鱼类之一[1]。草鱼也是中国重要的淡水养殖鱼类,其和鲢(Hypophthalmichthysmolitrix)、鳙(Aristichthysnobilis)、青鱼(Mylopharyngodonpiceus)一起,构成了中国的“四大家鱼”。然而,草鱼容易被病原体感染,如呼肠孤病毒(Reovirus)感染,一旦感染,发病率和死亡率极高[2]。干扰素(Interferon,IFN)是一种重要的细胞因子,具有抗肿瘤、抗病毒、抗菌及免疫调节等多种作用[3]。作为干扰素调节因子(Interferon regulator factors, IRF)活化所必须的磷酸激酶,TNF受体相关因子(TNF Receptor-associated factor, TRAF)家族成员相关的NF-kB活化因子(TANK)结合激酶1(TANK binding kinase 1,TBK1),在Toll样受体(Toll-like receptors, TLRs)、RIG-I样受体(RIG-I Like Receptors, RLRs)以及胞浆DNA受体介导的抗感染天然免疫中发挥核心枢纽作用,TBK1活化后可诱导下游的IFN调节因子 3/7(IRF3/7)活化并激活I型干扰素的表达,启动后续信号传导,抵御病原体浸染[4-5]。开展动物干扰素的研究,建立动物干扰素功能相关基因检测方法,特别是反应机体天然抗病免疫功能的TBK1基因的准确定量检测,可用于动物病原体感染、机体免疫系统激活的早期监测,对于动物疫病的防控起到重要作用。
目前,关于基因检测方法有RT-PCR[6]、Northern blot[7]、Real-time PCR[8-9]、融合荧光蛋白[10-11]、报告基因等[12-13]。其中qRT-PCR在养殖动物基因或微生物中应用广泛[14-15],特别在评价机体基因表达水平的qRT-PCR方法,由于其敏感性和特异性强,能准确检测微量mRNA水平,应用更为广泛。但由于RNA存在质量及反转率效率差异等问题,一般选择基因序列高度保守、mRNA表达数量高、稳定表达于不同组织细胞中的18SrRNA作为内参基因进行校正和标准化[16]。
目前关于TBK1[17-18]的实时荧光定量PCR检测技术,在人和鸡的天然抗病免疫中已有报道[19],然而TBK1在硬骨鱼中研究较少。草鱼TBK1基因研究报道很少,主要是克隆及免疫调控方面研究[19-20],其定量检测方法未见报道。因此本研究以草鱼的18SrRNA作为内参基因,建立了草鱼TBK1的实时定量PCR检测方法,为研究草鱼病原体感染后天然抗病免疫功能的激活、草鱼疫病感染的早期检测及草鱼TBK1基因的动态变化规律提供基础数据。
1 材料与方法
1.1 主要仪器与材料
本研究中实验动物草鱼(体重40~50 g,体长15.28~16.20 cm)来自长江水产研究所梁子湖实验基地。
本研究所用试剂主要包括:Trizol(Invitrogen 公司),异丙醇、三氯甲烷、无水乙醇(国药集团),Taq DNA 聚合酶、RNase 抑制剂、DNAseⅠ、dNTP、DEPC(TaKaRa生物科技有限公司)、RevertAidTM第一链cDNA合成试剂盒(Fermentas 公司),ChamQ SYBR qPCR Master Mix荧光定量试剂盒(Vazyme公司),Mini BEST Agarose Gel DNA Extraction Kit、琼脂糖、蛋白胨、酵母浸粉、TAE 缓冲液、核酸染料、DNA Maker、Plasmid Mini Kit(Tiangen公司),pMD18T 载体、DH5a大肠杆菌感受态细胞购自北京全式金生物技术有限公司。
本研究所用的仪器设备主要包括:PCR 基因扩增仪、CFX96 荧光定量 PCR 仪、凝胶成像分析仪(美国Bio-Rad 公司),台式高速离心机、可调式微量移液器(2.0 μL、10.0 μL、100.0 μL)(Eppendorf公司),DYCP-31型水平电泳仪、涡旋混合仪、HZP 型振荡培养箱(北京六一),超净工作台,通风橱、常规冰箱、超低温冰箱(Thermo Fisher 公司)。
1.2 引物的设计与合成
通过Prime 6.0软件,以National Center for Biotechnology Information(NCBI)数据库中公布的草鱼TBK1序列为模板,设计2对草鱼TBK1基因PCR检测引物,以草鱼的18SrRNA作为实时定量PCR的内参基因,所设计的引物由上海生工股份有限公司合成,引物序列信息见表1。
1.3 PCR扩增及ciTBK1引物验证
将所取的草鱼肾脏、脾脏组织用液氮低温研磨处理,利用Trizol 等试剂采用经典的方法提取RNA,用RevertAidTM第一链cDNA合成试剂盒(Fermentas公司)进行反转录扩增,获得cDNA,作为后续PCR扩增的模板,利用表1中的引物,进行特异性PCR扩增,获得目的基因片段。PCR产物经琼脂糖电泳进行鉴定,并回收鉴定正确的基因片段进行测序分析,验证所设计引物的准确性。
1.4 标准品的制备
凝胶回收测序验证正确的草鱼TBK1及18SrRNA基因片段,与 pMD18T载体连接,将连接产物转化DH5a感受态细胞,通过氨苄抗性筛选,选取2~3个单克隆接种含氨苄的液体LB培养基培养12~16 h,用质粒提取试剂盒提取阳性质粒,并将所提取质粒进行测序,将测序正确含有目的基因的重组阳性质粒命名为pMD18T-ciTBK1和pMD18T-18SrRNA,该阳性质粒可作为后续荧光定量PCR检测的标准品。
1.5 定量PCR检测方法的建立
1.5.1 定量PCR反应条件优化
以反转录获得的草鱼cDNA作为模板,按照荧光定量PCR试剂盒说明书推荐的反应体系进行PCR扩增,以每个反应中荧光信号达到设定的域值时所经历的循环数,即Ct值来评判扩增效果。以熔解曲线峰单一、无非特异性扩增和Ct值最小为标准,对模板浓度、引物浓度、退火温度、反应时间及循环数等反应条件进行优化,确定PCR反应最优条件。
1.5.2 标准曲线的制备
测定pMD18T-ciTBK1和pMD18T-18SrRNA标准品的浓度及纯度,换算方法参考Li等[17]建立的TBK1突变检测的方法。将制备的标准品进行10倍倍比稀释,以101~106拷贝/μL的不同浓度标准品为模板进行PCR扩增,每个样品设置3个平行,同时设置以去离子水为模板的空白对照。标准曲线是以模板数的对数为x轴,循环数Ct值为y轴,建立定量PCR反应的标准曲线。
1.5.3 定量PCR反应的敏感性、特异性及重复性验证
用优化建立的qRT-PCR方法扩增ciTBK1基因,通过qRT-PCR熔解曲线中扩增曲线峰单一且无杂峰来表明设计的引物特异性较强,反应条件恰当,以此确定qRT-PCR扩增反应的特异性。以10倍倍比稀释的101~106拷贝/μL的标准品为模板,进行qRT-PCR和常规PCR扩增,比较2种方法能够检出的最低模板浓度,评价定量PCR方法的灵敏性。选取1×102、1×104、1×106拷贝/μL 3个浓度的标准品为模板进行PCR扩增,进行组内重复性检验,同时在3个不同时间点进行组间重复性检验。计算定量PCR反应Ct值的平均数和变异系数,评价定量PCR反应的重复性。
2 结果与讨论
2.1 ciTBK1定量PCR引物的确定
本试验针对草鱼TBK1基因所设计的2对引物均可扩增得到大小与预期相符的目的基因条带(图1),且扩增产物经测序分析发现与已报道的草鱼TBK1基因序列一致。其中引物1进行PCR反应,所扩增条带特异性更好,因此本研究选取引物1作为后续定量PCR检测引物。

图1 不同引物扩增ciTBK1及18S rRNA的PCR扩增基因条带1:ciTBK1(引物1扩增);M:DNA标准DL2000;2:ciTBK1(引物2扩增);3:18S rRNA。Fig.1PCR amplification of ciTBK1 and 18S rRNANote:1:ciTBK1(primer 1 amplification);M:DNA standard DL200;2:ciTBK1(primer 2 amplification);3:18S rRNA.
2.2 定量PCR反应标准品的制备
提取测序验证正确的阳性克隆质粒pMD18T-ciTBK1和pMD18T-18SrRNA,并测定其浓度,作为后续定量PCR反应的标准品,-20 ℃保存备用。重组阳性质粒pMD18T-ciTBK1和pMD18T-18SrRNA的拷贝数分别为5.40×107拷贝/μL和1.28×108拷贝/μL。
2.3 定量PCR反应条件的确定
通过对引物浓度、退火温度及循环数等定量PCR反应条件优化,最终确定20 μL PCR反应体系如下:模板2 μL, 上、下游引物(2 μmol/L)各1 μL,2×ChamQ SYBR qPCR Master Mix 10 μL,ddH2O 6 μL。PCR反应条件为:95 ℃,1 min;95 ℃,10 s;60 ℃,30 s;共40个循环。
2.4 定量PCR标准曲线的构建
从PCR反应的扩增曲线分析:ciTBK1和18SrRNA的定量PCR扩增曲线间距均匀,熔解曲线单一无杂峰。根据浓度对数值与Ct值之间的关系,确定ciTBK1和18SrRNA表达量的回归方程分别为:
2.5 特异性、敏感性及重复性试验
特异性试验表明:在相同的反应条件下,以pMD18T-ciTBK1和pMD18T-18SrRNA质粒为模板能扩增到正常曲线和特征性熔解曲线峰,ciTBK1和18SrRNA扩增反应的退火温度Tm值分别为(80.0±0.2) ℃ 和 (82.0±0.2) ℃,PCR反应无非特异性扩增,扩增产物单一(图2)。
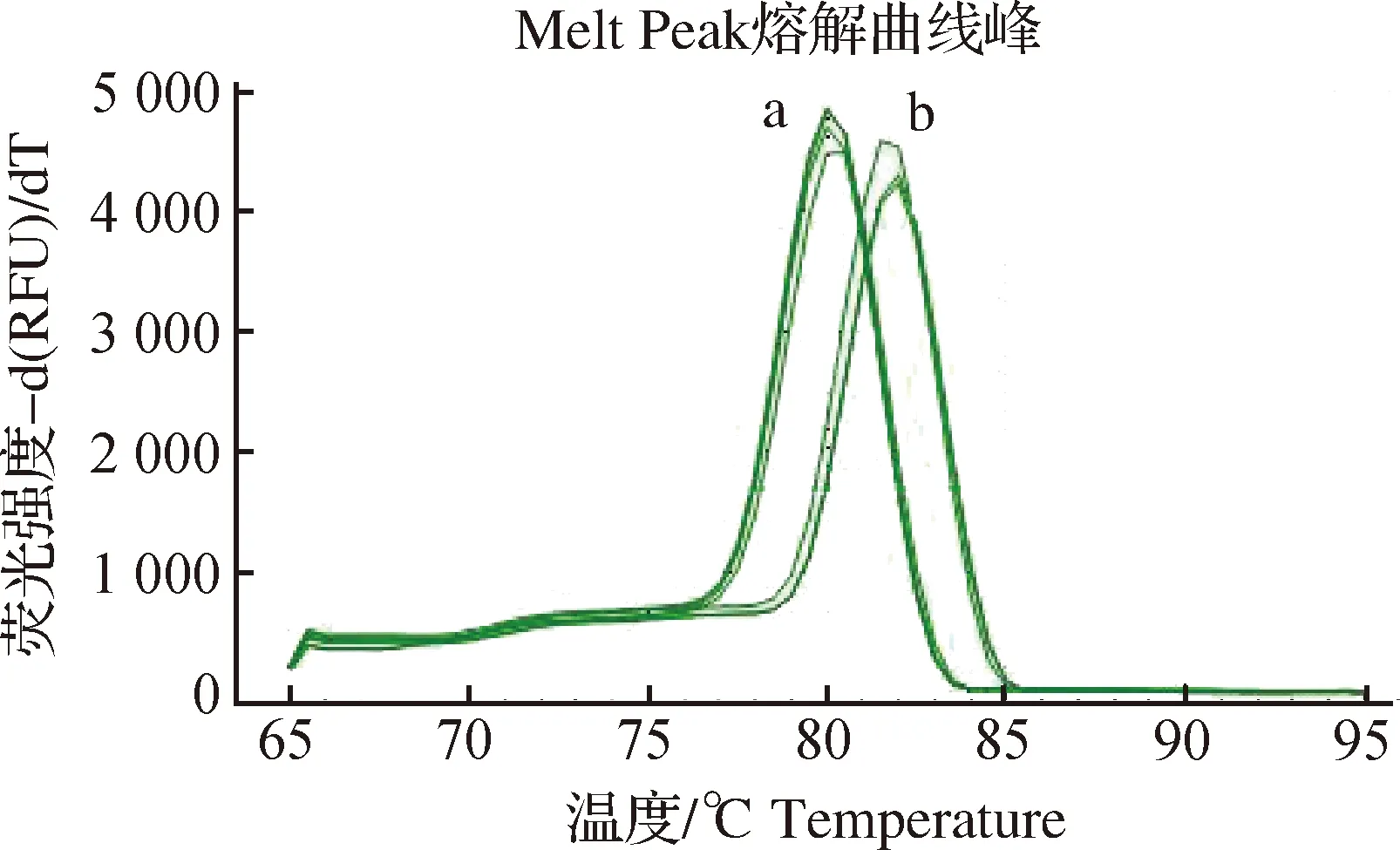
图2 ciTBK1及18S rRNA荧光定量PCR扩增的特异性试验注:图中 a、b峰型分别代表pMD18T-ciTBK1和pMD18T-18S rRNA.Fig.2Specificity assay of qRT-PCR for detection of ciTBK1 and 18S rRNANote:a:pMD18T-ciTBK1,b:pMD18T-18S rRNA.
敏感性试验表明:以101~106拷贝/μL的pMD18T-ciTBK1质粒为模板进行检测,普通PCR反应检测下限为103拷贝/μL(图3a),而荧光定量PCR反应检测的下限为101拷贝/μL (图3b),荧光定量PCR反应检测下限明显高于普通PCR反应,灵敏度较常规PCR高100倍。
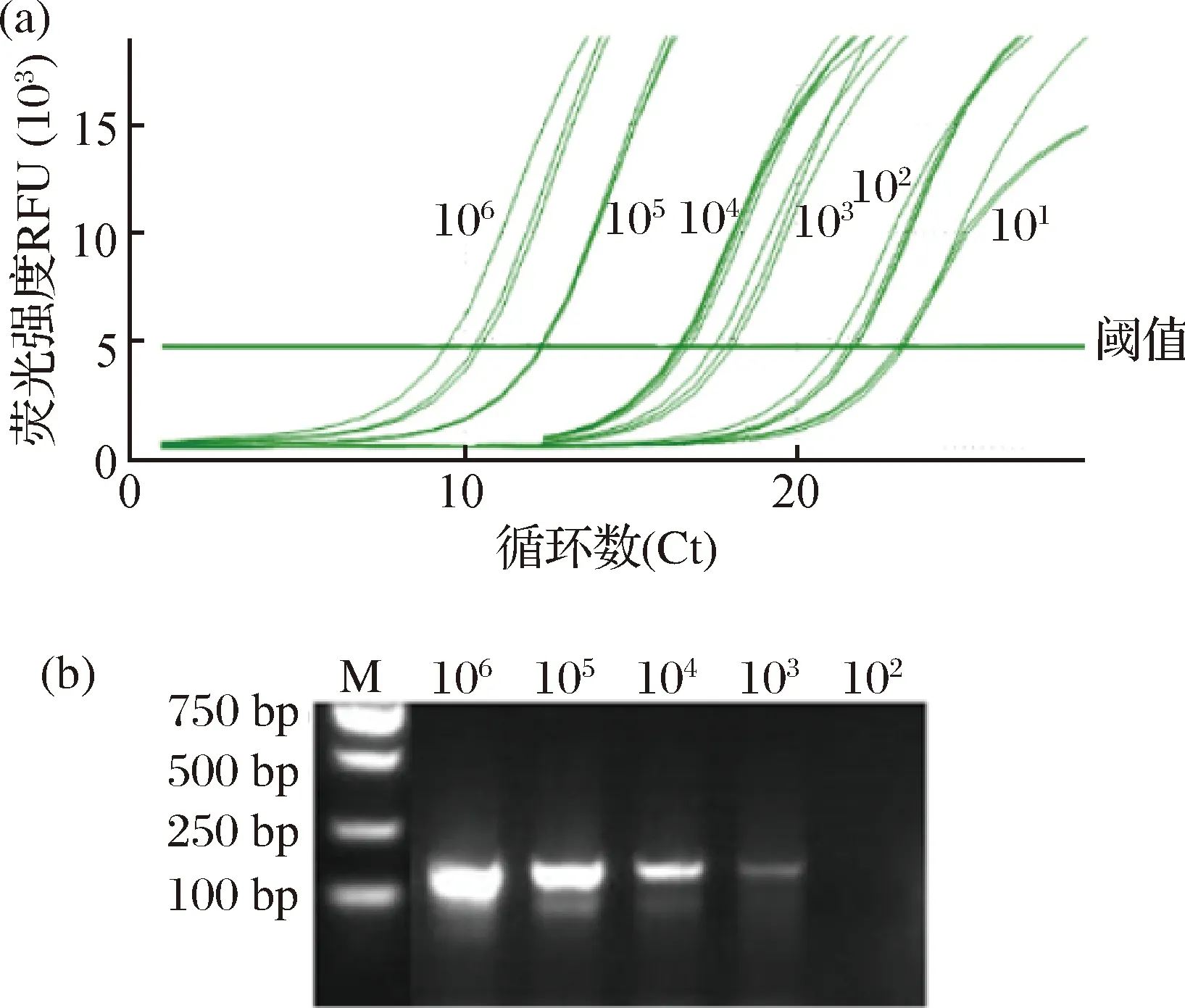
图3 ciTBK1检测的敏感性试验注:3a:ciTBK1荧光定量PCR检测的敏感性试验;3b:ciTBK1普通PCR检测的敏感性试验。Fig.3Sensitivity assay for detection of ciTBK1Note:3a: Sensitivity assay of qRT-PCR for detection of ciTBK1;3b: Sensitivity assay of ordinary-PCR for detection of ciTBK1.
以3个稀释度的重组质粒为模板分别进行组内和组间重复性试验,由表2可知,组内及组间重复的变异系数分别为0.25%~0.59%、0.37%~0.49%,所建立的定量PCR检测方法重复性好。
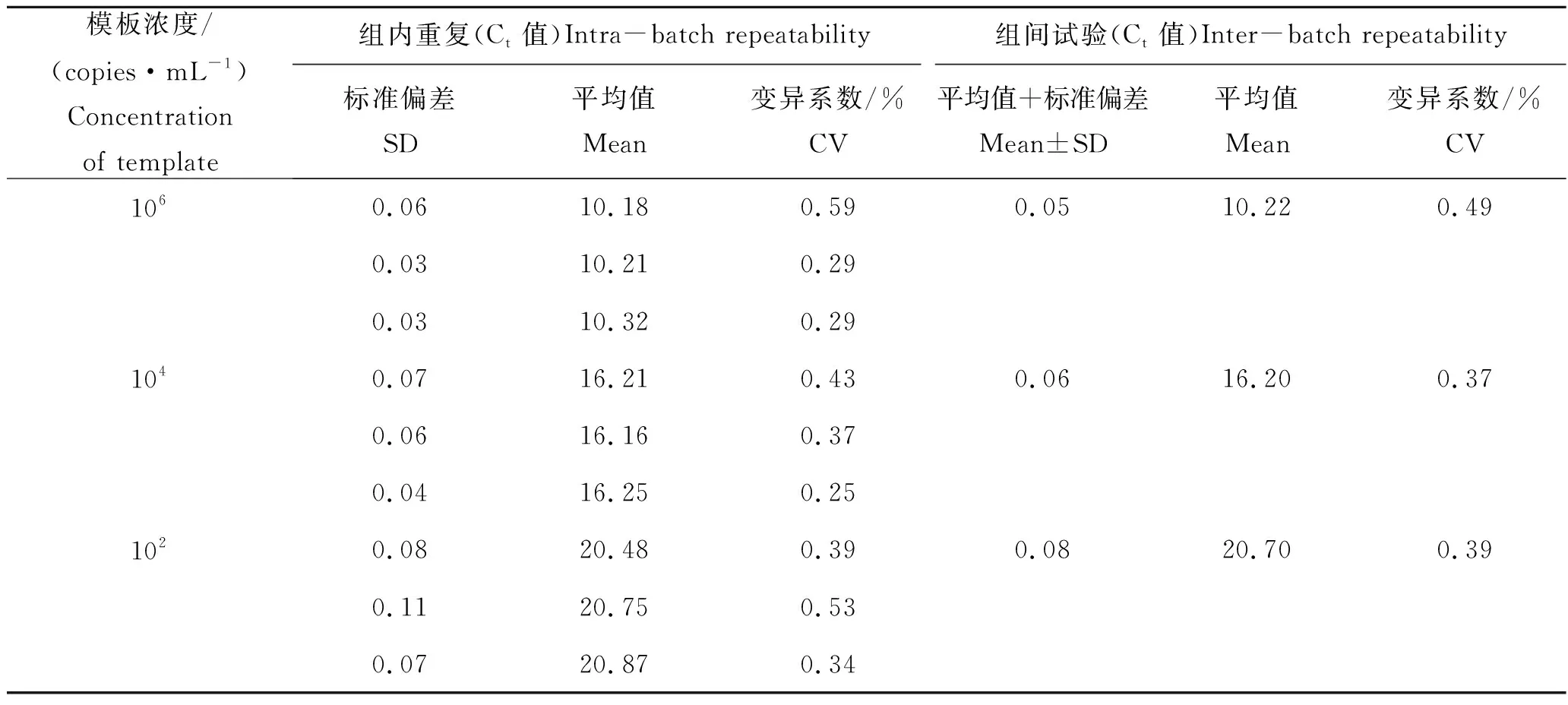
表2 ciTBK1荧光定量PCR扩增重复性试验Tab.2 Repeatability assay of qRT-PCR for detection of ciTBK1
3 结论
本研究建立的草鱼TBK1基因实时荧光定量PCR检测方法采用ChamQ SYBR qPCR Master Mix试剂盒,该产品中含有 SYBR Green I荧光染料,通过SYBR Green I与dsDNA非特异性结合,实时监测随着PCR扩增产物的增加荧光强度的变化情况,并通过熔解曲线排除非特异性干扰[14]。
本研究建立的荧光定量PCR检测方法具有检测成本低、检测方法简单快捷的特点。整个PCR检测过程可实时监测,自动化程度较高,避免了交叉污染的可能,可进行直观的定量分析。本研究结果表明,目的基因和内参基因的扩增曲线间距均匀,特异性强,熔解曲线单一无杂峰,标准曲线线性关系良好;同时检测下限可达50 拷贝/μL,检测方法的敏感性高,是常规PCR的100倍;所建立的检测方法组内和组间变异系数均在0.6%以内,重复性和稳定性良好。
综上所述,本研究建立的草鱼TBK1基因的实时荧光定量PCR检测方法可实现对草鱼TBK1表达水平快速定量检测;本检测方法通过18SrRNA内参基因的校正,可消除采样、RNA提取及反转录等过程中的操作误差,且具有特异性强、灵敏度高、重复性好和操作简便等诸多优点,可作为一种快速、灵敏、准确的草鱼体内TBK1基因表达监测的有效方法,应用于实际生产中草鱼感染的早期监测,为草鱼疫病防治提供技术支持。
