肝滤泡树突细胞肉瘤1例报告
2022-02-11李晨光贾继尧孙栾彪高硕徽
李晨光, 贾继尧, 孙栾彪, 高硕徽
吉林大学中日联谊医院 胃肠外科, 长春 130000
1 病例资料
患者女性,41岁,因“体检发现肝占位性病变3 d”入本院。2015年10月8日患者曾在上海东方肝胆外科医院行肝尾状叶、胆囊切除术,术后未行任何放、化疗,术后病理回报提示倾向于原发性肝滤泡树突细胞肉瘤(follicular dendritic cell sarcoma,FDCS)。查体:专科情况未见异常。入院后完善相关检查,肝脏超声造影示:动脉造影剂迅速填充,快于周围肝实质,延迟相造影剂消退明显快于周围肝实质,呈“快进快退”表现;MRI示:肝内可见多发结节状、团块状异常信号影,最大者大小约6.5 cm×5.7cm×6.3 cm,考虑肝内多发肿瘤性病变可能性大(图1)。实验室检查:肝功能正常,HbsAg阴性,肿瘤标志物AFP、CEA、CA19-9均为阴性。临床诊断为肝内多发占位,行肝多发肿瘤切除、肝肿瘤微波固化术,术中请超声科会诊,于近第二肝门处探及2枚病灶,大小分别为1.0 cm×1.0 cm,1.2 cm×1.5 cm,予以微波消融。术后病理:镜下水平肿瘤由梭形细胞、丰富的小淋巴细胞和成熟浆细胞组成(图2),免疫组化染色:CD21阳性,CD23局灶性阳性,EBER阴性,Vimentin阳性(图3),支持FDCS诊断。术后未行任何放、化疗。随访至8个月时超声造影(图4)及PET-CT提示肝左叶转移瘤(大小约1.6 cm×1.5 cm),肿瘤标志物均为阴性,于全麻下行肝左叶微波消融术;术后随访至16个月时肝脏超声造影及MRI(图5)提示肝左叶转移瘤(大小约1.2 cm×1.4 cm)、肝右叶转移瘤(大小约1.0 cm×1.1 cm),肿瘤标志物均为阴性,于全麻下行肝左叶、肝右叶微波消融术。后期继续密切随访。
2 讨论
滤泡树突细胞(FDC)通常作为B淋巴细胞的抗原呈递细胞,参与抗原的识别、加工处理和呈递, 在机体细胞免疫和体液免疫调控中起重要作用。当其基因发生突变或缺失时, 便失去了免疫功能, 甚至在致癌因子的作用下过度增殖形成肿瘤,多见于FDCS[1]。FDCS是一种罕见的树突细胞来源恶性肿瘤,1986年由Monda等[2]首次报道并命名。FDCS分为淋巴结内型和淋巴结外型,且以前者多见,淋巴结内型多发生于颈区和腋窝淋巴结;淋巴结外型可发生于扁桃体、甲状腺、颚、咽、肺、肝脏等。原发于肝脏的FDCS极为罕见,发病率占全部肝脏原发肿瘤不足0.1%[3]。1996年Shek等[4]首次报道肝FDCS。迄今为止仅有少量单个病例以及病例系列报告,尚缺乏大样本研究。肝FDCS发病年龄在19~82岁,女性多于男性,无特异性临床表现,部分表现为不适、腹胀、上腹部疼痛、腹部包块、发热、体质量减轻等,也可无任何临床表现[5]。

注:肝右叶后上段见类圆形长T2信号影。图1 MRI检查结果

图2 术后病理检查结果(HE染色,×200)

注:a,CD21阳性; b,CD23局灶阳性; c,EBER阴性; d,Vimentin阳性。图3 术后病理学检查结果(免疫组化染色,×200)
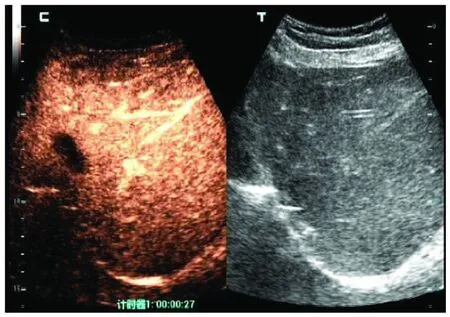
注:肝左叶可见低回声,边界不清,造影剂呈“快进快退”表现。图4 术后随访至8个月时超声造影检查结果

注:a,肝方叶可见异常强化影,增强扫描动脉期呈明显环形强化;b,肝右叶后上端可见异常强化影,增强扫描动脉期呈明显环形强化。图5 术后随访至16个月时MRI检查结果
肝FDCS的发病原因至今尚未明确,有报道[3,6-7]认为其发病原因与EB病毒及Castleman病有密切联系。罕见的Castleman病病例有滤泡外FDC的结节性增生或发育不良[8]。而Chan等[9]发现17例FDCS中有2例与Castleman病有关。B超多表现为肝内实性或囊实性肿块。CT平扫多见单发巨大肿物,密度不均,增强扫描可见肿瘤环形强化,中心部位可因坏死或囊变而不均匀强化,复发灶的影像学表现与原发肿瘤类似。实验室检查可发现贫血,绝大部分患者肿瘤标志物为阴性,只有少数病例肿瘤标志物高于正常值。本例患者肿瘤标志物均为阴性。
HFDCS的诊断需要依靠病理学及免疫组化:肿瘤细胞呈梭形或卵圆形,弥漫排列或形成束状,席纹状结构,部分肿瘤内可见模糊的漩涡状结构,类似于脑膜瘤[10]。细胞核有异型性,核分裂象少见。淋巴细胞及浆细胞或多或少地分布于肿瘤细胞间,局部可见小淋巴细胞在血管周围积聚形成血管周围袖套样结构[11]。在免疫组化方面:肿瘤细胞表达树突状细胞标记,如CD21、CD35、CD23阳性,而S100、CD1a、CD20和CD34呈阴性[1]。有研究[12]显示,肝FDCS患者EB病毒检测阳性率63%,异型性细胞和部分梭形细胞EB病毒编码小RNA(EBV encoded small RNA,EBER)原位杂交结果显示阳性,建议肝FDCS 诊断中首选 EBER 检测。本例患者CD21阳性,CD23局灶性阳性,EBER阴性,HBsAg阴性。有报道[13]表示肝FDCS免疫组化Vimentin有时可能也成阳性。本例患者Vimenin阳性。
肝FDCS需与炎性假瘤和Hodgkin 病鉴别[5]。与前者的鉴别点是:(1)肝FDCS只有少量稀疏分布的浆细胞;(2)炎性假瘤以梭形细胞和浆细胞增殖为特点,无束状和席纹状排列特征;(3)炎性假瘤无细胞核异型性;(4)免疫组化检测肝FDCS 对CD21和CD35有特异性表达且EBER表达多数为阳性。与后者鉴别点在于肝FDCS组织形态学上有时可见 R-S样双核细胞,从而容易与Hodgkin 病混淆,但肝FDCS背景淋巴细胞分布均匀且无嗜酸性粒细胞和中性粒细胞,免疫组化检查Hodgkin病CD30和CD15阳性,而肝FDCS CD30和CD15无表达。
肝FDCS的治疗主要有手术切除、化疗、放疗等,首选手术完整切除,术后需要密切随访。有研究[9,14]表示,FDCS复发、转移和死亡的总发生率分别为43%、24%和17%,结外FDC肉瘤5年无复发生存率仅为27.4%。因为本病罕见,临床治疗方法也正处于探索阶段,到目前为止,尚未找到满意的术后辅助治疗方案。查阅国内外文献,本例是首次使用射频消融技术治疗复发性肝FDCS的报道,射频消融可能成为治疗复发性肝FDCS的有效手段之一。适用于淋巴瘤和软组织肉瘤的全身化疗可为转移性FDCS的治疗带来一定的获益[15-16]。目前临床上最常用的化疗方案是CHOP方案(环磷酰胺+阿霉素+长春新碱+泼尼松)。有资料[17]显示,有部分患者对CHOP方案效果不明显,针对CHOP耐药的患者可采用吉西他滨和紫衫烷治疗。
利益冲突声明:所有作者均声明不存在利益冲突。
作者贡献声明:李晨光负责课题设计,资料分析,撰写论文;贾继尧参与收集数据,修改论文;孙栾彪参与修改论文;高硕徽负责拟定写作思路,指导撰写文章并最后定稿。
