木尔坦棉花曲叶病毒RPA快速检测方法的建立
2022-02-10汤亚飞李正刚佘小漫于琳蓝国兵何自福
汤亚飞 李正刚 佘小漫 于琳 蓝国兵 何自福


摘要
木尔坦棉花曲叶病毒Cotton leaf curl Multan virus (CLCuMuV)引起的病害是世界棉花生产上的毁灭性灾害,也是我国进境植物检疫性有害生物之一。因此,建立快速检测技术对CLCuMuV的检疫和防控具有重要意义。本研究根据CLCuMuV外壳蛋白(CP)基因序列设计引物,建立了该病毒的重组酶聚合酶等温扩增(recombinase polymerase amplification,RPA)检测方法,并评价了该方法的灵敏度和特异性,进一步测定了对田间疑似病样的检测准确性。结果表明,建立的RPA检测方法仅能从感染CLCuMuV的样品中扩增出目的条带,而感染同属的其他5种病毒的样品中未扩增出目的条带。该方法检测灵敏度是常规PCR的10倍,且对田间疑似病样的检出结果与PCR试验结果一致。因此,本研究所建立的CLCuMuV RPA快速检测方法具有特异、灵敏、准确、操作简便、无需特殊设备等优点,这些为CLCuMuV的快速检测提供了一种新技术。
关键词
木尔坦棉花曲叶病毒;RPA;快速检测
中图分类号:
S436.418
文献标识码:A
DOI:10.16688/j.zwbh.2020677
Establishment of RPA for rapid detection of Cotton leaf curl Multan virus
TANG Yafei,LI Zhenggang,SHE Xiaoman,YU Lin,LAN Guobing,HE Zifu*
(Research Institute of Plant Protection, Guangdong Academy of Agricultural Sciences; Guangdong
Provincial Key Laboratory of High Technology for Plant Protection, Guangzhou510640, China)
Abstract
Cotton leaf curl Multan virus (CLCuMuV) causes destructive diseases in cotton crops worldwide, which is a quarantine organism subjected to phytosanitary regulations in China. The rapid detection technique is very important for the quarantine and control of CLCuMuV. In this study, a recombinase polymerase amplification (RPA) detection method was established based on the coat protein (CP) gene sequence of CLCuMuV. The sensitivity and specificity of this method were evaluated. The accuracy of this method was determined by detecting the suspected samples in fields. The results showed that the established RPA detection method amplified the target fragment only from CLCuMuVinfected samples, and no fragment was amplified from the samples infected by other five viruses belonging to the same genus with CLCuMuV. The sensitivity of the established RPA detection method was 10fold higher than that of the conventional PCR. The RPA detection results of suspected diseased samples in fields were consistent with the PCR results. Therefore, the rapid CLCuMuV RPA detection method was established in this study, characterized by high specificity, sensitivity, accuracy, easiness to operate, and no requirement for special equipment. It provides a new technique for rapid detection of CLCuMuV.
Key words
Cotton leaf curl Multan virus;RPA;rapid detection
木尔坦棉花曲叶病毒Cotton leaf curl Multan virus(CLCuMuV)属双生病毒科Geminiviridae菜豆金色花葉病毒属Begomovirus成员[1],由烟粉虱Bemisia tabaci以持久方式传播,可嫁接传播,但不能通过机械摩擦和种子带毒传播。CLCuMuV最先发现于巴基斯坦木尔坦地区,是20世纪90年代引起巴基斯坦棉花曲叶病大流行的主要病原[2- 4]。2006年,我国首次在广东的朱槿Hibiscus rosasinensis上检测到CLCuMuV[5]。目前,该病毒已扩散到广西[6 -7]、海南[8]、云南[9]、福建[10]、江苏[11]、新疆等地,侵染朱槿[5,7,10- 11]、红麻H.cannabinus[8]、黄秋葵Abelmoschus esculentus[12]、陆地棉Gossypium hirsutum[6,13]、垂花悬铃花Malvaviscus penduliflorus[14]、玫瑰茄H.sabdariffa[15]等多种锦葵科Malvaceae植物。
棉花是重要的纤维作物,在我国国民经济和社会发展中占有重要的地位。我国是世界上最大的棉花生产国和消费国。棉花曲叶病是世界棉花生产上最具毁灭性的病毒病害。虽然目前我国长江流域、黄河流域和西北内陆三大棉区尚未发生棉花曲叶病,但能引起该病害的病原CLCuMuV已在我国多地危害多种锦葵科作物,尤为重要的是,华南地区已出现由该病毒侵染引起的棉花曲叶病[6,13],再加上其传播介体烟粉虱在我国各地普遍发生,CLCuMuV极有可能导致棉花曲叶病在我国暴发和流行。我国在首次检测到CLCuMuV后,立即将其列入中国进境植物检疫性有害生物名录,确定为一种检疫性病害,依法对其实施检疫。任何植物病毒病诊断、防治和预测预报都需快速、灵敏和特异的检测方法。因此,建立快速准确CLCuMuV检测技术是阻止该病毒传播与扩散的前提,即对预警该病毒侵染引致棉花曲叶病在我国棉区暴发和流行有重要意义。
重组酶聚合酶扩增技术(recombinase polymerase amplification,RPA)是Piepenburg等研发出的一种等温核酸扩增技术[16]。该技术原理是:在恒温(25~43℃)条件下,重组酶(recombinase)与引物核苷酸结合形成聚合体,并促使引物与模板DNA序列进行配对;在碱基序列互补配对时,单链DNA结合蛋白(single strand binding protein)促使模板DNA打开双链;进一步在DNA聚合酶(DNA polymerase)的作用下形成新的DNA互补链,完成扩增反应。该技术具有简便快捷,且不需要专门的仪器设备的优点,被认为是目前最具有应用潜力的恒温扩增技术。樊晓旭等[17]综述了RPA技术在医学病原物快速诊断中的应用,周莹等[18]综述了近几年RPA技术在植物病原物检测上的应用。但目前尚未有RPA技术在棉花曲叶病毒检测方面的报道。本研究建立了不需专门仪器设备、操作简便快捷的CLCuMuV的RPA检测技术,为该病毒的检疫和快速检测提供一种新技术,从而为预防CLCuMuV在我国棉花产区传播扩散、大流行提供技术支持。
1材料与方法
1.1材料
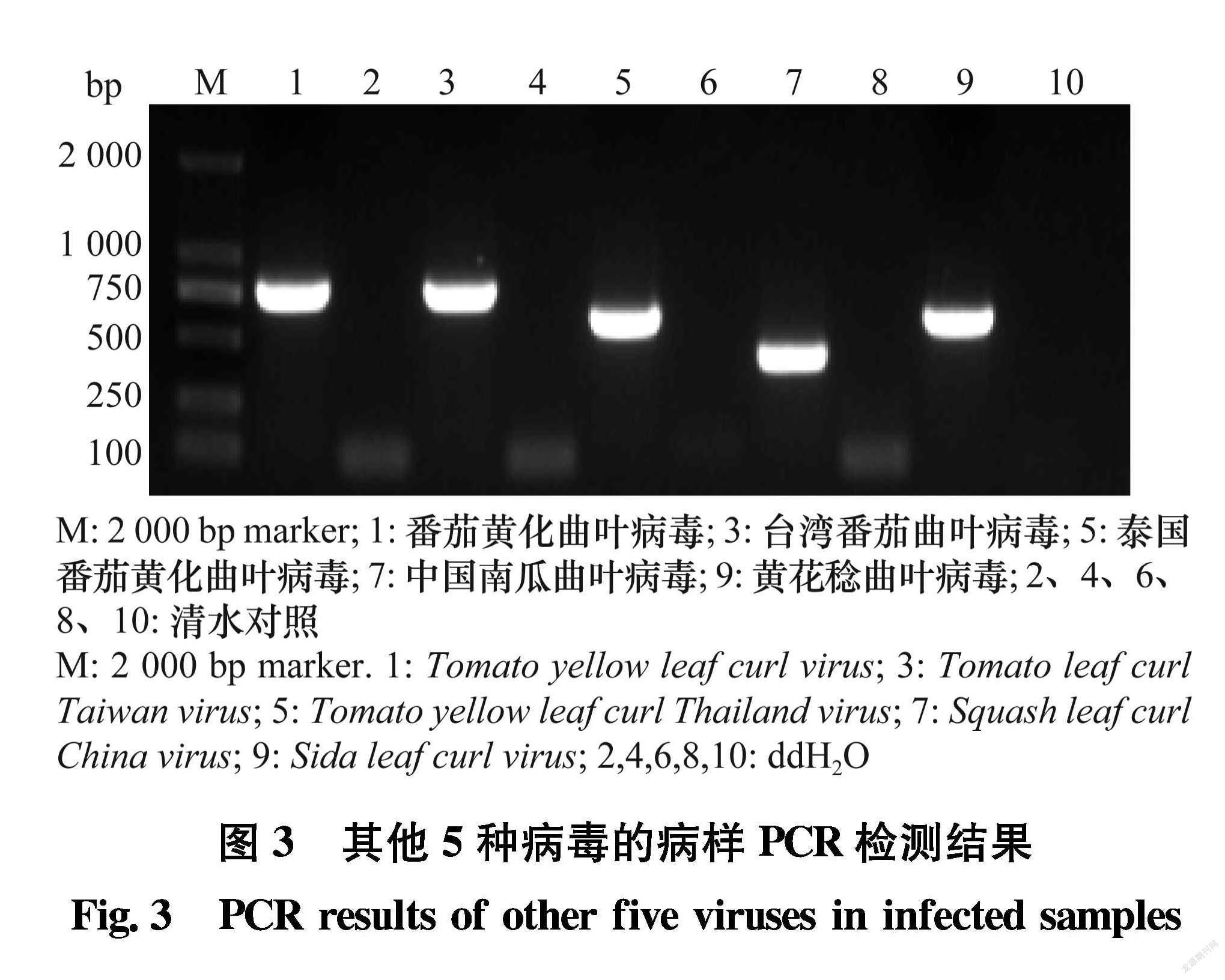
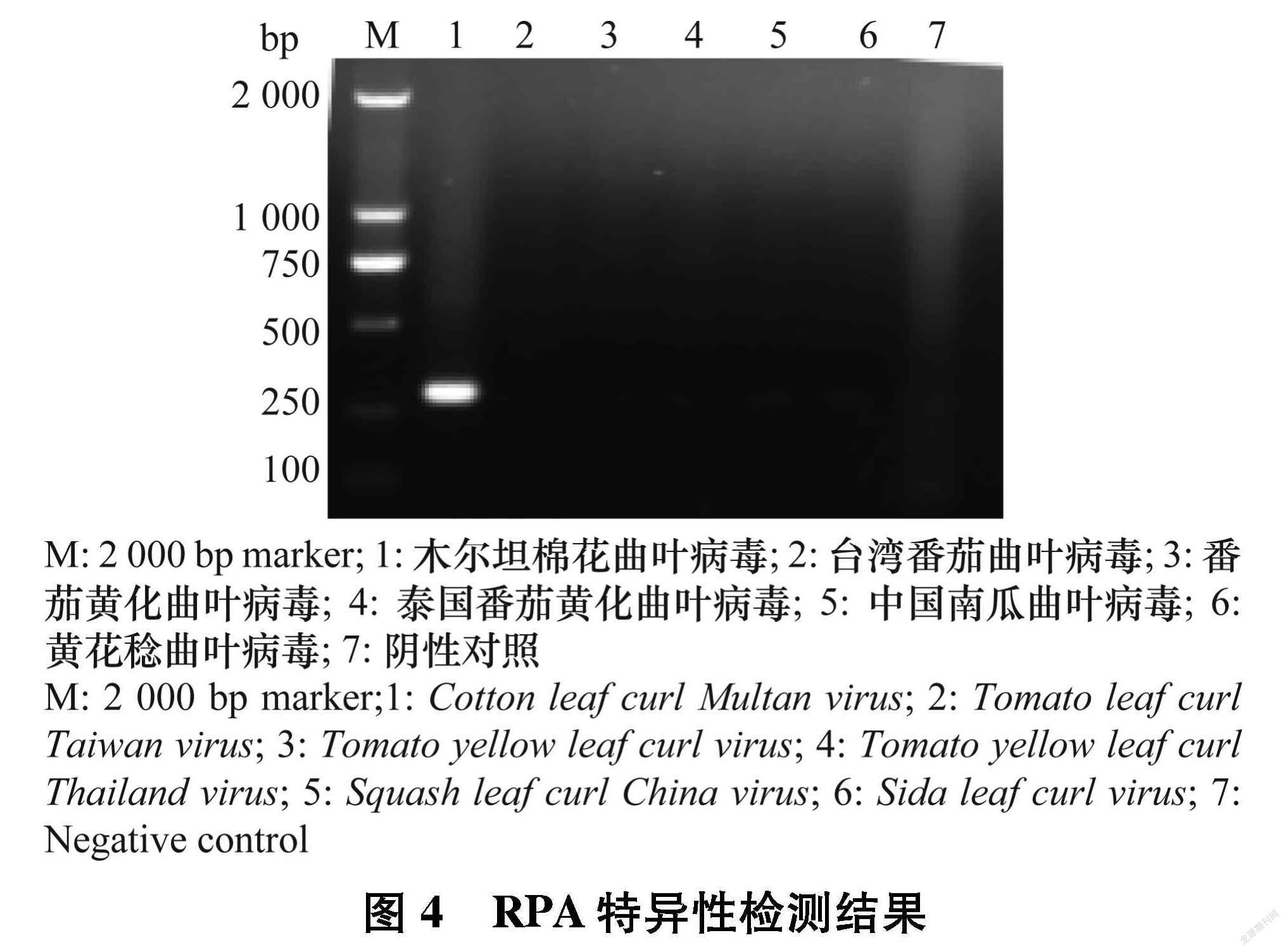
供试感染CLCuMuV的病样采自广东广州的朱槿、感染台湾番茄曲叶病毒Tomato leaf curl Taiwan virus(ToLCTV)的病样采自广东广州的番茄、感染番茄黄化曲叶病毒Tomato yellow leaf curl virus(TYLCV)的病样采自海南三亚的番茄、感染泰国番茄黄化曲叶病毒Tomato yellow leaf curl Thailand virus(TYLCTHV)的病样采自广东汕头的番茄、感染中国南瓜曲叶病毒Squash leaf curl China virus(SLCCNV)的病样是采自广东河源的南瓜病样、感染黄花稔曲叶病毒Sida leaf curl virus(SiLCuV)的病样采自海南东方的番茄; 健康样品为采自本实验室网室繁殖的朱槿植株;待測7份田间朱槿病样分别采自广东省广州(2份)、茂名(2份)、 湛江(2份)、清远(1份)。
TwistAmp Basic RPA试剂盒购自英国TwistDx公司,植物DNA提取试剂盒购自北京全式金生物技术有限公司,Premix TaqTM和DNA片段纯化试剂盒购自宝生物工程(大连)有限公司。
1.2方法
1.2.1引物设计
通过比对CLCuMuV中国分离物的外壳蛋白基因核苷酸序列找出保守区域,结合RPA的引物要求设计引物对CLCVF/CLCVR;同时设计用于PCR检测ToLCTV、TYLCV、TYLCTHV、SLCCNV、SiLCuV的特异引物,引物详情见表1。所有引物由生工生物工程(上海)股份有限公司合成。
1.2.2总DNA的提取
取适量的供试植物叶片,用植物DNA提取试剂盒提取总DNA。具体操作按照试剂盒说明书进行。DNA沉淀溶解于50 μL TE缓冲液,保存于 20℃冰箱,备用。
1.2.3RPA反应体系及最佳反应时间
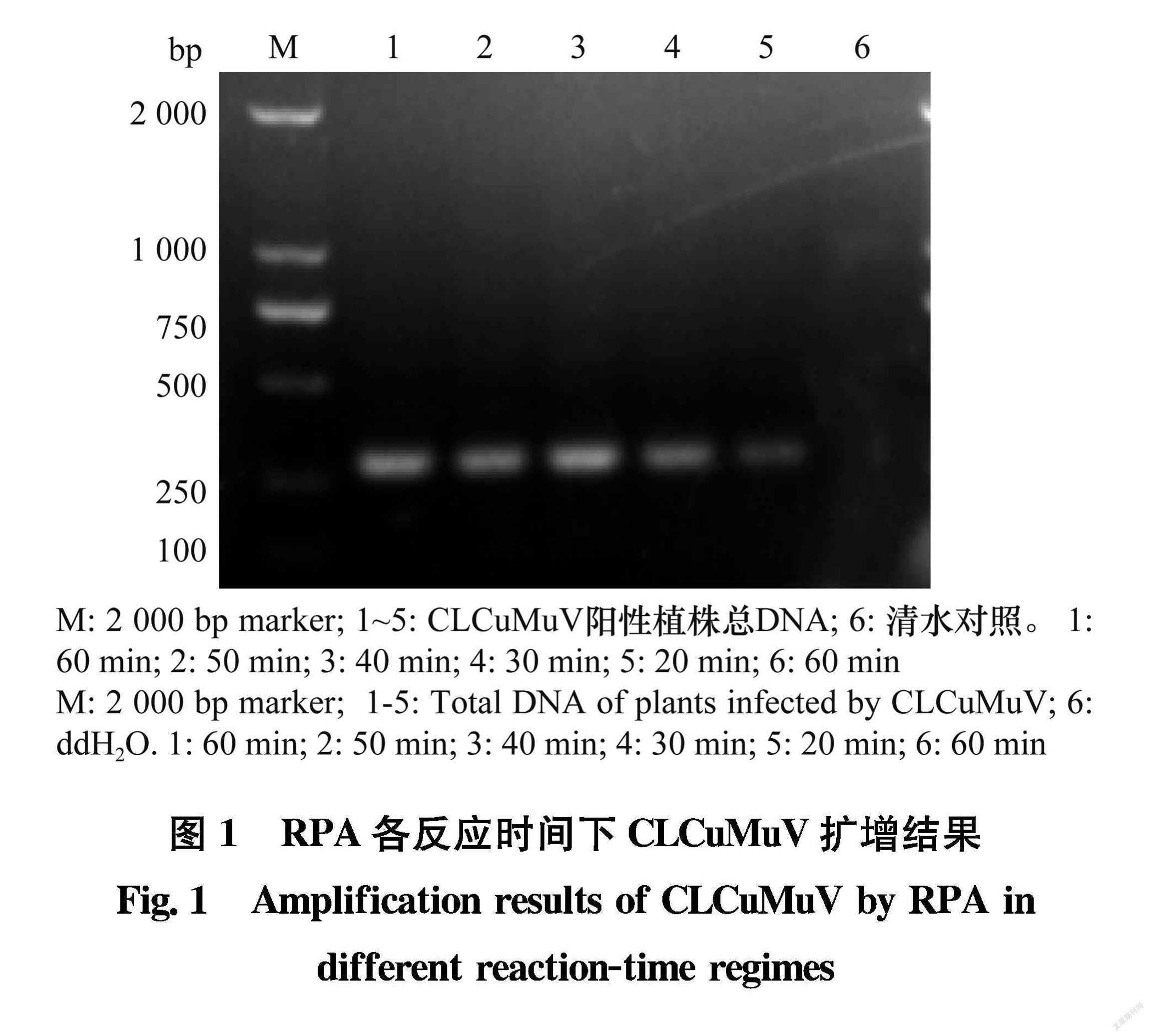
以CLCuMuV阳性植株总DNA为模板,利用引物CLCVF/CLCVR进行RPA扩增。按照TwistAmp Basic RPA试剂盒的说明配制RPA反应体系,向试剂盒中装有冻干酶粉的0.2 mL反应管中加入Rehydration Buffer 29.5 μL、10 μmol/L引物CLCVF和CLCVR各2 μL、模板DNA 2 μL、280 mmol/L醋酸镁2.5 μL、无RNase水12 μL,反应总体系为50 μL。在40℃恒温金属浴中分别反应20、30、40、50、60 min;反应结束后,用DNA片段纯化试剂盒对RPA产物进行纯化回收,取纯化后的RPA产物10 μL进行1.0%琼脂糖凝胶电泳,在凝胶成像系统上观察结果,根据琼脂糖凝胶电泳结果确定最佳反应时间。
1.2.4普通PCR
以CLCuMuV、ToLCTV、TYLCV、TYLCTHV、SLCCNV、 SiLCuV阳性植株总DNA为模板,分别利用表1中检测相应病毒的特异引物进行PCR扩增。模板DNA 2 μL、rTaqTM Premix 25 μL、10 μmol/L 上、下游引物各2 μL、灭菌水19 μL,反应总体系为50 μL。反应条件为:94℃ 预变性4 min;94℃变性45 s,在表1中每种病毒的退火温度下反 应45 s,72℃延伸 45 s,35个循环;72℃延伸10 min 。取PCR产物10 μL进行1.0%琼脂糖凝胶电泳,在凝胶成像系统上观察结果。
1.2.5灵敏度试验
以CLCuMuV阳性植物总DNA 100、10 1、10 2、10 3、10 4、10 5稀释液为模板,分别进行RPA和普通PCR检测,比较二者的检测灵敏度。RPA反应体系同1.2.3,于40℃恒温金属浴中温浴40 min;普通PCR扩增反应体系和反应程序同1.2.4。
1.2.6特异性评价
分别以CLCuMuV、ToLCTV、TYLCV、TYLCTHV、 SLCCNV、SiLCuV特异引物PCR检测为阳性的植物总DNA为模板进行RPA扩增,对所建立的RPA检测方法特异性进行评价,RPA反应体系同1.2.3,然后在恒温金属浴40℃条件下温浴40 min。
1.2.7样品检测
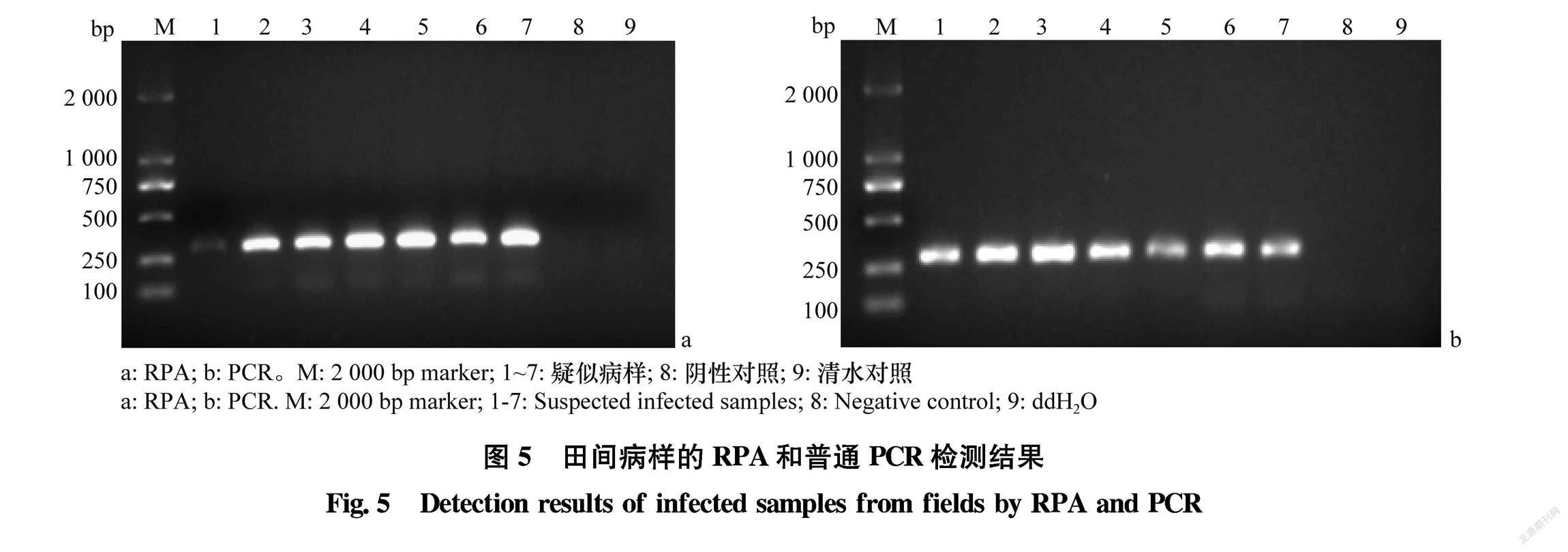
从广东省广州、茂名、湛江、清远采集疑似感染CLCuMuV的朱槿病样7份,提取总DNA,用本研究建立的RPA方法检测,并用普通PCR扩增验证。
2结果与分析
2.1RPA最佳反应时间
以CLCuMuV阳性植株总DNA为模板,利用引物CLCVF/CLCVR进行RPA扩增。电泳结果(图1)表明,40℃温浴20 min时就可以获得目的条带,温浴40 min获得的目的条带最亮,随着时间延长条带亮度无明显变化。根据琼脂糖凝胶电泳结果,确定40 min为最佳反应时间。
2.2灵敏度检测结果
以稀释度分别为100、10 1、10 2、10 3、10 4、10 5 的CLCuMuV阳性植株总DNA为模板,分别进行RPA和普通PCR检测。电泳
结果(图2)显示,RPA在模板稀释倍数为10 3时能扩增出目的条带,普通PCR在模板稀释倍数为10 2时能扩增出目的条带,因此,本研究所建立的RPA检测方法是普通PCR检测方法的10倍。
2.3特异性评价结果
分别以ToLCTV、TYLCV、TYLCTHV、SLCCNV、 SiLCuV检测为阳性(图3)的植物病样总DNA和CLCuMuV阳性植株总DNA为模板进行RPA扩增,对所建立的RPA检测方法特异性进行评价。电泳结果(图4)显示,所建立的RPA检测方法只能从含有CLCuMuV的总DNA中扩增出目的条带,不能从其他几种病毒总DNA中扩增出任何条带。由此可见,所建立的RPA检测技术具有较好的特异性,可有效检测CLCuMuV。
2.4田间样品的检测结果
从广东省广州、茂名、湛江、清远采集疑似感染CLCuMuV的朱槿病样7份,用所建立的RPA扩增系统进行检测,电泳结果显示(图5),7份疑似病样均为阳性,进一步应用PCR加以验证,其检测结果与RPA结果的一致率为100%,表明,所建立的RPA检测方法能够实现田间病样中CLCuMuV的快速、准确检测与诊断。
3讨论
本研究建立了木尔坦棉花曲叶病毒快速RPA检测方法。与普通PCR检测方法相比,RPA扩增过程中不需要热循环,可在恒温水浴锅或烘箱中进行,不依赖昂贵而专业的仪器设备;反应速度快,在适合温度条件下最短20 min就可以完成扩增反应;RPA检测灵敏度是普通PCR的10倍;RPA检测技术对引物要求比常规PCR嚴格,引物一般由30~35个核苷酸组成,而常规PCR引物长度通常为20~25个核苷酸。本研究根据CLCuMuV中国分离物的外壳蛋白基因核苷酸序列设计引物,检测与CLCuMuV同属的其他5种病毒,结果均为阴性,特异性较好。因此,本研究建立了简便、快速、灵敏和特异的CLCuMuV检测方法。
RPA技术不仅具有快速、灵敏、特异等优点,而且可以在恒温条件下完成扩增,适用于实验室外的现场诊断,是目前最具有应用潜力的恒温扩增技术。自2006年首次报道以来,RPA技术已取得快速发展,尤其随着商业化产品的出现,该技术在医学、食品、农业等领域得到了更为广泛的应用。近几年RPA技术也逐渐被应用于植物病毒的检测。目前已报道建立了番茄斑萎病毒Tomato spotted wilt virus(TSWV)[19]、番茄褪绿病毒Tomato chlorosis virus(ToCV)[20]、番茄黄化曲叶病毒(TYLCV)[21]、南方菜豆花叶病毒Southern bean mosaic virus(SBMV)[22]﹑樱桃病毒A Cherry virus A(CVA)[23]﹑玉米褪绿斑驳病毒Maize chlorotic mottle virus (MCMV)[24]、菜豆荚斑驳病毒Bean pod mottle virus(BPMV)[25]、大豆花叶病毒Soybean mosaic virus(SMV)[26]、葡萄卷叶伴随病毒3号Grapevine leaf rollassociated virus 3(GLRaV3)[27]、李矮缩病毒Prune dwarf virus(PDV)[28]等多种植物病毒的RPA检测方法,但未见有CLCuMuV RPA检测报道。
CLCuMuV是有可能引起我国棉花曲叶病暴发和流行的病毒,是我国进境植物检疫性有害生物,可随带毒苗木进行远距离传播。针对性加强病毒寄主苗木的检疫是防止CLCuMuV在我国棉花产区发生的关键。目前,用于检测CLCuMuV的技术主要有常规PCR、实时荧光PCR[29 30]、纳米磁珠荧光PCR[31]。这些技术都需要专业仪器设备,只能适用于实验室快速检测。本研究建立的CLCuMuV RPA技术不需要专业仪器设备,适合基层单位和口岸现场以及田间检测使用,为我国棉花曲叶病的田间诊断、预测预报和相关寄主苗木带毒快速检测提供了一种更为便捷的技术手段,具有广泛的应用前景,对我国棉花曲叶病的综合防控具有重要意义。
参考文献
[1] BROWN J K, ZERBINI F M, NAVASCASTILLO J, et al. Revision of Begomovirus taxonomy based on pairwise sequence comparisons [J]. Archive of Virology, 2015, 160(6):1593- 619.
[2]ZHOU Xueping, LIU Yule, ROBINSON D J, et al. Four DNAA variants among Pakistani isolates of Cotton leaf curl virus and their affinities to DNAA of geminivirus isolates from okra [J]. Journal of General Virology, 1998, 79(4): 915- 923.
[3]BRIDDON R W, MARKHAM P G. Cotton leaf curl virus disease [J]. Virus Research, 2000, 71(1/2): 151- 159.
[4]MANSOOR S, BRIDDON R W, BULL S E, et al. Cotton leaf curl disease is associated with multiple monopartite begomoviruses supported by single DNA β [J]. Archives of Virology, 2003, 148(10): 1969 1986.
[5]毛明杰, 何自福, 虞皓, 等. 侵染朱槿的木爾坦棉花曲叶病毒及其卫星DNA全基因组结构特征[J]. 病毒学报, 2008, 24(1): 64 -68.
[6]CAI Jianhe, XIE Ke, LIN Lin, et al. Cotton leaf curl Multan virus newly reported to be associated with cotton leaf curl disease in China [J]. Plant Pathology, 2010, 59(4): 794- 795.
[7]林林, 蔡健和, 罗恩波, 等. 南宁市朱槿曲叶病毒病病原分子鉴定和寄主范围研究[J]. 植物保护, 2011, 37(4): 44 -47.
[8]汤亚飞, 何自福, 杜振国, 等. 海南红麻曲叶病的病原检测与鉴定[J]. 植物病理学报, 2015,45(6): 561 568.
[9]TANG Yafei, HE Zifu, ZHOU Guohui. Passiflora edulis is a new host of Cotton leaf curl Multan virusbetasatellite complex in China [J]. Canadian Journal of Plant Pathology, 2020, 42(4):493 -498.
[10] 章松柏, 夏宣喜, 张洁, 等. 福州市发生由木尔坦棉花曲叶病毒引起的朱槿曲叶病[J]. 植物保护, 2013, 39(2):196 -200.
[11] 张晖, 季英华, 吴淑华, 等. 江苏朱槿上分离到的木尔坦棉花曲叶病毒基因组结构特征分析[J]. 植物病理学报, 2015, 45(4): 361 369.
[12] 董迪, 朱艳华, 何自福, 等. 侵染广东黄秋葵的木尔坦棉花曲叶病毒及伴随卫星DNA的分子特征[J]. 华南农业大学学报, 2012, 33(1): 33 -39.
[13] 汤亚飞, 何自福, 杜振国, 等. 木尔坦棉花曲叶病毒及其伴随的β卫星分子复合侵染引起广东棉花曲叶病[J]. 中国农业科学, 2015, 48(16): 3166 3175.
[14] 汤亚飞, 何自福, 杜振国, 等. 侵染垂花悬铃花的木尔坦棉花曲叶病毒分子特征研究[J]. 植物病理学报, 2013, 43(2): 120 -127.
[15] ARIF M, LIN Wenzhong, LIN Lihuang, et al. Cotton leaf curl Multan virus infecting Hibiscus sabdariffa in China [J]. Canadian Journal of Plant Pathology, 2018, 40(1):128 -131.
[16] PIEPENBURG O, WILLIAMS C H, STEMPLE D L, et al. DNA detection using recombination proteins [J/OL]. PLoS Biology, 2006, 4(7): e204. DOI:10.1371/journal.pbio.0040204.
[17] 樊晓旭, 赵永刚, 李林, 等. 重组酶聚合酶扩增技术在疾病快速检测中的研究进展[J]. 中国动物检疫, 2016, 33(8): 72- 77.
[18] 周莹, 岳瑾, 李云龙, 等. 重组酶介导的等温扩增技术及其在植物病原检测中的应用[J]. 中国植保导刊, 2020, 40(6): 27 -31.
[19] 余辛, 魏梅生, 林晓红, 等. 番茄斑萎病毒RTRPA检测方法的建立[J]. 植物检疫,2020, 34(5): 46- 49.
[20] 宋建, 薛俊, 孙海波, 等. 一种基于RPA的番茄褪绿病毒检测方法[J]. 植物保护,2020, 46(4): 168 -170.
[21] 周莹, 杨丽梅, 刘梅, 等. 重组酶聚合酶扩增技术在番茄黄化曲叶病毒检测中的应用[J]. 中国蔬菜, 2019 (1):36 -40.
[22] 魏霜, 袁俊杰, 李桂芬, 等. 南方菜豆花叶病毒RTRPA检测方法的建立[J]. 植物检疫, 2018, 32(1): 50 -53.
[23] 陈玲, 段续伟, 张开春, 等. 基于重组酶聚合酶扩增(RPA)技术的樱桃病毒A(CVA)的检测方法[J]. 园艺学报, 2020, 47(1):1 -9.
[24] 馮黎霞, 魏霜, 余辛, 等. 重组酶聚合酶扩增技术(RPA)快速检测玉米褪绿斑驳病毒[J]. 植物保护学报, 2020, 47(1): 217- 218.
[25] 张永江, 魏霜, 袁俊杰, 等. 一步法逆转录重组酶聚合酶常温扩增(RTRPA)技术检测菜豆荚斑驳病毒[J]. 江苏农业科学, 2018, 46(21): 96- 98.
[26] 袁俊杰, 魏霜, 龙阳, 等. 一步法逆转录重组酶聚合酶常温扩增(RTRPA)技术检测大豆花叶病毒[J]. 检验检疫学刊, 2018, 28(2): 1- 4.
[27] 张娜, 乾义柯, 魏霜, 等. 基于重组酶聚合酶扩增技术(RPA)的葡萄卷叶伴随病毒3号检测方法[J]. 新疆农业科学, 2016, (2): 302- 308.
[28] 陈玲, 闫国华, 张晓明, 等. 李矮缩病毒重组酶聚合酶扩增—侧流层析试纸条检测方法的建立[J]. 园艺学报,2021,48(1):183 192.
[29] 赵蕊, 吕利华, 陈婷, 等. 木尔坦棉花曲叶病毒SYBR Green I 实时荧光定量PCR检测方法[J]. 华南农业大学学报, 2015, 36(6): 87 -90.
[30] 张卫东, 王岚, 冯宇梅, 等. 实时荧光PCR法特异性检测棉花曲叶病毒[J]. 广东农业科学, 2015, 42(2): 126 -130.
[31] 张永江, 李明福, 辛言言, 等. 应用纳米磁珠荧光PCR检测棉花曲叶病毒[J]. 棉花学报, 2013, 25(1): 90 -94.
收稿日期:2020 -12 -17修订日期:2020 -12- 29
基金项目:
国家自然科学基金(31871937);广东省现代农业产业共性关键技术研发创新团队建设项目(2020KJ134);广州市科技计划(201904010173);广东省科技创新战略专项资金(高水平农科院建设)(R2019PYJX005)
* 通信作者
Email:hezf@gdppri.com
