高表达lncRNA调控意大利蜜蜂工蜂中肠发育的作用解析
2022-02-10孙明会范元婵郭意龙张凯遥石彩云陈大福
王 杰, 孙明会, 隆 琦, 范元婵, 吴 鹰, 郭意龙, 张凯遥, 石彩云, 陈大福,2, 郭 睿,2
(1.福建农林大学动物科学学院(蜂学学院), 福州 350002; 2.福建农林大学蜂疗研究所, 福州 350002)
1 引 言
长链非编码RNA(long non-coding RNA, lncRNA)是ncRNA世界的重要成员之一,一般长度大于200 nt且包含2个以上外显子,由RNA聚合酶Ⅱ转录形成[1]. 类似于mRNA,lncRNA具有5′端帽子和3′ployA尾巴,但多数lncRNA的表达量较低且长度更短[2]. 在发现之初,lncRNA被认为是基因转录过程的副产物,但随着研究的不断增多与深入,lncRNA已被证实在基因组印记、染色体修饰、转录调控等诸多生物学过程中发挥重要作用[3,4]. LncRNA的作用方式灵活多样,不仅能通过顺式(cis)作用对其相邻蛋白编码基因的的表达进行调控,还可以通过反式作用(trans)调控距离较远基因的表达[1];此外,lncRNA还能作为竞争性内源RNA(competing endogenous RNA, ceRNA)与其他含相同miRNA反应元件(miRNA response element, MRE)的RNA分子竞争性结合miRNA,从而间接调节下游基因的表达水平[5]. CeRNA机制已在人类、其他哺乳动物和植物中被广泛证实. Xue等[6]发现肝癌细胞中上调表达的Loc339803可通过竞争结合miR-30a-5p进而调控靶基因SNAIL1,最终促进了肝癌细胞的侵袭和迁移;Wang等[7]研究表明IMFlnc1可以通过竞争结合miR-199a-5p并影响caveolin-1的表达进而影响猪中肌内脂肪含量. Yuan等[8]建立了植物中ceRNA调控网络数据库PceRBase(http://bis.zju.edu.cn/pcernadb/index.jsp),收录了拟南芥在内26种植物中潜在的ceRNA调控网络. 但目前lncRNA在意蜂工蜂中肠发育中的调控作用尚不清楚. 通过解析高表达lncRNA在意蜂工蜂中肠发育过程的表达谱及潜在调控作用,可为明确HlncRNA的分子功能提供理论依据,并为阐明中肠发育机理打下基础.
近年来,随着高通量测序技术的快速发展,人们在黑腹果蝇(Drosophilamelanogaster)、家蚕(Bombyxmori)、小菜蛾(Plutellaxylostella)[9-11]等昆虫中鉴定到大量lncRNA. 研究表明lncRNA可参与昆虫的生殖、发育、行为和免疫等过程. 但蜜蜂lncRNA的研究较为滞后,迄今仅有少量的研究报道. 例如,郭昱等[12]通过比较意蜂蜂王与工蜂4、5和6日龄幼虫中lncRNA的表达谱,发现在幼虫的发育进程中差异lncRNA的数量逐渐增多,功能注释显示差异lncRNA在组织发育、神经系统发育、转录调控等方面发挥潜在的调控作用. Chen等[13]通过对意大利蜜蜂的处女王、产卵蜂王、抑制产卵的蜂王以及产卵恢复的蜂王进行转录组测序,鉴定出位于控制卵巢大小数量性状位点(QTL)的14条lncRNA,并进一步筛选出卵巢发育和产卵相关的2条lncRNA XLOC_073978和XLOC_081294.
意大利蜜蜂(Apismelliferaligustica,简称意蜂)是西方蜜蜂(Apismellifera)的亚种之一,因具有性情温顺、采集能力优越及分泌蜂王浆能力和造脾能力较强的显著优势而在世界各养蜂国家中广泛饲养. 中肠是昆虫的重要组织,除了直接发挥食物消化和营养吸收的功能外,还能分泌抗菌肽和活性氧进而参与昆虫的免疫及解毒过程[14]. 前人对于蜜蜂肠道的研究主要涉及肠道微生物方面[15],而肠道发育机理的相关研究很少. 此前,笔者团队全基因组鉴定、分析和验证了意蜂工蜂中肠的lncRNA和环状RNA(circular RNA, circRNA)[16,17],并对中肠发育过程的lncRNA差异表达谱、circRNA差异表达谱及调控网络进行了系统解析[18,19].
笔者团队前期已利用链特异性cDNA建库的RNA-seq技术意蜂工蜂中肠进行深度测序,本研究拟基于已获得的高质量转录组数据筛选意蜂工蜂中肠的高表达lncRNA(highly expressed lncRNA, HlncRNA),通过分子生物学手段验证HlncRNA的真实表达并检测其在工蜂中肠发育过程的表达谱,进而利用生物信息学方法分析和探讨HlncRNA的顺式作用、反式作用和ceRNA调控网络,以期深入揭示HlncRNA在意蜂工蜂中肠发育过程的潜在作用,并为探明背后的分子机理提供理论依据和基础.
2 材料与方法
2.1 材 料
2.1.1 转录组数据来源 之前笔者所在团队已利用链特异性cDNA建库的RNA-seq技术对意蜂7日龄(Am7)和10日龄(Am10)工蜂中肠进行测序,得到的平均raw reads数分别为134 802 058和147 051 470 条,经严格过滤得到的平均clean reads数分别为134 166 157和146 293 288条,平均Q20和Q30分别达到97.34%和93.86%[18],质控结果表明转录组数据质量良好,可满足本研究的需要.
2.1.2 意蜂工蜂 取自本院教学蜂场.
2.2 方 法
2.2.1 HlncRNA筛选 参照Chen等[2]的报道,利用FPKM(Fragments Per Kilobase of transcript per Million mapped reads)法对每一条lncRNA的表达量进行归一化. 将Am7组和Am10组包含的所有lncRNA按照FPKM值从高往低排序,表达量最高的前9条lncRNA相同,均为XR_001706220.1、XR_001702285.1、XR_001703498.1、XR_411315.2、TCONS_00004791、TCONS_00004790、TCONS_00034036、TCONS_00007249和TCONS_00006094. 因此,本研究选择上述9条HlncRNA进行验证、检测和分析.
2.2.2 意蜂工蜂的人工饲养及中肠样品的制备 按照笔者所在实验室前期已建立的技术流程[16]进行意蜂工蜂的人工饲养及中肠样品制备:从群势较强的蜂群中提出封盖子脾,置于34±0.5 ℃的培养箱中待工蜂出房,将刚出房的工蜂记为1日龄,然后在34±0.5 ℃的条件下连续饲养至21日龄,每日检查工蜂的存活状态,并及时清理死亡蜜蜂. 本实验进行3次生物学重复. 每日随机选取3只工蜂拉取中肠,放入RNA-free的离心管,经液氮速冻后置于-80 ℃超低温冰箱保存.
2.2.3 意蜂工蜂中肠中HlncRNA的RT-PCR验证 根据上述9条HlncRNA的核酸序列,采用DNAMAN软件(Lynnon Biosoft公司,美国)设计相应的特异性引物,委托上海生工生物有限公司合成. 利用AxyPrepTMMultisource Total RNA Miniprep Kit(TaKaRa公司,日本)分别提取上述21个日龄中工蜂中肠样品的总RNA,作为模板经反转录得到相应的cDNA,再作为模板进行PCR. PCR反应体系包含:cDNA模板1 μL,上游及下游引物各1 μL,PCR mix 10 μL,无菌水7 μL. PCR反应程序设置为:94 ℃预变性 5 min;94 ℃变性 30 s,55 ℃退火 30 s,72 ℃延伸 30 s,共 34 个循环;72 ℃再延伸 10 min. PCR 产物经1.5%琼脂糖凝胶电泳检测后用凝胶成像仪(上海培清,中国)观察和拍照.
2.2.4 意蜂工蜂中肠发育过程中HlncRNA表达谱的qPCR检测 利用1.3中制备的cDNA作为模板进行qPCR. qPCR反应按照SYBR Green Dye试剂盒(Vazyme公司,中国)的操作说明书进行. RT-qPCR反应在QuantStudio 3(ABI公司,美国)上进行. 反应体系(20 μL)包括:SYBR Green Dye 10 μL,浓度为1 μmol/L的上下游引物各1 μL,cDNA模板1 μL,无菌水7 μL. 反应程序为:95 ℃预变性 1 min,95 ℃变性 15 s,60 ℃延伸 30 s,共40个循环. 每个反应进行3次平行重复和3次技术重复. 以actin基因作为内参. 以意蜂1日龄工蜂中肠作为对照组,采用2-ΔΔCt法[20]计算上述9条HlncRNA在2~21日龄工蜂中肠中的相对表达量.
2.2.5 HlncRNA的顺式作用和反式作用分析 参照熊翠玲等的方法[16],将HlncRNA上下游10 kb内的蛋白编码基因预测为HlncRNA顺式调控的靶基因. 通过计算lncRNA与mRNA的共表达关系,选择其中Pearson相关系数大于0.95的mRNA作为HlncRNA反式调控的靶mRNA. 然后利用Omicshare平台(http://www.omicshare.com/tools/index.php/)对高表达lncRNA的上下游基因以及反式作用的靶mRNA进行GO(Gene Ontology)分类和KEGG通路富集分析.
2.2.6 HlncRNA的靶向预测及调控网络构建与分析 参照郭睿等[19]的方法,联用Miranda、RNAhybrid和TargetScan三个软件预测lncRNA的靶miRNA以及miRNA的靶mRNA. 依据靶向关系构建HlncRNA-miRNA-mRNA调控网络. 通过Cytoscape软件对调控网络进行可视化. 再利用基迪奥云平台的相关软件对调控网络中的靶mRNA进行GO数据库(http://geneontology.org/)和KEGG数据库(https://www.kegg.jp/)注释,均采用默认参数.
3 结果与分析
3.1 HlncRNA的筛选及表达验证
Am7组和Am10组中表达量最高的前9条lncRNA相同,均为XR_001706220.1、XR_001702285.1、XR_001703498.1、XR_411315.2、TCONS_00004791、TCONS_00004790、TCONS_00034036、TCONS_00007249、TCONS_00006094 利用RT-PCR对上述9条HlncRNA进行验证,电泳结果显示它们在意蜂1~21日龄工蜂中肠中均真实表达;其中XR_001706220.1的验证结果如图1所示.

表1 9条高表达lncRNA在Am7组和Am10组中的FPKM值Tab.1 FPKM values of nine HlncRNAs in Am7 group and Am10 group
3.2 HlncRNA在意蜂工蜂发育过程中的表达谱检测
RT-qPCR检测结果显示,上述9条HlncRNA在意蜂工蜂中肠发育1~21日龄总体上均表现出不同的表达规律;XR_411315.2的表达量在5日龄时最高,TCONS_00006094的表达量在9日龄时最高,其余7条HlncRNA的表达水平均在6日龄时达到峰值;XR_001706220.1的表达量在2~4日龄持续上调,其余8条HlncRNA在2~4日龄均表现为先下调再上调;XR_001703498.1、TCONS_00004791、TCONS_00004790和TCONS_00007249的表达量在15日龄前不断变化,但在17~21日龄表达量趋于稳定.

图2 9条高表达lncRNA在意蜂工蜂中肠发育过程的表达谱Fig.2 Expression profile of nine HlncRNAs during the developmental process of the A. m. ligustica worker’s midgut
3.3 意蜂工蜂中肠HlncRNA的顺式作用和反式作用分析
顺式作用分析结果显示, 9条HlncRNA潜在调控32个上下游基因. 反式作用分析结果显示,9条HlncRNA与共表达的18条mRNA具有正(或负)相关关系. 对HlncRNA顺式和反式调控的上下游基因和mRNA进行GO分类,结果显示这些靶标涉及单一组织进程、细胞进程和定位等9个生物学进程相关条目,细胞膜、细胞膜组分和细胞等7个细胞组分相关条目及结合和催化活性等4个分子功能相关条目(图3a). KEGG通路富集分析结果显示,上述靶标可富集在ABC转运体、胆汁分泌及糖类消化与吸收等18条通路(图3b).
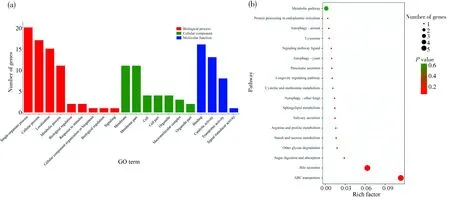
图3 9条高表达lncRNA顺式和反式调控靶标的GO分类(a)和KEGG通路富集分析(b)Fig.3 GO classification (a) and KEGG pathway enrichment analysis (b) of cis- and trans-regulating targets of nine HlncRNAs
3.4 意蜂工蜂中肠HlncRNA的靶向预测及调控网路分析
靶向预测结果显示,9条HlncRNA共靶向55个miRNA,进而结合131条mRNA. 靶向miRNA数量最多的HlncRNA是TCONS_00006094和XR_001703498.1,分别靶向33和6个miRNA. 结合mRNA数量最多的miRNA是ame-miR-3477和mir-283-x,分别结合16和11条mRNA(图4). 进一步的数据库注释结果显示,ceRNA调控网络中的靶mRNA可注释到细胞进程、代谢进程、结合、催化活性和应激反应等30个功能条目,以及内吞作用、细胞周期、Wnt信号通路、Hippo信号通路、和Notch信号通路等70条通路.
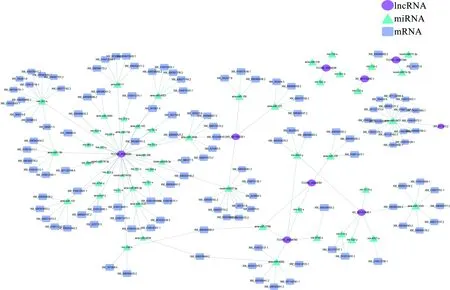
图4 意蜂工蜂中肠的9条高表达lncRNA的ceRNA调控网络Fig.4 CeRNA network of nine HlncRNAs in the midgut of A. m. ligustica worker
4 讨 论
昆虫中肠不仅是消化吸收的主要场所,也是重要的免疫器官[14]. LncRNA能在转录水平和转录后水平发挥灵活多样的调控功能[1,3]. 有研究表明表达量较高的lncRNA在癌症发生、免疫应答等方面具有重要的调控功能. 例如,Zhang等[21]研究发现lncRNA CCND2-AS1在恶性胶质瘤组织和细胞中的表达量较高,可通过增强脑胶质瘤中的Wnt/β-catenin信号通路促进胶质瘤细胞增殖;Valanne等[22]研究发现当果蝇感染革兰氏阳性细菌M.luteus后,lincRNA-IBIN维持高表达且可通过影响Toll通路进而参与宿主免疫应答. 基于笔者团队已获得的高质量lncRNA组学数据,我们发现9条HlncRNA在意蜂7和10日龄工蜂中肠中均为高表达(FPKM值分别介于75.62~7353.5和93.47~2904.95),暗示这些HlncRNA在中肠发育过程的潜在重要性. 本研究中,RT-PCR结果显示上述9条HlncRNA在意蜂1~21日龄工蜂中肠中均真实表达;此外,RT-qPCR检测结果显示它们在1~21日龄工蜂中肠中呈现出不同的表达规律,XR_411315.2的表达量在5日龄时最高,TCONS_00006094的表达量在9日龄时最高,其余7条HlncRNA的表达水平均在6日龄时达到峰值;XR_001706220.1的表达量在2~4日龄持续上调,其余8条HlncRNA在2-4日龄均表现为先下调再上调;XR_001703498.1、TCONS_00004791、TCONS_00004790和TCONS_00007249的表达量在15日龄前不断变化,但在17~21日龄表达量趋于稳定. 意蜂工蜂中肠发育是一个复杂的过程,期间伴随着不同分子事件的次第发生,HlncRNA的表达谱检测结果可为进一步的功能研究提供理论和实验依据.
LncRNA的功能与其邻近的蛋白编码基因密切相关,可通过影响基因的启动子或者其他顺式作用元件发挥调控作用;此外,lncRNA也可以结合距离较远的基因上的增强子或启动子,进而调控基因表达[1]. 笔者团队前期研究发现无论在意蜂工蜂中肠发育过程还是在意蜂工蜂中肠响应东方蜜蜂微孢子虫侵染的过程中,差异表达lncRNA均可可以通过顺式和反式作用发挥潜在的调控功能[2, 18]. 本研究发现,9条HlncRNA的上下游基因和共表达mRNA共有50个,可注释到胆汁分泌、胰液分泌、唾液分泌和糖类消化与吸收等消化吸收相关条目,以及内质网蛋白加工、半胱氨酸和蛋氨酸代谢及淀粉和蔗糖代谢等物质代谢相关通路. 以上结果表明相应的HlncRNA在意蜂工蜂中肠发育过程潜在调节消化吸收与物质代谢. 自噬在真核生物中广泛存在,当生物体遭遇营养缺乏、病原入侵和细胞程序性死亡时都可以激活自噬进而起到平衡体内环境的功能[23].本研究中,HlncRNA顺式和反式调控的靶标可注释到细胞自噬-动物、细胞自噬-其它真菌及细胞自噬-酵母,说明相应的HlncRNA可能通过调节自噬机制进而参与意蜂工蜂中肠的发育过程.
CeRNA机制认为含相同或类似miRNA反应元件(miRNA response elements, MREs)的不同类型RNA皆能通过竞争性结合miRNA调控基因表达[5]. Feng等[24]通过对抗丁氟螨酯与丁氟螨酯敏感品系的朱砂叶螨进转录组测序和比较分析,筛选出与丁氟螨酯抗性相关的lincRNA_Tc13743.2,过表达实验结果表明lincRNA_Tc13743.2可通过与谷胱甘肽 S-转移酶基因TcGSTm02竞争结合miR-133-5p介导朱砂叶螨对丁氟螨酯的抗性. 本研究中,9条HlncRNA可靶向59个miRNA进而结合131条mRNA. 进一步分析发现,TCONS_00006094、XR_001703498.1、TCONS_00004790、XR_001706220.1和TCONS_00004791靶向的miRNA较多,分别为33、6、5、3和3个,这些靶miRNA又能分别靶向75、14、12、16和4条mRNA;上述5条HlncRNA形成的调控网络较为复杂;而TCONS_00034036仅靶向4个miRNA,XR_001702285.1可靶向2个miRNA,进而结合1条mRNA;类似地,TCONS_00007249可靶向2个miRNA,进而结合1条mRNA;XR_411315.2仅能靶向1个miRNA,但能进一步结合16条mRNA. 根据ceRNA机制的原理,处于调控网络中心且连接靶标的数量越多(即联通性越强)的RNA分子的重要性越大,推测TCONS_00034036、XR_001702285.1、TCONS_00007249和XR_411315.2在意蜂工蜂中肠发育的过程中作用相对其他5条HlncRNA较弱. 通过功能注释发现调控网络中的靶mRNA可注释到消化相关通路如初级胆汁酸生物合成,这表明HlncRNA不仅可通过顺式和反式作用还可以通过ceRNA机制对中肠的消化吸收进行调控;此外,还发现HlncRNA间接调控的靶mRNA可注释到Hippo和Wnt信号通路. Hippo信号通路由一系列保守激酶组成,通过调控细胞增殖与凋亡从而控制器官大小[25]. Wnt信号通路已被证实在昆虫生长、发育和代谢等方面扮演重要角色[26]. 目前,利用RNAi技术对昆虫的lncRNA进行敲减和功能研究已见诸报道[24,27]. 下一步我们将针对9条HlncRNA分别设计合成特异性siRNA,然后通过饲喂siRNA的方法对意蜂工蜂中肠的单条HlncRNA进行敲减或多条HlncRNA同时进行敲减,进一步探究HlncRNA的功能.
综上所述,本研究证实了9条HlncRNA的真实表达并检测了它们在意蜂工蜂中肠中的表达谱,揭示了HlncRNA可通过其顺式作用、反式作用和ceRNA调控网络调节消化吸收和物质代谢,进而参与中肠的发育过程.
