补阴益智汤配方颗粒对睡眠剥夺小鼠记忆力及睡眠质量的影响
2022-02-08李克建
李克建 李 静 李 红
(1 湖北中医药大学附属湖北省中医院神志病科,武汉,430000; 2 武汉市儿童医院中西结合科,武汉,430015)
睡眠剥夺(Sleep Deprivation,SD)指自身或外部原因所导致睡眠时间被迫减少的一类疾病,可导致患者注意力下降、学习记忆及认知功能障碍、机体免疫力下降等症状[1]。据世界流行病学分析,全球超过三分之一的人口有睡眠障碍及失眠症状,且世界卫生组织指出SD是一个应得到世界重视和解决的公共卫生问题[2]。目前,国内外主要用中枢兴奋性药物和镇静催眠药物治疗SD,但因不良反应大、对神经系统造成不良影响而使这些药物临床应用受限[3]。中医药防治睡眠障碍历史悠久且疗效显著[4],中医认为阴虚火旺、阴不敛阳、实火扰心等为失眠症主要病机[5],以清热泻火、滋阴安神的药物治疗失眠已获得一定疗效[6]。中医经验方-补阴益智汤配方颗粒(Buyin Yizhi Tang Dispensing Granule,BYT)由女贞子、墨旱莲、栀子、黄芩、甘草组成,可滋阴凉血、清热除烦、补益肝肾,对肝肾阴虚、心烦不眠等疗效较好。近来研究发现BYT对东莨菪碱所致小鼠记忆损伤有保护作用[7],基于以上推测BYT亦可能对SD所致学习记忆下降有一定改善作用。因此建立小鼠SD模型,对此进行验证并初步探讨其作用机制,以期为临床合理用药及中医药开发应用提供参考。
1 材料与方法
1.1 材料
1.1.1 动物 无特定病原体(Specific Pathogen Free,SPF)级ICR雄性小鼠4周龄,体质量18~22 g,由广东省医学实验动物中心提供,生产许可证号为SCXK(粤)2018-0002。所有小鼠于本院动物房中常规饲养。本试验经本院伦理委员会批准[伦理审批号:IACUC-01(2020317)],试验动物符合3R原则。
1.1.2 药物 补阴益智汤配方:墨旱莲20 g、女贞子20 g、栀子10 g、黄芩10 g、甘草5 g,药材均购自本地中药房,用8倍体积纯净水浸泡后投入中药药液浓缩机中进行浓缩,至终浓度为2 g/mL;地西泮片(山西昂生药业有限责任公司,生产批号:20180219)。
1.1.3 试剂与仪器 TUNEL细胞凋亡检测试剂盒(北京索莱宝科技有限公司,货号:T2190,);5-羟色胺(5-Hydroxytryptamine,5-HT)酶联免疫吸附试验(Enzyme-linked Immunosorbent Assay,ELISA)试剂盒(武汉纯度生物科技有限公司,货号:CD-102334-ELA,);谷氨酸(Glutamate,Glu)ELISA试剂盒(上海羽朵生物科技有限公司,货号:YEF16367,);蛋白激酶A-催化亚基β(Protein Kinase A-catalytic Subunit Beta,PKA-Cβ)抗体、cAMP反应元件结合蛋白(cAMP Rresponse Element Binding Protein,CREB)及磷酸化CREB(P-CREB)抗体、原肌球蛋白受体激酶(Tropomyosin Receptor KinaseB,TrkB)抗体、神经细胞凋亡相关通路配体蛋白(Wnt)抗体、β-连环素抗体、β-半乳糖苷酶(β-galactosidase,β-gal)抗体(美国abcam公司,美国,货号分别为:ab5815、ab32515、ab32096、ab187041、ab109222、ab32572、ab240038);BCA蛋白定量试剂盒(美国Pierce公司,美国,货号:P0768)。手动轮转式切片机(德国Leica公司,德国,型号:RM2125RTS);光学显微镜(日本尼康公司,日本,型号:SMZ745);蛋白电泳仪、半干转膜仪(美国Bio-Rad公司,美国,型号:1659001、Trans-Blot SD)等。
1.2 方法
1.2.1 分组与模型制备 将60只小鼠用随机数字表法分为正常对照组、模型组、BYT低剂量组(6 g/kg)、BYT中剂量组(12 g/kg)、BYT高剂量组(18 g/kg)、阳性对照组(地西泮0.9 mg/kg),每组10只。除正常对照组外,其余组小鼠均参照文献[8]建立SD模型:取SD箱,使小鼠在剥夺箱内自由活动、进食和饮水,在靠近鼠笼底部装有一个长方形的金属杆,设置金属杆的拨动间隔为30 s,剥夺90 min,休息15 min;当拨杆从鼠笼的一端匀速移动到另一端时,小鼠需要跨过金属杆才可以继续活动。如果小鼠睡着,金属杆拨动就会对小鼠产生触觉刺激,唤醒小鼠,阻止睡眠,共给予剥夺21 d。21 d后,观察小鼠行为状态,若小鼠出现狂躁及尖叫行为,且毛色枯暗现象表明造模成功。正常对照组在正常条件下持续光照黑暗各12 h模拟正常睡眠。
1.2.2 给药方法 各组均于造模成功后开始给药,BYT参照文献[7]用生理盐水配制成0.6、1.2、1.8 mg/mL的溶液,地西泮参照文献[9]用生理盐水配制成0.09 mg/mL溶液,均按10 mL/kg的剂量灌胃给药,正常对照组及模型组等剂量灌胃生理盐水。连续给药21 d,1次/d。
1.2.3 检测指标与方法
1.2.3.1 小鼠一般行为观察 各组小鼠给药期间,每日观察并记录包括毛发、精神、饮食在内的一般状态。
1.2.3.2 Morris水迷宫实验 各组小鼠末次灌胃给药结束后30 min,参照文献[10]进行Morris水迷宫实验。具体操作方法为:设置水迷宫直径1 m,平台直径9 cm,水温保持23 ℃。训练阶段,把小鼠面朝池壁随机从4个象限放入水中,让其自由游泳60 s,找到平台停留20 s,记录小鼠找到并爬上平台的时间即为逃逸潜伏期;如果小鼠在60 s内未找到平台,则由实验人员引导其找到平台,在平台停留20 s,逃逸潜伏期记为60 s。每次训练结束后擦干小鼠,送回鼠笼休息60 s后,进行下一次训练,共训练12次,取9~12次的平均值进行计算。上述训练结束后第2 d进行空间探索测试,具体操作方法为:撤掉平台,从离平台最远点将小鼠放入水池,视频记录小鼠60 s内穿越平台次数。
1.2.3.3 小鼠入睡潜伏期及持续时间检测 各组小鼠在1.2.3.2实验后,经腹腔注射戊巴比妥钠50 mg/kg,以翻正反射消失和重新出现为标准,记录小鼠入睡潜伏期及持续时间。
1.2.3.4 标本采集 各组小鼠在1.2.3.3检测后,经尾静脉取血3 mL,于3 000 r/min条件下离心5 min(离心半径为5 cm)后取血清,置于-20 ℃条件下保存备用。立即断头处死小鼠,解剖取小鼠海马组织,剪取0.5 g海马组织置于-80 ℃冰箱保存,剩余海马组织迅速置于4%多聚甲醛溶液中固定24 h备用。
1.2.3.5 TUNEL染色观察海马组织神经细胞凋亡情况 取1.2.3.4项下4%多聚甲醛溶液中固定24 h的海马组织,经脱水、透明、石蜡包埋后切成4 μm切片,并经脱蜡、脱水、3%H2O2灭活,胃蛋白酶K孵育后添加TUNEL工作液37 ℃下湿盒中孵育1 h,随后封闭滴加转化剂-POD 50 μL/片,置37 ℃下湿盒中孵育10 min,0.01MPBS洗涤后滴加二氨基联苯胺(3,3′-diaminobenzidine,DAB)底物孵育15 min后苏木精复染50 s后常规脱水、透明、封片。在共聚焦显微镜下观察切片中神经细胞凋亡情况(细胞核染成棕褐色颗粒者为凋亡细胞),细胞凋亡率=凋亡细胞数/细胞总数×100%。
1.2.3.6 血清5-HT及Glu水平检测 取1.2.3.4项下-20 ℃冰箱保存的血清标本,4 ℃条件下解冻后,按ELISA试剂盒说明书方法检测血清5-HT及Glu水平。
1.2.3.7 蛋白质免疫印迹法检测海马组织PKA-Cβ、P-CREB、CREB、Trk B、Wnt、β-连环素、β-gal蛋白相对表达水平 取1.2.3.3中-80 ℃保存的海马组织,匀浆后取上清液,用蛋白提取试剂盒提取蛋白,二喹啉甲酸(Bicinchoninic Acid,BCA)试剂盒检测蛋白总浓度。取50 μg蛋白上样,进行电泳和转膜反应,洗涤缓冲液(Tris Buffered Saline Tween,TBST)溶液清洗后,加入5%脱脂牛奶室温下封闭1 h,TBST溶液清洗3次后,加入一抗[PKA-Cβ、P-CREB、CREB、Trk B、Wnt、β-连环素、β-gal、β-肌动蛋白(内参)]抗体,稀释倍数除内参抗体为1∶2 000外,其余均为1∶1 000,4 ℃摇床室温孵育过夜,TBST振洗后加入辣根过氧化物酶(Horseradish Peroxidase,HRP)羊抗兔二抗(稀释倍数1∶2 000),37 ℃摇床室温孵育1 h,TBST清洗3次后,采用增强化学发光法显色,以化学发光仪观察条带并拍照,并以Image-J软件分析各组蛋白相对表达水平。
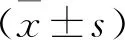
2 结果
2.1 各组小鼠一般状态 正常对照组小鼠行为活动正常,毛色光泽柔顺;与正常对照组比较,模型组小鼠摄食量减少,毛发脏乱无光泽,精神萎靡,活动减少,反应迟钝,抓取时出现尖叫、狂躁行为;与模型组比较,BYT各剂量组饮食正常,活动增多,抓取时尖叫、狂躁行为减少。
2.2 各组小鼠Morris水迷宫实验逃逸潜伏期、穿越平台次数比较 与正常对照组比较,模型组小鼠逃逸潜伏期增加,穿越平台次数减少,学习记忆能力降低(P<0.05);与模型组比较,BYT低剂量组、BYT中剂量组、BYT高剂量组及阳性对照组小鼠学习记忆能力升高(P<0.05),BYT中剂量组、BYT高剂量组及阳性对照组比较学习记忆能力差异无统计学意义(P>0.05)。见表1。
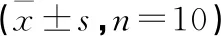
表1 各组小鼠Morris水迷宫实验逃逸潜伏期、穿越平台次数比较
2.3 各组小鼠入睡潜伏期及持续时间比较 与正常对照组比较,模型组小鼠入睡潜伏期增加,睡眠持续时间减少,睡眠质量降低(P<0.05);与模型组比较,BYT低剂量组、BYT中剂量组、BYT高剂量组及阳性对照组睡眠质量升高(P<0.05),BYT中剂量组、BYT高剂量组及阳性对照组比较睡眠质量差异无统计学意义(P>0.05)。见表2。
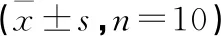
表2 各组小鼠入睡潜伏期及持续时间比较
2.4 各组小鼠血清5-HT及Glu等神经递质水平比较 与正常对照组比较,模型组小鼠血清Glu水平增加,5-HT水平减少,神经递质水平异常(P<0.05);与模型组比较,BYT低剂量组、BYT中剂量组、BYT高剂量组及阳性对照组小鼠神经递质水平趋于正常(P<0.05),BYT中剂量组、BYT高剂量组及阳性对照组神经递质水平差异无统计学意义(P>0.05)。见表3。
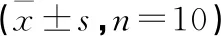
表3 各组小鼠血清5-HT及Glu等神经递质水平比较
2.5 各组小鼠海马神经细胞凋亡率比较 海马神经细胞被染成棕褐色的为凋亡细胞,正常对照组小鼠海马神经细胞染色正常。与正常对照组比较,模型组小鼠海马神经细胞核固缩且染色较深,神经细胞凋亡率增高(P<0.05),与模型组比较,BYT低剂量组、BYT中剂量组、BYT高剂量组及阳性对照组小鼠细胞核染色较浅,神经细胞凋亡率降低(P<0.05),BYT中剂量组、BYT高剂量组及阳性对照组比较海马神经细胞凋亡率差异无统计学意义(P>0.05)。见图1,表4。
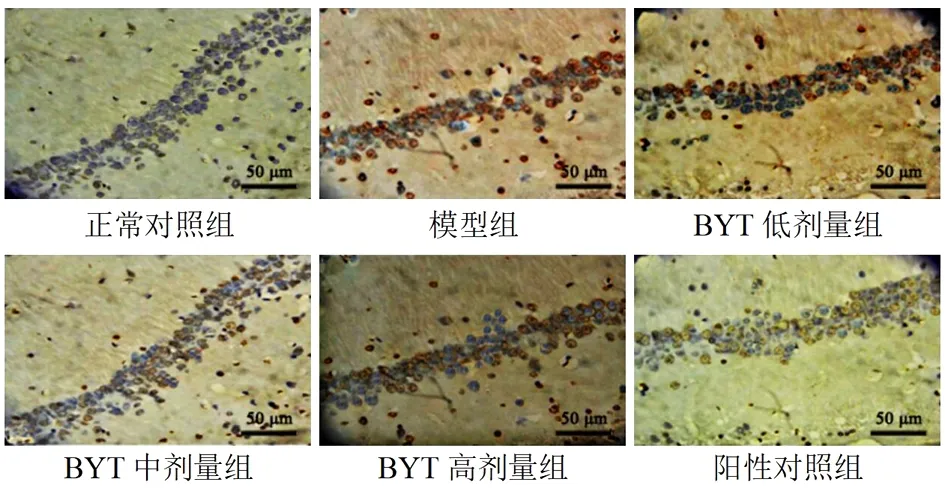
图1 各组小鼠海马组织(TUNEL染色,×400)
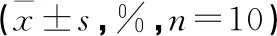
表4 各组小鼠海马神经细胞凋亡率比较
2.6 各组小鼠海马组织PKA-Cβ、P-CREB/CREB、Trk B蛋白表达比较 与正常对照组比较,模型组小鼠海马组织PKA-Cβ、P-CREB/CREB、Trk B蛋白表达减少(P<0.05);与模型组比较,BYT低剂量组、BYT中剂量组、BYT高剂量组及阳性对照组小鼠海马组织PKA-Cβ、P-CREB/CREB、Trk B蛋白表达升高(P<0.05),BYT中剂量组、BYT高剂量组及阳性对照组比较PKA-Cβ、P-CREB/CREB、Trk B蛋白表达差异无统计学意义(P>0.05)。见图2,表5。

图2 各组小鼠海马组织PKA-Cβ、P-CREB/CREB、TrkB蛋白表达免疫印迹图
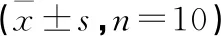
表5 各组小鼠海马组织PKA-Cβ、P-CREB/CREB、Trk B蛋白表达比较
2.7 各组小鼠海马组织Wnt、β-连环素、β-gal蛋白表达比较 与正常对照组比较,模型组小鼠海马组织Wnt、β-连环素、β-gal蛋白表达减少(P<0.05);与模型组比较,BYT低剂量组、BYT中剂量组、BYT高剂量组及阳性对照组小鼠海马组织Wnt、β-连环素、β-gal蛋白表达升高(P<0.05),BYT中剂量组、BYT高剂量组及阳性对照组比较Wnt、β-连环素、β-gal蛋白表达差异无统计学意义(P>0.05)。见图3,表6。

图3 各组小鼠海马组织Wnt、β-连环素、β-gal蛋白表达免疫印迹图
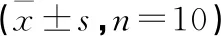
表6 各组小鼠海马组织Wnt、β-连环素、β-gal蛋白表达比较
3 讨论
睡眠可缓解疲劳、巩固和改善学习记忆、提高机体免疫力[11]。刘陶等[8]发现,SD 3周可造成小鼠学习过程减慢及空间记忆能力受损。为模拟人类长期睡眠不足模型,本研究用SD箱给予小鼠3周SD,发现模型组小鼠活动减少、反应迟钝且狂躁,学习记忆能力下降,提示SD3周后,小鼠学习过程减慢及空间记忆能力受损,表明造模成功。海马与学习记忆有关,对睡眠丧失特别敏感,若海马体受到大范围损伤,会引起记忆丧失[12]。本研究发现SD模型小鼠海马组织神经细胞凋亡率高于正常对照组,可能与学习记忆功能下降关系密切。另外,学习记忆功能维持离不开中枢神经系统递质的参与。兴奋性神经递质Glu不仅参与学习记忆传导过程[13],还参与睡眠觉醒、总睡眠时间与慢波睡眠的维持过程[14];5-HT水平增高或降低均会损害学习记忆活动[15],且5-HT参与非快速眼动睡眠的维持过程[16]。本研究发现SD小鼠血清Glu水平及入睡潜伏期升高,5-HT水平及睡眠维持时间降低,预示SD小鼠神经递质释放异常、睡眠质量较差可能与学习记忆力下降关系密切。
中医将睡眠障碍归属为“不寐”“不得眠”,认为“寐本乎阴,神其主也,神安则寐,神不安则不寐”[17],并认为“心藏神,脑为元神之腑”“人之记忆,皆在脑中,小儿善忘者,脑未满也;老人健忘者,脑渐空也”提示心神与脑神息息相关,“一处神明伤,两处皆伤”暗示睡眠不足心主血脉功能不调,会累及脑功能及记忆受损[17]。火热之邪、上扰心神为失眠的病因,中医验方BYT中女贞子可去燥火,现代药理发现其可用于治疗神经炎、神经衰弱等症[18];墨旱莲可滋补肝肾、凉血止血,与女贞子合用其滋阴效果较好,治疗肝肾阴虚火旺症;栀子可清热泻火、凉血、除烦而治疗火热上炎虚烦不眠;黄芩清热燥湿,泻火解毒,其善清中上焦湿热除烦渴,为清热佳品,甘草除调和药味外,也可清热解毒,方中诸药配伍可清心、肝、肺、肾脏腑之热,滋阴凉血、降虚火而助眠,且在本科室用于治疗顽固性失眠,并取得较好疗效。本研究发现BYT治疗后,SD小鼠精神萎靡、反应迟钝及狂躁等减轻,空间记忆学习能力提高,海马神经细胞凋亡率、神经递质释放趋于正常,睡眠质量提高,提示BYT可能通过减少海马神经细胞凋亡,调节神经递质释放,来改善SD小鼠学习记忆能力及睡眠质量。这为BYT的开发应用提供了一定参考,但其具体分子生物学机制还不甚清楚,本研究对此进行继续探究。
学习记忆过程中,突触可塑性及学习、记忆相关的PKA-Cβ入核后可使CREB磷酸化,通过与cAMP反应元件结合,调节神经营养因子等多种基因转录和表达,进而调控神经活动的传导、神经细胞及突触的生长、分化、再生及记忆的整合、维持[19]。另外脑源性神经营养因子(Brain Derived Neurotrophic Factor,BDNF)与TrkB结合,可调控突触联系,使获得的记忆片段得以长期储存[20]。本研究中SD小鼠海马组织中PKA-Cβ、P-CREB/CREB、TrkB蛋白表达明显低于正常对照组,预示PKA-Cβ/CREB/TrkB通路的衰减可能与SD小鼠学习记忆下降关系密切。Wnt可介导中枢神经系统海马神经的再生,研究证实Wnt激活后,β-连环素可与转录因子复合体结合,驱动β-gal表达,促进海马新生神经细胞新生并增加其数量,改善动物的学习记忆障碍[21-22]。本研究发现模型组小鼠海马组织中Wnt、β-连环素及β-gal表达明显降低,推测Wnt/β-连环素/β-gal通路抑制可能降低了海马神经新生,可能为SD小鼠学习记忆功能降低的机制之一。而BYT低剂量组、BYT中剂量组、BYT高剂量组及阳性药组小鼠海马组织中学习记忆信号通路PKA-Cβ/CREB/TrkB及海马神经细胞再生信号通路Wnt/β-连环素蛋白表达均明显升高,表明BYT可能通过激活PKA-Cβ/CREB/TrkB信号通路及Wnt/β-连环素/β-gal信号通路蛋白表达,改善SD小鼠学习记忆功能。
综上所述,BYT可调节神经递质释放,改善SD小鼠睡眠质量及学习记忆能力,可能通过激活PKA-Cβ/CREB/TrkB信号通路及Wnt/β-连环素/β-gal信号通路蛋白表达实现。但睡眠不足引起学习记忆损伤机制复杂,可能涉及其他机制共同参与,另外Wnt/β-连环素/β-gal神经细胞新生与学习记忆相关通路之间的联系也需要继续研究。
