鸡血多肽亚铁螯合物的制备工艺优化及结构表征
2022-02-06马晶晶徐为民王道营
杨 静, 石 景, 邹 烨, 杨 彪, 马晶晶, 徐为民, 王道营
(1.江苏省农业科学院农产品加工研究所,江苏南京210014;2.南京农业大学食品科技学院,江苏南京210095)
中国是世界肉鸡养殖和消费大国,随着居民消费意识的转变,肉鸡屠宰量持续攀升,鸡血资源十分丰富。鸡血中的蛋白质含量与禽肉接近,必需氨基酸含量高,是制备活性肽等深加工产品的优质原料。然而目前国内的鸡血主要用于制备血球蛋白粉和血浆蛋白粉等初加工产品,对鸡血蛋白的利用还存在一定局限,造成了鸡血中蛋白质资源的浪费。因此,开展畜禽血深加工研究、研发高附加值和高蛋白质利用率的产品成为副产物研究领域的热点。
铁是一种人体必需的微量金属元素,长期缺铁会影响红细胞代谢,降低人体免疫力,进而引发贫血等多种缺铁性疾病,2020年《中国居民营养与慢性病状况调查报告》显示,中国成年人贫血率为8.7%,孕妇贫血率为 13.6%[1]。口服补铁剂可有效改善贫血,但硫酸亚铁、琥珀酸亚铁等目前常见补铁剂的生物利用率较低,且长期食用会导致胃肠道不适[2],因此亟需开发一种新型铁补充剂来改善这一问题。研究发现,肽与亚铁离子形成的螯合物可以有效防止亚铁离子在胃肠道中受到植酸等膳食成分的影响,具有生物利用率高、稳定性好、毒副作用少等优点[3-4],还具有良好的耐酸碱性、耐盐性[5],使其在较低的补给量下即可达到补充效果。由此可见,利用多肽制备多肽亚铁螯合物是当前制备铁补充剂的一种重要方法[6]。
虽然中国鸡血资源丰富,但是利用率低,而且关于鸡血肽亚铁的研究较少。因此,本研究以鸡血为原料,提取鸡血多肽,通过单因素及响应面法优化鸡血多肽亚铁的制备工艺,并对其螯合前后的结构进行表征,以期为新型补铁剂的开发和畜禽血的高值化利用奠定基础。
1 材料与方法
1.1 材料与试剂
新鲜鸡血由江苏立华牧业有限公司提供;无水乙醇、FeCl2·4H2O、乙酸钠、冰乙酸等试剂为分析纯,购自国药集团化学试剂有限公司。
1.2 仪器与设备
荧光分光光度计(FL-4600),购自日本日立技术有限公司;傅里叶变换红外光谱仪(Nicolet iS50),购自美国Thermo Fisher Scientific公司;离心机(Centrifuge|5810R),购自德国Eppendorf公司;扫描电子显微镜(EVO-LS10),购自德国ZEISS公司;真空冷冻干燥机,购自德国Christ公司。
1.3 试验方法
1.3.1 鸡血多肽的提取 将新鲜抗凝鸡血除杂后,于1 000g离心15 min,收集沉淀并加入5倍体积的去离子水,匀质化处理40 min后,将溶液置于管式离心机中,于3 000g离心10 min,收集上清。参照Yang等[7]的方法进行酶解,酶解反应结束后于3 000g离心10 min,收集上清液,获得鸡血多肽,冷冻干燥后备用。
1.3.2 鸡血多肽亚铁螯合物的制备 工艺路线:将多肽溶液水浴加热至需要温度→用0.1 mol/L NaOH、0.1 mol/L HCl溶液调节pH值→加入适量FeCl2·4H2O→搅拌加热→用旋转蒸发仪于50~55 ℃浓缩→用9倍体积的无水乙醇处理(为了使多肽亚铁螯合物在溶液中形成沉淀,便于后续通过离心使其和多肽、盐溶液分离)后静置2 h→离心(10 000g,10 min)→冷冻干燥→鸡血多肽铁螯合物。
研究表明,MCS是暴雨的直接影响系统,梅雨锋对MCS的发生发展有组织作用(赵玉春,2011)。卫星TBB资料(图略)分析表明,整个暴雨过程有多个MCS活动,那么此次暴雨过程的MCS的活动和组织方式是怎样的?下面利用江苏和安徽地区13部多普勒雷达拼图进行分析,这里主要关注东部降水区在降水发展阶段MCS的组织特征。
1.3.2.1 单因素试验 为了考察不同因素的最适条件,以亚铁螯合率为指标,在其他条件相同的情况下,分别研究不同肽铁质量比(2∶1、4∶1、6∶1、8∶1、10∶1)、pH值(3、4、5、6、7)、温度(20 ℃、30 ℃、40 ℃、50 ℃、60 ℃)、螯合时间(10 min、20 min、30 min、40 min、50 min、60 min)对鸡血多肽亚铁螯合率的影响。
1.3.2.2 响应曲面法优化鸡血多肽亚铁螯合物工艺 用SPSS软件对单因素试验结果进行分析,用Design expert 12 Box-Behnken中心组合试验方法选择对鸡血多肽亚铁螯合率影响较大的3个因素进行试验,对鸡血多肽亚铁的螯合工艺进行优化、验证。
1.3.3 亚铁螯合率的测定 采用改进的乙醇沉淀法测定鸡血多肽亚铁螯合率[8-9],样品中总铁含量的测定采用火焰原子吸收光谱法[5]。鸡血多肽亚铁螯合率计算公式如下:

式中:M1为待测样品中的总铁含量;M2为待测样品上清液中的铁离子含量。
1.3.4 氨基酸组成分析 取适量冻干样品,首先用盐酸真空水解,并在样品上样前用0.45 μm滤膜过滤除杂,再用氨基酸自动分析仪进行测定。
1.3.5 表征分析
1.3.5.1 鸡血多肽和鸡血多肽亚铁螯合物的紫外光谱分析 鸡血多肽及其亚铁螯合物用超纯水溶解并进行梯度稀释至50 μg/ml后过0.45 μm水系滤膜,在波长范围190~400 nm、扫描间隔1 nm的条件下采用紫外分光光度计进行扫描。
1.3.5.2 荧光光谱分析 利用荧光分光光度计FL-4600在发射波长295~500 nm、激发波长280 nm的条件下,按照扫描速度300 nm/min、步长2 nm、狭缝宽度10 nm测定样品的荧光性能,获得荧光光谱。
1.3.5.3 傅里叶变换红外光谱(FTIR)扫描 分别将鸡血多肽及其亚铁螯合物样品放入红外光谱仪测定台上进行扫描,扫描条件:波数为4 000~525 cm-1,次数为32次,分辨率为4 cm-1,获得样品的FTIR谱图。
1.3.5.4 扫描电镜分析 取适量样品冻干粉,均匀地涂抹于样盘双面胶上,经喷金镀膜处理后,在加速电压为15 kV的扫描电镜下观察样品放大1 500倍、10 000倍后的微观结构,获取样品表面的扫描图像。
1.4 统计分析
响应面设计和分析用软件Design Expert进行,其他试验结果用软件SPSS 16进行统计分析。
2 结果与分析
2.1 鸡血多肽亚铁螯合物制备的单因素试验结果
如图1a所示,当溶液pH值为3~7时,随着反应溶液pH值的升高,鸡血多肽亚铁螯合率呈先上升后下降的趋势,在pH值为5时出现拐点,这是由于当溶液的pH值较低时,H+含量高,与Fe2+形成竞争,导致多肽与Fe2+的螯合能力降低[10]。当反应溶液的pH值高于5时,反应体系中的OH-可以与Fe2+结合形成沉淀[11],致使溶液中Fe2+浓度降低,不利于螯合反应的进行,因此选取pH值=5作为响应面试验的中心点。
由图1b可以看出,在20~60 ℃,鸡血多肽亚铁的螯合率先升高后降低,螯合率最高时的温度为40 ℃,这可能是由于温度升高能够加快Fe2+与多肽分子间的碰撞,使螯合率提高。当温度继续升高时,螯合率逐渐下降,温度为40 ℃时的螯合率与温度为50 ℃时的螯合率差异不显著,但与温度为60 ℃时的螯合率差异显著。这可能是由于螯合反应为放热反应,当反应温度超过其适宜温度时,会在一定程度上阻止放热反应的进行,从而使螯合率降低[12]。因此,选择40 ℃进行后续试验。
由图1c可以看出,随反应时间的延长,鸡血多肽亚铁螯合率呈提高的趋势,当螯合时间不超过30 min时,鸡血多肽与亚铁离子的螯合率快速提高;当螯合时间超过30 min后,螯合率持续提高,但差异不显著。因此,为了提高螯合效率,选择螯合时间为30 min作为进行后续响应面试验的中心点。
由图1d可以看出,随着肽铁质量比的提高,鸡血多肽与亚铁离子的螯合率也随之升高,当肽铁质量比提高至6∶1以上时,螯合率虽继续升高但差异不显著,出现该现象的原因可能是由于当肽铁质量比较低时,肽量不足导致Fe2+过剩,因此螯合率随着肽含量的增加而提高,当肽铁质量比过大时多肽易形成聚集,使多肽利用率降低[13]。因此,选择肽铁质量比6∶1用于后续工艺优化。
2.2 响应面试验结果
2.2.1 响应面试验设计及结果 根据单因素试验结果,按照中心组合设计原理选取肽铁质量比、螯合时间、pH值为自变量进行响应面分析,试验设计及结果见表1。
根据试验结果进行多项回归分析,建立多肽亚铁螯合率(Y)对肽铁质量比(A)、时间(B)和pH值(C)的二次回归模拟方程:
Y=72.250 0+4.110 0A+1.770 0B+1.280 0C+1.000 0AB+0.433 8AC+0.219 5BC-6.530 0A2-4.200 0B2-3.670 0C2

由表2可知,模型的一次项均对多肽亚铁螯合率具有极显著影响。分析各因子之间的交互作用可知,在试验设计的因素范围内,对鸡血多肽亚铁螯合率影响最大的交互作用因素是因素A(肽铁质量比)和因素B(螯合时间)。图2的响应面等高线接近椭圆,表示交互作用显著,图2与表2结果一致。

a:pH值的影响;b:温度的影响;c:时间的影响;d:肽铁比的影响。不同处理间标有不同小写字母表示差异显著(P<0.05)。图1 单因素对多肽亚铁螯合率的影响Fig.1 Effects of factors on the chelating rate of iron-peptide
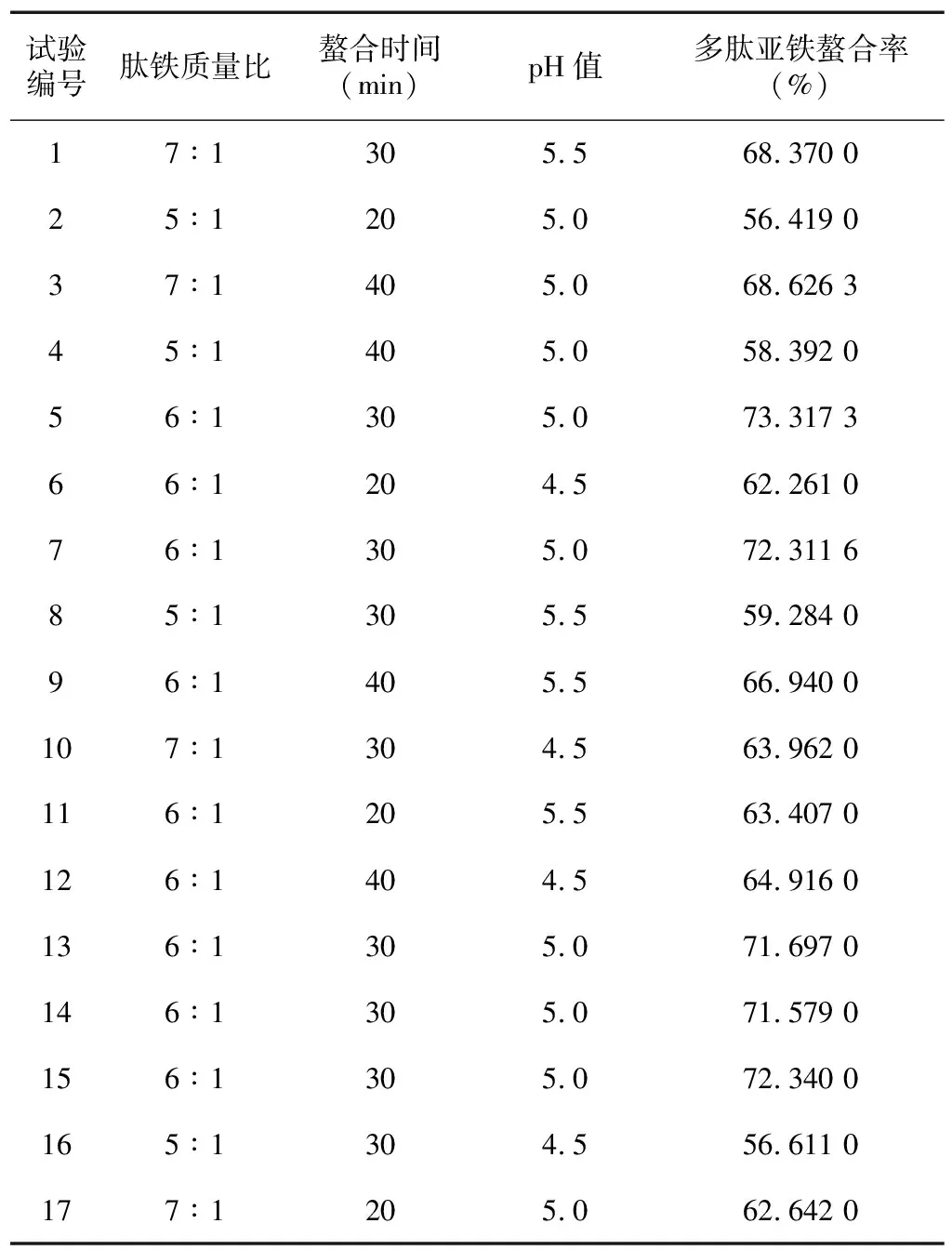
表1 响应面试验设计及结果

表2 二次回归模型的方差分析结果

图2 反应时间和肽铁质量比交互作用对鸡血多肽亚铁螯合率的影响Fig.2 Effects of interaction between reaction time and peptide-iron mass ratio on chelating rate
2.2.2 响应面试验优化及验证 根据预测模型,对响应曲面结果进行最优化分析,预测的最佳螯合工艺条件:肽铁质量比6.34∶1.00,螯合时间32.57 min,pH值5.1,此时鸡血多肽亚铁螯合率的理论值为73.03%。为了便于操作,将螯合条件修正为肽铁质量比6.3∶1.0、螯合时间30 min、pH值5.1进行3次验证试验,实际多肽亚铁螯合率为73.27%±2.54%。通过统计分析发现,预测值与试验值之间的差异不显著,说明本试验采用的鸡血多肽亚铁制备工艺可靠。
2.3 氨基酸组成分析
表3结果显示,鸡血多肽、鸡血多肽亚铁螯合物中的必需氨基酸含量分别为37.24%、29.43%,均具有较高的营养价值,但在鸡血多肽螯合前后,氨基酸组成有明显差异,螯合反应后的氨基酸总量由螯合前的87.15%降至65.43%,这与Lee等[14-15]的研究结果相似。鸡血多肽和鸡血多肽亚铁螯合物中均富含谷氨酸、赖氨酸和天冬氨酸,其中天冬氨酸、谷氨酸为带负电荷的极性氨基酸,鸡血多肽亚铁螯合物中这2种氨基酸的含量接近30%。对比分析鸡血多肽和鸡血多肽亚铁螯合物中的氨基酸含量发现,鸡血多肽亚铁螯合物中谷氨酸、组氨酸及天冬氨酸含量明显提高,说明这3种氨基酸与Fe2+的螯合能力较强。已有研究发现,这可能是由于谷氨酸的羧基、组氨酸的咪唑氮、巯基及天冬氨酸的羧基等官能团和残基有助于促进肽和Fe2+的螯合[16-18]。此外,螯合物中的半胱氨酸、丝氨酸含量也有所提高,这可能是由于半胱氨酸的硫醇基[19]及丝氨酸中的羟基和巯基残基也能够提供与Fe2+结合的螯合位点[20]。
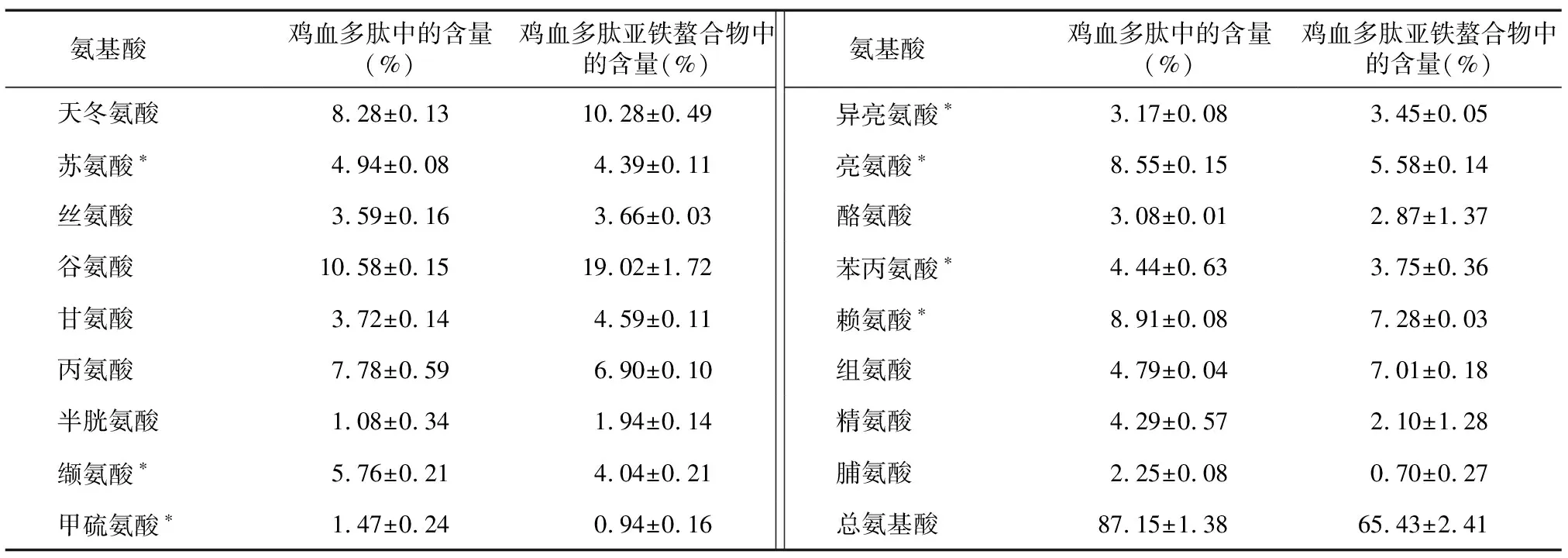
表3 多肽与螯合物的氨基酸组成
2.4 结构表征
2.4.1 紫外光谱分析 多肽与金属元素螯合时,多肽中的某些生色基或助色基与金属离子发生键合,导致出现新的紫外吸收峰,或原有特征峰移动以及消失[21],因此可以通过对比紫外吸收光谱的出峰位置、强度来判断鸡血多肽和亚铁之间是否发生了螯合反应。由图3可以看出,鸡血多肽及其亚铁螯合物的紫外吸收光谱明显不同,鸡血多肽的最大吸收峰在195 nm处,其与亚铁螯合后的最大吸收峰蓝移至191 nm处,且螯合物的紫外吸收强度显著低于多肽,表现为减色效应,表明多肽中的酰胺键参与了螯合反应,使多肽中的发色或助色基团发生了偏振[22]。多肽及其亚铁螯合物均在260 nm附近出现的1个弱吸收峰是芳香族氨基酸的特征紫外吸收峰;鸡血多肽亚铁螯合物在此处的紫外吸收强度高于多肽,可能是由于多肽和铁离子结合造成电子跃迁引起的,因此推测鸡血多肽与Fe2+发生了螯合反应。对猪骨胶原肽-钙[23]和海参卵肽-亚铁[24]的研究也呈现了相似的紫外光谱。

图3 鸡血多肽及鸡血多肽亚铁螯合物的紫外扫描结果Fig.3 Ultraviolet absorption spectrum of chicken peptide and peptide-iron chelate
2.4.2 荧光光谱分析 荧光光谱可以反映有机物的分子结构变化[25],Cai等[22]研究发现,当多肽结构发生变化时,其荧光性能也会随之发生改变。如图4所示,当鸡血多肽与Fe2+螯合后,吸收峰由358 nm移动至353 nm,荧光强度也显著下降,出现明显的荧光淬灭。可能由于加入Fe2+后,多肽中的芳香氨基酸与Fe2+发生螯合反应,使多肽的分子结构发生变化,导致暴露的荧光残基减少,进而降低荧光强度。因此从荧光光谱结果看出,鸡血多肽与Fe2+结合形成了新物质。

图4 鸡血多肽及鸡血多肽亚铁螯合物的荧光光谱Fig.4 Fluorescence spectra of chicken peptide and peptide-iron chelate
2.4.3 红外光谱分析 FTIR特征吸收峰的变化可以反映多肽中某些特征官能团的改变[26],由图5可以看出,多肽的特征吸收峰位于3 080 cm-1附近,鸡血多肽及其亚铁螯合物分别在2 956.83 cm-1、2 970.56 cm-1处有明显吸收峰,说明二者均具有一般多肽的特征官能团;鸡血多肽中的C=O、C-N吸收峰分别位于1 640 cm-1、1 515 cm-1,鸡血多肽与亚铁螯合后,C=O、C-N的吸收峰分别位移到1 646 cm-1、1 541 cm-1。鸡血多肽在1 389.68 cm-1处出现-COOH的伸缩振动,从而出现特征吸收峰,与Fe2+螯合后,螯合物的吸收峰发生明显位移,蓝移至1 405.21 cm-1,在指纹区,对比多肽及其亚铁螯合物可以发现多个吸收峰发生了变化,这些变化可能是由C-H、N-H键的弯曲振动引起的。通过红外光谱分析,推测鸡血多肽中的-COOH、C=O、C-N参与了螯合反应。

图5 鸡血多肽及鸡血多肽亚铁螯合物的红外光谱结果Fig.5 Infrared spectral results of chicken peptide and peptide-iron chelate
2.4.4 扫描电镜分析 图6显示,鸡血多肽及其亚铁螯合物在扫描电子显微镜下分别放大1 500倍、10 000倍后,二者的表面结构明显不同,鸡血多肽表面为光滑的片状结构,与Chen等[27]制备的罗非鱼肽结构相似,而鸡血多肽与Fe2+螯合后,呈现聚集状态,表面粗糙并形成了排列紧密的团状颗粒结构。太平洋鳕鱼骨多肽与钙离子螯合后,结构也由片状变为紧密排列的球形颗粒状[28]。由扫描电镜结果的差异看出,螯合反应改变了鸡血多肽原有的结构,使多肽和Fe2+发生交联聚集,表面形成紧密的颗粒结构。

图6 鸡血多肽及其亚铁螯合物的扫描电镜结果Fig.6 Scanning electron micrograph of chicken peptide and peptide-iron chelate
3 讨论
缺铁性贫血是比较常见的营养性疾病之一,有研究发现,多肽螯合铁作为一种新型的食源性补铁剂能有效增加铁元素的摄入,具有稳定性好、安全性高等优点[4-5]。鸡血是禽类加工常见的副产物,可以通过水解提取其中的多肽。鸡血肽与Fe2+螯合后,不仅提高了鸡血的附加值和利用率,还使鸡血具有多种生理功能。鸡血原料价格低廉且易于获取,螯合反应技术路线易于实现鸡血产品的工业化生产。
本研究通过对鸡血多肽及其亚铁螯合物氨基酸成分进行对比分析,推测了氨基酸种类与鸡血多肽亚铁螯合活性间的关系,但是不能明确,需通过进一步试验加以验证。通过紫外、荧光、红外等表征光谱分析,鸡血多肽与Fe2+可通过羧基、酰胺基和氨基等多种方式进行结合,扫描电镜结果表明,鸡血多肽及其亚铁螯合物的结构不同,但鸡血多肽与Fe2+具体结合模式及鸡血多肽亚铁螯合物在人体内的吸收效率需要进一步研究。
4 结论
本研究通过酶解从鸡血中提取多肽,以鸡血多肽、FeCl2·4H2O作为原料,将二者结合得到鸡血多肽亚铁螯合物。通过分析不同因素对鸡血多肽亚铁螯合率的影响,明确影响其螯合率的主要因素,并优化了鸡血多肽亚铁螯合物的制备条件,通过单因素和响应面试验确定制备鸡血多肽亚铁螯合物的最佳工艺参数:螯合时间为30 min,反应pH值为5.1,鸡血多肽与FeCl2·4H2O的质量比为6.3∶1.0,在此条件下的螯合率为73.27%。
进一步对螯合前后的氨基酸成分和表征进行分析发现,鸡血多肽中的谷氨酸、组氨酸、天冬氨酸、半胱氨酸和丝氨酸可能有助于促进鸡血多肽和Fe2+的螯合反应。紫外光谱和荧光光谱分析结果说明,螯合反应产生了鸡血多肽螯合物;红外光谱分析结果表明,鸡血多肽中的羧基、酰胺基和氨基可能以配位键结合的形式参与了螯合反应,形成新型的鸡血多肽亚铁螯合物。扫描电镜结果发现,鸡血多肽螯合Fe2+后,其结构发生了明显变化,鸡血多肽为表面光滑的片状结构,与Fe2+螯合后发生交联聚集,形成表面粗糙且排列紧密的颗粒结构。通过对制备鸡血多肽亚铁螯合物的工艺优化和鸡血多肽亚铁螯合物的表征分析,为畜禽血的综合利用和补铁原料的开发提供了理论基础,后续可开展对该螯合物的补铁功效及安全性评价研究。
