2种鹅星状病毒一步法双重RT-PCR检测方法的建立与应用
2022-02-06肖亦辰赵冬敏章丽娇刘青涛刘宇卓韩凯凯黄欣梅
杨 颖, 肖亦辰, 马 平, 赵冬敏, 章丽娇, 李 银, 刘青涛, 杨 婧, 刘宇卓, 韩凯凯, 黄欣梅
(1.江苏省农业科学院兽医研究所,江苏南京210014;2.农业农村部兽用生物制品工程技术重点实验室,江苏南京210014;3.国家兽用生物制品工程技术研究中心,江苏南京210014;4.南京农业大学动物医学院,江苏南京210095)
星状病毒(Astrovirus)是一种无囊膜,单股正链的RNA病毒,其基因组全长6.2~7.8 kb,包含ORF1a、ORF1b和ORF2 3个开放阅读框以及5′UTR、3′UTR和PolyA尾[1]。星状病毒科包括哺乳动物星状病毒属和禽星状病毒属2个属。哺乳动物星状病毒属可导致人、猪、牛、羊、猫和犬等多种哺乳动物患胃肠炎、脑膜炎和腹泻疾病[2-4]。禽星状病毒属可引起鸭致死性肝炎[5],鸡的发育不良综合征[6]、白鸡综合征[7]、火鸡的家禽肠炎死亡综合征[8]等。
Bidin等[9]从克罗地亚地区鹅群中分离到禽星状病毒属中的禽肾炎病毒(Avian nephritis virus, ANV),并证实该星状病毒在鹅场中普遍存在,可导致鹅胚胎发育障碍及孵化阶段死亡。Zhang等[10]从湖南省具有肠炎症状的雏鹅体内鉴定出1株鹅源星状病毒(Goose astrovirus, GoAstV)FLX株。基因序列分析结果表明,与禽星状病毒属其他成员相比,鹅星状病毒FLX株的基因组核苷酸同源性为51%~59%,3个开放阅读框的氨基酸同源性低于66%,是禽星状病毒属中新出现的一种鹅源星状病毒。2017年至2019年,有研究者从国内鹅群中分离到鹅源星状病毒SCCD株和AHDY株,遗传序列分析结果表明,SCCD株和AHDY株与FLX株编码衣壳蛋白的ORF2基因编码的蛋白质的氨基酸同源性为81%,遗传距离为0.189。国际病毒分类学委员会星状病毒研究小组规定,不同星状病毒毒株的ORF2基因编码氨基酸同源性若大于75%,可划分为同一星状病毒种,如果遗传距离大于0.05,ORF2基因核苷酸同源性小于93%,可定义为变异株,因此有学者将SCCD株和AHDY株定义为鹅星状病毒FLX株的变异株[11]。
2016年以来,中国主要养鹅地区陆续暴发一种以雏鹅肾炎和内脏、关节痛风为主要特征的急性传染病,死亡率为20.0%~50.0%,给中国养鹅产业造成的经济损失达1.2×109~1.5×109元[12]。多位研究者从具有痛风症状的雏鹅体内分离到一种新的星状病毒,包括GD、AHQJ18、SDPY、JSHA、CXZ18和SD01等毒株[13-18]。基因序列分析结果表明,这些从具有痛风症状的雏鹅体内分离到的鹅星状病毒与禽星状病毒属其他代表性毒株的基因组核苷酸同源性为46.5%~62.0%,与ORF2基因编码的蛋白质的氨基酸序列的同源性仅为27.3%~57.0%,遗传距离较远。与引起肠炎的鹅星状病毒FLX株相比,引起痛风症状的鹅星状病毒ORF2基因编码的蛋白质的氨基酸相似性为40.4%~42.5%,低于同种星状病毒的划分标准(75.0%),是一种新的鹅星状病毒种,因此许多学者将引起雏鹅痛风的鹅星状病毒定义为新型鹅星状病毒。也有学者将这2种鹅星状病毒分别定义为鹅星状病毒1(GoAstV1)和鹅星状病毒2(GoAstV2)[19],或者是鹅星状病毒G-I群和鹅星状病毒G-II群[20]。目前对这2种鹅星状病毒还未有统一的命名方式,本文暂时将引起鹅肠炎的毒株称为鹅星状病毒变异株,将引起雏鹅痛风的毒株称为新型鹅星状病毒。
张玉杰等[11]对临床采集的典型雏鹅痛风样品进行检测,发现约有94.03%的样品为鹅星状病毒变异株和新型鹅星状病毒混合感染,动物试验结果表明2种鹅星状病毒混合感染引起的痛风症状及死亡率要高于单独感染组。本实验室在前期流行病学调查中也发现,发生雏鹅痛风的鹅群中,可从部分泄殖腔拭子中同时检测出2种鹅星状病毒[21]。这些结果表明,临床上存在鹅星状病毒变异株和新型鹅星状病毒混合感染的情况,这2种鹅星状病毒在雏鹅痛风中发挥的作用及致病机制还有待进一步深入研究。目前还未有同时鉴别区分2种鹅星状病毒感染的诊断方法。传统的病原分离鉴定存在耗时长,对人员设备要求高等缺点。因此,建立一种可同时快速检测2种鹅星状病毒的方法具有重要的临床意义。本研究拟根据新型鹅星状病毒的ORF2基因和鹅星状病毒变异株的ORF1a基因序列分别设计特异性引物,对反应体系和条件进行优化,建立快速、灵敏、准确的一步法双重RT-PCR检测方法,以期为2种鹅星状病毒的临床鉴别诊断,流行病学调查以及有效防控雏鹅痛风提供技术支撑。
1 材料与方法
1.1 病毒与细胞
新型鹅星状病毒(nGoAstV) AHQJ18株、鹅星状病毒变异株(vGoAstV) 33-3株、坦布苏病毒(TMUV)、鹅细小病毒(GPV)、鹅副黏病毒(GPMV)、H9N2亚型禽流感病毒(AIV)、大肠杆菌(Escherichiacoli)、沙门菌(Salmonella)和鸡肝癌细胞系(LMH)等由江苏省农业科学院兽医研究所保存。
1.2 试剂
pMD19-T载体、DH5α感受态细胞、限制性内切酶EcoRⅠ和HindⅢ购自宝生物工程(大连) 有限公司;DNA/RNA提取试剂盒、胶回收试剂盒、小量提取质粒试剂盒等购自爱思进生物技术( 杭州) 有限公司;一步法RT-PCR试剂盒、DNA Marker等购自南京诺唯赞生物科技有限公司。
1.3 引物设计与合成
参考GenBank收录的新型鹅星状病毒ORF2基因和鹅星状病毒变异株ORF1a基因序列,应用Primer Premier 5.0软件分别设计了1对特异性引物,引物信息见表1。引物由南京金斯瑞生物科技有限公司合成。

表1 本试验所用引物序列及产物长度
1.4 新型鹅星状病毒和鹅星状病毒变异株单一RT-PCR扩增
分别取200 μl新型鹅星状病毒阳性LMH细胞培养物和鹅星状病毒变异株阳性鹅胚尿囊液,用RNA提取试剂盒提取病毒核酸,利用新型鹅星状病毒和鹅星状病毒变异株的特异性引物,分别进行单一的一步法RT-PCR扩增。扩增反应体系为:2×一步法反应缓冲液12.50 μl,酶混合物 1.25 μl,上、下游引物(10 μmol/L)各1.00 μl, RNA模板 2.00 μl,ddH2O补足至25.00 μl,混匀。新型鹅星状病毒的反应程序为:50 ℃ 反转录 30 min;94 ℃ 预变性 3 min;94 ℃ 30 s,54 ℃ 30 s,72 ℃ 45 s,共30个循环;72 ℃延伸7 min。鹅星状病毒变异株的反应程序为:50 ℃ 反转录 30 min;94 ℃ 预变性 3 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,共30个循环;72 ℃延伸7 min。反应结束后,扩增产物经1.5%琼脂糖凝胶电泳检测。
1.5 重组质粒标准品的制备
用胶回收试剂盒分别回收上述RT-PCR扩增条带,克隆至pMD19-T载体,转化大肠杆菌DH5α,筛选阳性克隆,提取质粒后用限制性内切酶EcoR Ⅰ和HindⅢ进行双酶切鉴定。阳性质粒送南京金斯瑞生物科技有限公司进行序列测定。提取序列正确的重组质粒,测定质量浓度并计算质粒拷贝数,作为质粒标准品。
1.6 一步法双重RT-PCR检测方法的建立及反应条件优化
将新型鹅星状病毒和鹅星状病毒变异株阳性培养物等量混合后提取RNA作为模板,建立一步法双重RT-PCR检测方法。固定反应体系中其他组分不变,单一改变引物用量来确定最适的引物浓度。引物nGoAstV-F、nGoAstV-R和vGoAstV-F、vGoAstV-R的浓度均为10 μmol/L,加入量设0.1 μl、0.3 μl、0.5 μl、0.7 μl、0.9 μl 5个梯度。反应程序为:50 ℃ 反转录 30 min;94 ℃ 预变性 3 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 45 s,共30个循环;72 ℃延伸7 min。反应结束后,取扩增产物进行琼脂糖凝胶电泳检测。
选择上述筛选的最佳引物用量,单一改变退火温度,设置52.0 ℃、53.0 ℃、54.0 ℃、55.2 ℃、56.4 ℃、57.6℃、58.8 ℃和60.0 ℃ 8个梯度退火温度,进行一步法双重RT-PCR扩增,确定最佳退火温度。
1.7 一步法双重RT-PCR检测方法的特异性试验
用上述优化好的反应体系和条件,分别检测新型鹅星状病毒和鹅星状病毒变异株单一和混合样品,以及坦布苏病毒、鹅细小病毒、鹅副黏病毒、H9N2亚型禽流感病毒、大肠杆菌和沙门菌单一样品,同时设置生理盐水为阴性对照,用建立的一步法双重RT-PCR方法进行扩增检测,检验该方法的特异性。
1.8 一步法双重RT-PCR检测方法的敏感性试验
将构建好的新型鹅星状病毒和鹅星状病毒变异株质粒标准品等体积混合,用ddH2O进行10倍梯度稀释,取1×10-2~1×10-109个稀释度各2 μl混合质粒作为模板进行一步法双重RT-PCR扩增,以检验该方法的敏感性。
1.9 一步法双重RT-PCR检测方法的重复性试验
用建立的一步法双重RT-PCR检测方法对3份新型鹅星状病毒和鹅星状病毒变异株均为阳性的样品进行3次重复检测,以检验该方法的重复性和稳定性。
1.10 临床样品的检测
对2020年江苏地区124份21日龄内扬州白鹅泄殖腔拭子样本分别用本研究建立的单一和双重RT-PCR方法检测其中的新型鹅星状病毒和鹅星状病毒变异株,以评价该一步法双重RT- PCR检测方法的临床实用性。
2 结果与分析
2.1 单一RT-PCR扩增及重组质粒标准品的构建
以提取的新型鹅星状病毒和鹅星状病毒变异株RNA为模板,利用引物nGoAstV-F/R和vGoAstV-F/R分别进行单一的一步法RT-PCR扩增。扩增产物经1.5%琼脂糖凝胶核酸电泳检测,结果如图1所示,新型鹅星状病毒目的基因片段大小为658 bp,鹅星状病毒变异株目的基因片段大小为381 bp,与预期片段大小相符。
将2个目的基因片段分别回收纯化后连接至pMD19-T载体,转化DH5αE.coli,提取质粒后进行双酶切鉴定。琼脂糖凝胶核酸电泳检测结果显示,酶切片段与预期大小相符(图2)。测序后经NCBI BLAST比较分析发现,2个目的基因片段与新型鹅星状病毒(GenBank登录号:MF772821.1)和鹅星状病毒变异株(GenBank登录号:MH410610.1)的同源性分别为98.2%和97.6%,表明阳性重组质粒标准品构建成功。用超微量分光光度计测定pMD19T-nGoAstV和pMD19T-vGoAstV的质量浓度,其质量浓度分别为62.83 ng/μl和57.40 ng/μl,计算其拷贝数分别为1 μl 1.71×1010拷贝和1 μl 1.70×1010拷贝。

M:DL2 000 DNA marker;1:新型鹅星状病毒;2:阴性对照;3:鹅星状病毒变异株;4:阴性对照。图1 新型鹅星状病毒和鹅星状病毒变异株单一RT-PCR扩增Fig.1 The single RT-PCR amplification of novel goose astrovirus and variant of goose astrovirus

M:DL5 000 DNA marker;1:新型鹅星状病毒质粒标准品pMD19T-nGoAstV酶切鉴定; 2:鹅星状病毒变异株质粒标准品pMD19T-vGoAstV酶切鉴定。图2 重组质粒标准品的酶切鉴定Fig.2 Identification of standard recombinant plasmids digested by Eco R Ⅰ和Hind Ⅲ
2.2 一步法双重RT-PCR检测方法的建立及反应条件优化
将新型鹅星状病毒和鹅星状病毒变异株阳性培养物等量混合后提取RNA作为模板,用引物nGoAstV-F/R和vGoAstV-F/R进行一步法双重RT-PCR扩增,琼脂糖凝胶电泳检测结果显示,可同时扩增出658 bp和381 bp 2个条带,与单一RT-PCR扩增条带大小相同,阴性对照未扩增出任何条带(图3)。
固定其他条件不变,对加入的引物nGoAstV-F/R和vGoAstV-F/R设置0.1 μl、0.3 μl、0.5 μl、0.7 μl和0.9 μl 5个梯度,进行一步法双重RT-PCR扩增。结果显示,当2对上、下游引物(10 μmol/L)各加入0.5 μl时即可获得较高的扩增效率,因此确定引物最适用量为0.5 μl(图4)。
固定其他反应条件不变,2对引物用量均为0.5 μl,在RT-PCR扩增时设置52.0 ℃、53.0 ℃、54.0 ℃、55.2 ℃、56.4 ℃、57.6℃、58.8 ℃和60.0 ℃ 8个退火温度梯度,结果显示,退火温度为57.6 ℃及以下时,目的条带均较亮,最终确定 57.6 ℃为最佳退火温度(图5)。
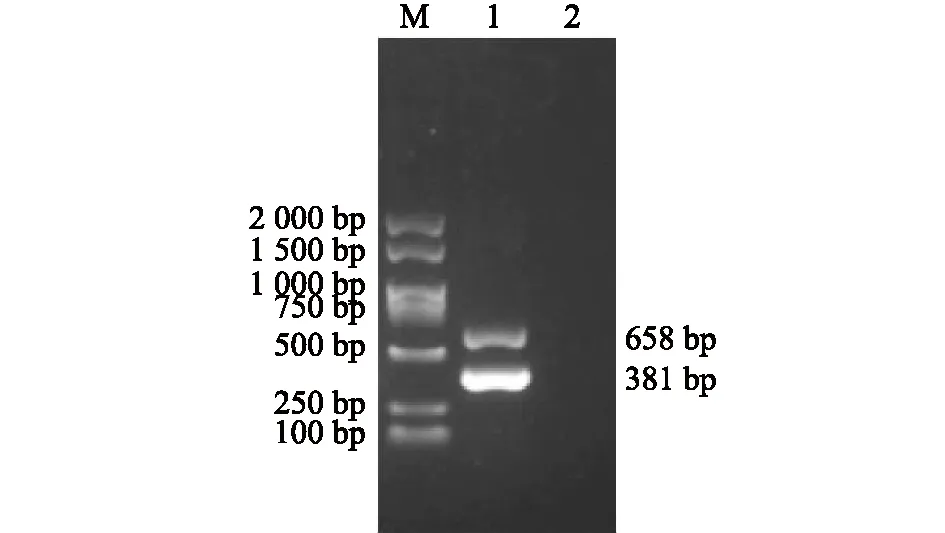
M:DL2 000 DNA marker;1:新型鹅星状病毒和鹅星状病毒变异株一步法双重RT-PCR扩增产物;2:阴性对照。图3 新型鹅星状病毒和鹅星状病毒变异株一步法双重RT-PCR扩增Fig.3 The one-step duplex RT-PCR amplification of novel goose astrovirus and variant of goose astrovirus
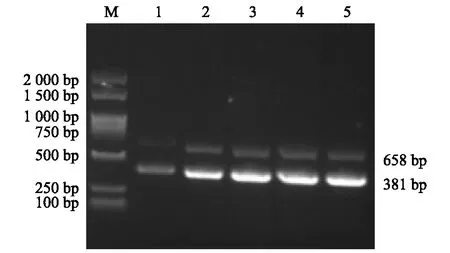
M:DL2 000 DNA marker;1~5:引物用量依次为0.1 μl、0.3 μl、0.5 μl、0.7 μl、0.9 μl。图4 一步法双重RT-PCR引物用量的优化Fig.4 Optimization of primer dosage for the one-step duplex RT-PCR
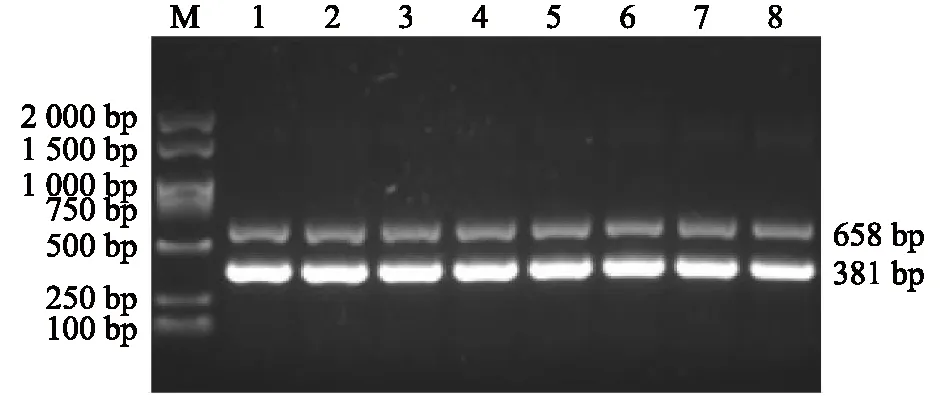
M:DL2 000 DNA marker;1~8:退火温度依次为52.0 ℃、53.0 ℃、54.0 ℃、55.2 ℃、56.4 ℃、57.6℃、58.8 ℃和60.0 ℃。图5 一步法双重RT-PCR退火温度的优化Fig.5 Optimization of annealing temperature for the one-step duplex RT-PCR
2.3 一步法双重RT-PCR检测方法的特异性试验
应用优化的一步法双重RT-PCR检测方法分别对新型鹅星状病毒和鹅星状病毒变异株单一和混合阳性样品以及坦布苏病毒、鹅细小病毒、鹅副黏病毒、H9N2亚型禽流感病毒、大肠杆菌和沙门菌进行检测,结果(图6)显示,2种鹅星状病毒的单一样品和混合样品均能扩增出与预期一致的特异性条带,而其他病原菌均未扩增出特异性条带,说明该方法具有较高的特异性。

M:DL2 000 DNA marker;1:新型鹅星状病毒;2:鹅星状病毒变异株;3:新型鹅星状病毒和鹅星状病毒变异株;4:坦布苏病毒;5:鹅细小病毒;6:鹅副黏病毒;7: H9N2亚型禽流感病毒;8:大肠杆菌;9:沙门菌;10:阴性对照。图6 一步法双重RT-PCR检测方法的特异性试验Fig.6 Specificity test of the one-step duplex RT-PCR detection method
2.4 一步法双重RT-PCR检测方法的敏感性试验
将新型鹅星状病毒和鹅星状病毒变异株质粒标准品等体积混合后进行10倍梯度稀释,取1×10-2~1×10-109个稀释度各2 μl混合质粒为模板,用建立的一步法双重RT-PCR检测方法进行扩增,结果(图7)显示,当混合质粒标准品稀释至1×10-7时仍能同时检测出2种鹅星状病毒的特异性条带,即对新型鹅星状病毒和鹅星状病毒变异株的最低检出量分别为1 μl 1.71×103拷贝和1 μl 1.70×103拷贝,表明该方法具有良好的敏感性。

M:DL2 000 DNA marker;1~9:新型鹅星状病毒和鹅星状病毒变异株混合质粒标准品稀释度分别为10-2~10-10;10:阴性对照。图7 一步法双重RT-PCR检测方法的敏感性试验Fig.7 Sensitivity test of the one-step duplex RT-PCR detection method
2.5 一步法双重RT-PCR检测方法的重复性试验
用建立的一步法双重RT-PCR检测方法对3份新型鹅星状病毒和鹅星状病毒变异株均为阳性的样品进行3次重复检测,均能同时扩增出2种鹅星状病毒的特异性条带(图8),表明该方法具有良好的重复性。

M:DL2 000 DNA marker;1~3、5~7、9~11:3份新型鹅星状病毒和鹅星状病毒变异株均为阳性样品的3次重复性检测;4、8、12:阴性对照。图8 一步法双重RT-PCR检测方法的重复性试验Fig.8 Repeatability test of the one-step duplex RT-PCR detection method
2.6 临床样品的检测
用本研究建立的单一和一步法双重RT-PCR方法分别对2020年江苏地区124份21日龄内扬州白鹅泄殖腔拭子样本中的2种鹅星状病毒进行检测。在124份雏鹅泄殖腔拭子样本中,新型鹅星状病毒阳性样本56份,阳性率为45.16%;鹅星状病毒变异株阳性样本35份,阳性率为28.23%;2种鹅星状病毒均为阳性的样本14份,阳性率为11.29%。检测结果与单一RT-PCR方法结果一致,符合率为100.00%。表明本研究建立的一步法双重RT-PCR检测方法可以对临床样品中的2种鹅星状病毒进行鉴别诊断。
3 讨论
2016年以来,中国主要养鹅地区陆续暴发一种以肾炎、痛风为主要特征的传染病,对中国养鹅产业造成了严重的经济损失。该病主要影响21日龄以内的雏鹅,患病雏鹅食欲减退、精神沉郁、腹泻,死亡率高达50%。剖检可见多个内脏器官表面及关节内有白色尿酸盐样渗出物,胆囊肿大,内有尿酸盐沉积,肾脏肿胀,输尿管内有白色尿酸盐样沉积物。国内多位学者从具有痛风症状的雏鹅体内分离到一种新的星状病毒[13-18],基因序列分析结果表明,这些鹅星状病毒与禽星状病毒属其他代表性毒株的基因组核苷酸同源性较低,遗传距离较远,是一种新的鹅星状病毒种,因此许多学者将引起雏鹅痛风的鹅星状病毒定义为新型鹅星状病毒。
Zhang等[10]从具有肠炎症状的雏鹅体内鉴定出1株鹅源星状病毒FLX株。之后有学者从临床鹅群中分离到与新型鹅星状病毒不同的鹅源星状病毒。遗传序列分析结果表明,这些鹅源星状病毒与鹅星状病毒FLX株为同一星状病毒种,但存在一定的遗传距离,可定义为变异株,本文暂时称为鹅星状病毒变异株。鹅星状病毒变异株与新型鹅星状病毒的ORF2基因编码的蛋白质的氨基酸同源性为40.4%~42.5%,低于同种星状病毒的划分标准75.0%,是2种不同的星状病毒种。有文献报道,在临床发生痛风症状的鹅群内存在2种鹅星状病毒混合感染的情况,动物试验结果表明,2种鹅星状病毒混合感染引起的痛风症状及死亡率要高于单独感染组[11,21]。但这2种鹅星状病毒在雏鹅痛风中发挥的具体作用及致病机制还有待进一步深入研究。
目前国内对于2种鹅星状病毒的研究均处于初期阶段[22-23],仅有单独检测新型鹅星状病毒和鹅星状病毒变异株的RT-PCR方法或实时荧光定量RT-PCR方法[24-25],还没有同时鉴别区分2种鹅星状病毒感染的诊断方法。因此,本研究建立了一种一步法双重RT-PCR检测方法,可以同时、准确、快速、简便地检测这2种鹅星状病毒,具有重要的临床意义。
传统的病原分离鉴定存在耗时长,对人员设备要求高等缺点。RT-PCR技术是一种比较成熟的核酸扩增检测技术,而且扩增出的特异性片段可以进行基因测序,进一步进行遗传进化分析。2种鹅星状病毒均为RNA病毒,检测时需先将RNA反转录为cDNA,再进行PCR扩增。本研究采用一步法RT-PCR方法,减少了操作步骤,降低了样本被污染的风险,提高了检测效率。
本研究根据新型鹅星状病毒的ORF2基因和鹅星状病毒变异株的ORF1a基因的保守区域分别设计了特异性引物,并对反应体系及反应条件进行优化,确定了最佳引物使用量和退火温度,首次建立了针对这2种鹅星状病毒的一步法双重RT-PCR检测方法。该方法可在同一反应体系中扩增出新型鹅星状病毒和鹅星状病毒变异株的2个特异性条带,对其他鹅常见病毒性和细菌性病原的检测结果均为阴性,具有较高的特异性。本研究建立的一步法双重RT-PCR检测方法对新型鹅星状病毒和鹅星状病毒变异株的最低检测量分别是1 μl 1.71×103拷贝和1 μl 1.70×103拷贝,具有良好的敏感性,同时具有较好的重复性。应用已建立的一步法双重RT-PCR检测方法对临床采集的雏鹅泄殖腔拭子样本进行检测,结果显示,124份雏鹅泄殖腔拭子中新型鹅星状病毒阳性率为45.16%,鹅星状病毒变异株阳性率为28.23%,2种鹅星状病毒均为阳性的占11.29%,证实临床上鹅群中确实存在2种鹅星状病毒混合感染的情况。检测结果与单一RT-PCR方法检测结果一致,符合率为100.00%。
本研究建立的检测新型鹅星状病毒和鹅星状病毒变异株的一步法双重RT-PCR检测方法具有操作简便,灵敏度高,特异性强的特点,可以快速高效地检测出2种鹅星状病毒,为上述2种病毒病的流行病学调查和临床早期鉴别诊断提供技术支持,对2种鹅星状病毒病的病原监测和有效防控以及混合感染的致病性研究具有重要意义。
