艾博韦泰联合多替拉韦钠在初治艾滋病患者中的临床应用
2022-02-06刘欢霞何盛华周锐峰何沅鸿杨彤彤姚远
刘欢霞 何盛华 周锐峰 何沅鸿 杨彤彤 姚远
成都市公共卫生临床医疗中心感染一科,成都 610061
近年来,随着新型药物的研发,抗逆转录病毒治疗(ART)方案日新月异,二联简化治疗方案逐渐成为当前国际上主流ART 方案之一[1]。中国艾滋病诊疗指南[2]及专家共识[3]认为部分二联简化疗法在病毒抑制方面不逊于三联方案,同时在减少药物不良反应及降低药物成本方面均有较大的优势,可作为首选或备选ART 方案。目前指南推荐以整合酶抑制剂(INSTIs) 为基础及含增效剂的蛋白酶抑制剂(bPIs)为基础的两药方案可作为初治患者的二联简化治疗方案选择,但其疗效受限于基线病毒载量或CD4+T 细胞(以下简称“CD4”)。融合抑制剂具有新作用机制(抑制病毒包膜与人体细胞膜融合,阻止病毒进入细胞)、静脉给药、半衰期长、耐药屏障高、药物不良反应少及药物间相互作用少等优势[4],INSTIs 具有高耐药屏障、高效、安全性良好的优势[5],因此融合抑制剂与INSTIs 的新两药ART 方案是否可以突破基线病毒载量或CD4+T 细胞的限制并减少不良反应,是否可广泛用于初治艾滋病患者,本文对此进行了初步探索,现将结果报道如下。
材料与方法
一、样本来源
回顾性收集2019年7月至2020年12月在成都市公共卫生临床医疗中心感染一科住院时进行基线耐药检查并且使用长效融合抑制剂——艾博韦泰 (ABT)+整合酶抑制剂——多替拉韦钠片(DTG)进行初始治疗的艾滋病患者资料,共计106 例患者纳入研究。艾滋病诊断标准参考《中国艾滋病诊疗指南(2018 版)》[2],所有受试者均签署知情同意书,该研究已经通过成都市公共卫生临床医疗中心伦理委员会审批(审批号:20180129)。
二、方法
1.HIV-1 基因型耐药检测
抽取患者外周静脉血5 mL,离心保留血浆。采用In-house 测序法进行HIV 基因测序,HIV-1 耐药基因型检测试剂盒(PCR-测序法)定性检测HIV-1基因组PR 区和RT 区的耐药突变,使用美国斯坦福大学HIV 耐药数据库 (http://hivdb.stanford.edu/)在线分析耐药性及突变位点。耐药标准:敏感S(0~9分); 潜在耐药P (10~14 分); 低度耐药L (15~29分);中度耐药I(30~59 分);高度耐药H(>60 分)。
2.HIV RNA 和T 淋巴细胞亚群检测
采用美国雅培公司的 Abbott Real Time M2000sp 病毒定量检测仪及配套试剂检测血浆HIV RNA,HIV RNA<40 拷贝/mL 为检测下限;采用美国BD 公司流式细胞仪FACS Calibur 及配套试剂盒检测T 淋巴细胞亚群。
3.实验室指标异常等级及不良事件评估标准
实验室指标异常等级:1 级:轻度;2 级:中度;3级:严重但不危及生命;4 级:危及生命;5 级:与死亡相关。使用美国NCI 发布的常见不良事件评价标准(CTCAE)5.0 版[6]进行不良事件的评估分级。
三、统计学分析
采用Excel 建立数据库收集、录入相关数据,采用SPSS25.0 进行统计学分析,对HIV RNA 进行对数转换,对计量资料进行Shapiro-Wilk 正态分布检验,符合正态分布的计量资料采用均数±标准差(±s)描述,组间比较采用t 检验;偏态分布的计量资料采用M(Q1,Q3)描述,组间比较采用秩和检验;计数资料采用例数、百分比或率表示,对于重复测量数据,采用广义估计方程分析HIV RNA 和CD4随时间的变化,利用最大似然比比较2 周、4 周相对于基线的变化,P<0.05 为差异有统计学意义。
结果
一、基本情况
106 例艾滋病患者的年龄为(45.00±16.09)岁,范围为21~84 岁,以20~60 岁为主,共86 例(81.13%);男性93 例(87.74%),女性13 例(12.26%)。患者住院时间为(33.58±18.59) d;感染途径均为性接触,其中异性性接触占64.15%(68/106),同性性接触占35.85%(38/106)。15.09%(16/106)的患者合并乙型肝炎,无患者合并丙型肝炎,12.26%(13/106)合并梅毒,14.15%(15/106) 合并高血压或高血脂或糖尿病等老年性疾病;所有患者均合并严重机会性感染,其中56.60%(60/106)合并卡氏肺孢子虫肺炎(Pneumocystis caeinii pneumonia,PCP),33.96%(36/106)合并肺部真菌感染,12.26%(13/106)合并肺结核,9.43% (10/106) 合并巨细胞病毒(cytomegalovirus,CMV)感染,9.43%(10/106)合并隐球菌感染,2.83%(3/106) 合并弓形虫脑病,42.45%(45/106)合并口腔和(或)食道真菌感染,8.49%(9/106)口唇或生殖器疱疹,1.89%(2/106)合并肺外结核,0.94%(1/106) 合并伯基特淋巴瘤,0.94%(1/106)合并马尔尼菲篮状菌病。96.23%(102/106)的艾滋病患者合并呼吸系统感染,16.98%(18/106)合并消化道系统感染,9.43%(10/106) 合并中枢神经系统感染,6.60%(7/106) 合并皮肤感染。16.98%(18/106) 的患者合并1 种机会性感染,83.02%(88/106) 合并2 种及以上机会性感染;17.92%(19/106)接受1 种抗真菌或抗细菌或抗病毒药物,82.08%(87/106) 接受2 种及以上抗真菌或抗细菌或抗病毒药物。
二、耐药检测结果
艾滋病患者启动ART 前进行基因型耐药检测,其中22 例患者检测到耐药突变位点,纳入耐药组,84 例患者对ART 药物均敏感,纳入敏感组。耐药突变位点阳性率20.75%(22/106)。耐药组患者中1 例对PIs 的阿扎那韦/利托那韦(ATV/r)和洛匹那韦/利托那韦(LPV/r)潜在耐药,21 例对NNRTIs 的1 种或几种药物潜在及以上程度的耐药,其中13 例对依非韦伦(EFV)、依曲韦林(ETR)、奈韦拉平(NVP)和利匹韦林 (RPV) 均潜在耐药,2 例对EFV、ETR、NVP、RPV 均低度耐药,1 例对NVP 高度耐药,1 例对EFV 和NVP 高度耐药,3 例对ETR、NVP、RPV潜在耐药,1 例对ETR 潜在耐药和对RPV 低度耐药。
三、ART 有效性分析
1.ART 前后HIV RNA 和CD4+T 细胞变化分析
106 例艾滋病患者基线HIV RNA(5.42±0.07) lg拷贝/mL,基线CD4+T 细胞(62.92±8.22)个/μL;ART 2 周、4 周,HIV RNA 较基线分别下降(2.75±0.07) lg拷贝/mL 和(2.92±0.14) lg 拷贝/mL(χ2=1 466.40 和436.24,P 均<0.001),CD4+T 细胞较基线分别上升(49.18±14.28)个/μL 和(94.03±20.19)个/μL(χ2=11.86,P<0.001;χ2=21.69,P=0.001)。
2.病毒学抑制率及免疫学恢复情况分析
如表1所示,106 例患者中,75.47%(80/106)基线HIV RNA>105拷贝/mL,80.19%(85/106) 基线CD4+T 细胞计数<100 个/μL,仅7.55%(8/106)的患者基线CD4+T 细胞计数>200 个/μL。ART 2 周后,89例患者检测HIV RNA,其中4.49%(4/89) 的患者HIV RNA<40 拷贝/mL ;87 例患者检测CD4+T 细胞,其中57 例(65.51%)患者CD4+T 细胞计数<100个/μL,17 例 (16.04%) 患者CD4+T 细胞计数>200个/μL。ART 4 周后,81 例患者检测HIV RNA,其中19 例(23.46%)患者HIV RNA<40 拷贝/mL;82 例患者检测CD4+T 细胞,其中43 例(52.44%)患者CD4+T细胞计数<100 个/μL,20 例(24.39%) 患者CD4 计数>200 个/μL。
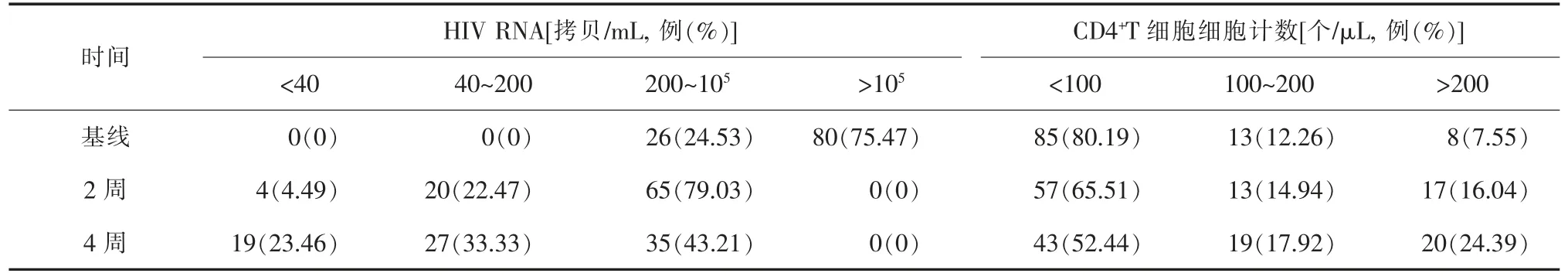
表1 艾滋病患者抗病毒治疗前后病毒学抑制率和免疫学恢复情况分析
四、耐药组和敏感组ART 疗效差异分析
1.艾滋病患者的HIV RNA 变化分析
耐药组和敏感组的基线HIV RNA 差异无统计学意义 (t=-0.48,P=0.635)。ART 2 周、4 周,两组HIV RNA 差异也均无统计学意义 (t=-0.29,P=0.769;t=0.63,P=0.530)。具体结果详见表2。
2.艾滋病患者的CD4+T 细胞变化分析
两组基线、ART 2 周和4 周CD4+T 细胞的计数差异均无统计学意义(t=-1.81,P=0.076;t=-0.43,P=0.667;t=-1.42,P=0.130)。具体结果详见表2。
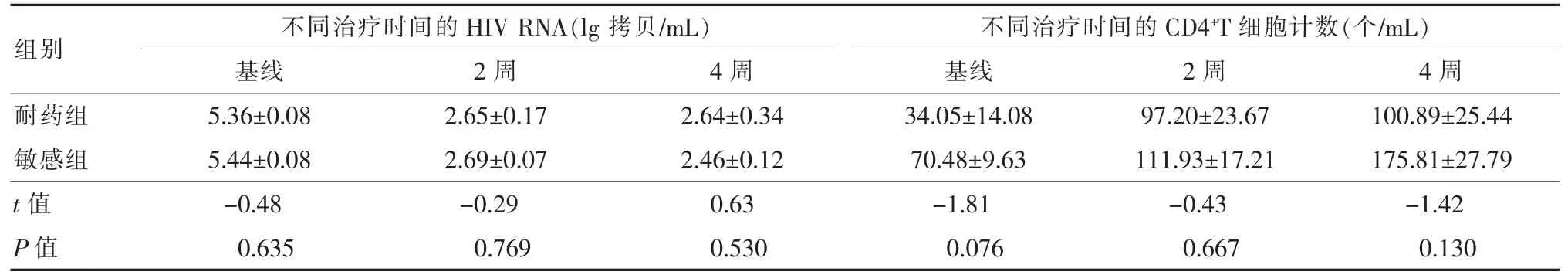
表2 两组艾滋病患者不同抗病毒治疗时间的HIV RNA 和CD4+T 细胞计数情况
五、ART 安全性分析
1.治疗前后实验室指标变化分析
106 例患者均合并严重机会性感染及合并用药,因此部分患者基线存在肝功能、肾功能、血常规异常,ART 治疗2 周、4 周,以ALT、AST、尿酸和肌酐升高、血红蛋白和血小板减少为主,治疗期间无患者发生直接与ART 药物相关的5 级不良事件。具体结果详见表3。
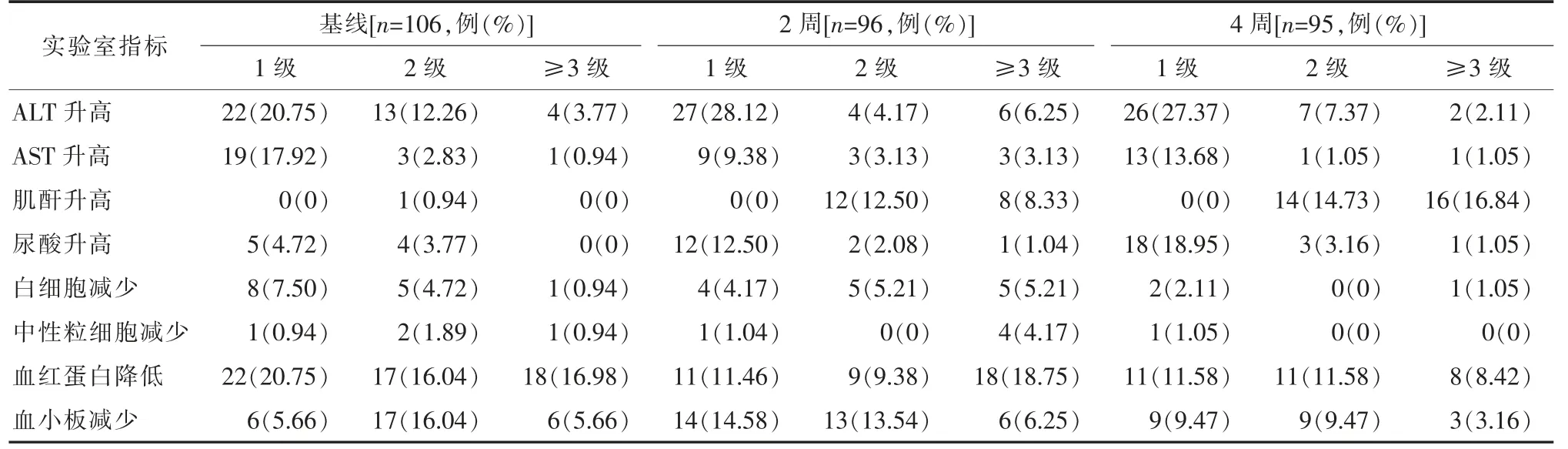
表3 抗病毒治疗前后实验室指标异常等级及发生率
2.不良反应发生情况
106 例患者住院使用ABT+DTG 期间,3 例患者因合并症所致病情危重抢救无效死亡。无患者发生注射位点反应,未报告头晕、头痛、恶心、呕吐、腹泻、皮疹等直接与ART 药物相关的严重不良反应,无患者因产生与ART 药物直接相关的严重不良事件而停用或更换ART 方案,无患者因药物相互作用而停用或更换ART 方案。
讨论
选择适合初治艾滋病患者的ART 方案一直是临床工作的重点和难点,尤其是合并多种机会性感染的住院艾滋病患者。探索安全、药物相互作用少的ART 方案将有利于提高ART 疗效,降低病死率,节约医疗资源。目前两药ART 方案较传统三药ART 方案药物不良反应少、药物间相互作用少且能减少经济负担,本研究对住院初治的艾滋病患者采用ABT+DTG 两药方案,结果显示治疗2 周、4 周,HIV RNA 较基线平均下降>2 个lg 拷贝/mL,CD4+T细胞也较基线水平有明显上升,提示早期使用ABT+DTG 方案进行初治ART 能快速抑制HIV 病毒复制,改善免疫功能,不受基线HIV RNA 和CD4+T 细胞的限制。
一、ABT+DTG 方案不受基线病毒载量和CD4+T细胞的限制
2019年EACS 指南推荐DTG+拉米夫定(3TC)两药方案[7]用于HIV RNA<105拷贝/mL 且CD4+T 细胞>200 个/μL 的初治艾滋病患者,但对于基线HIV RNA>105拷贝/mL 或CD4+T 细胞<200 个/μL 的初治患者该方案的疗效研究报道较少。本研究显示,75.47%(80/106)患者的基线HIV RNA>105拷贝/mL、80.19%(85/106)患者的基线CD4+T 细胞<100 个/μL,ART 治疗4 周患者HIV RNA<40 拷贝/mL 占比为23.46%(19/81),高于Zhao 等[8]研究中DTG+3TC 治疗4 周11.9%患者HIV RNA<50 拷贝/mL (76.2%患者基线HIV RNA>105拷贝/mL)。该研究[8]中,52%患者基线HIV RNA>5×106拷贝/mL,治疗4 周4.5%患者HIV RNA<50 拷贝/mL,但未对39 例基线HIV RNA>5×106拷贝/mL 患者进行分组研究,以及未收集该方案的长期疗效及安全性数据,因此,有关DTG+3TC与DTG+ABT 方案对于基线HIV RNA>5×106拷贝/mL的疗效及长期疗效、安全性差异还需进一步研究、探索。
多个研究[7-9]表明,无论拉替拉韦+达芦那韦/利托那韦或是拉替拉韦+LPV/r 两药方案均不适用高HIV RNA 或低CD4+T 细胞的初治艾滋病患者。本研究结果显示ABT+DTG 对基线病载和CD4+T 细胞无限定条件,即使基线HIV RNA>105拷贝/mL 和CD4+T细胞<100 个/μL,早期使用该方案仍可快速抑制HIV 病毒复制、恢复免疫功能,疗效显著。
二、基线存在NNRTIs 或PIs 药物耐药可选用ABT+DTG 方案
本文对所有患者均进行了基线耐药检测,发现22 例患者检出耐药突变位点,这22 例患者对1 种或几种NNRTIs 或PIs 药物存在耐药,且以潜在耐药为主。耐药组与敏感组基线及ART2 周、4 周HIV RNA、CD4+T 细胞差异无统计学意义,可能提示无论基线是否存在NNRTIs 或PIs 药物耐药均可选用ABT+DTG 方案进行治疗。由于特殊的分子结构,ABT 及DTG 均有高耐药屏障的优势,多个临床研究[10-12]显示,ABT 及DTG 对多种HIV 病毒株均有很强的抑制活性,尚未发现治疗期间初治患者出现ABT 或DTG 耐药。结合本研究结果,提示ABT+DTG可用于无法进行基线耐药检测的初治艾滋病患者,但仍建议进行基线耐药检测。由于本研究中基线耐药患者较少,以潜在耐药为主,未发现整合酶耐药,且观察时间较短,无法探讨高度耐药患者及整合酶耐药患者使用该方案的疗效,需进一步研究以了解基线耐药对该方案长期疗效的影响。
三、ABT+DTG 方案安全性良好
本研究中有3 例患者因合并症所致的病情危重抢救无效死亡,治疗期间无患者发生直接与ART药物相关的5 级不良事件,无患者发生注射位点反应,依从性良好,无患者因与ART 药物直接相关的严重不良事件而停用或更换ART 方案,无患者因药物相互作用而停用或更换ART 方案,提示该方案安全性良好,药物相互作用少,适用于住院艾滋病患者。由于本文患者均合并严重机会性感染及合并用药,因此在治疗过程中,须选择药物相互作用较少的ART 方案,据利物浦大学药物相互作用数据库显示,ABT、DTG 与多种药物相互作用少,因此使用该方案能减少药物相互作用对疗效及安全性的影响。同时,由于其特殊的代谢途径,ABT、DTG 对肝肾功能影响较小[13-14],减少了对肝脏、肾脏的损伤,并且ABT 半衰期长,可1~2 周注射1 次,减少了患者服药负担及注射位点反应[15],能有效提高治疗依从性。有研究报道,初治重症艾滋病患者使用含ABT 的方案可在短期内快速降低HIV RNA 水平,改善免疫功能,不良反应少[16]。
综上,住院初治艾滋病患者早期使用ABT+DTG 方案能快速降低HIV RNA,改善免疫功能,安全性良好,即使基线存在NNRTIs 或PIs 药物耐药,短期内使用该方案也能有效抑制HIV 病毒复制及恢复免疫功能。本研究为住院初治艾滋病患者临床应用ABT+DTG 方案提供了研究数据,但由于观察患者例数偏少,且为单中心、回顾性分析,部分安全性数据缺失,需进一步增加样本量及多中心研究,同时其在初治艾滋病患者中的长期疗效及安全性还需进一步研究。
利益冲突所有作者均声明不存在利益冲突
作者贡献声明刘欢霞:研究设计、数据收集、整理、统计分析、论文写作;何盛华:指导和修改论文;周锐峰、何沅鸿、杨彤彤、姚远:实施研究、技术支持
