PD-1抑制剂联合化疗一线治疗晚期食管鳞状细胞癌的Meta分析
2022-02-04魏瑜高艳努尔斯曼古丽买买提明马晓丽曹雷雨刘娟张莉
魏瑜 高艳 努尔斯曼古丽·买买提明 马晓丽 曹雷雨 刘娟 张莉
食管癌(esophageal cancer,EC)恶性程度高,预后差,病死率居所有恶性肿瘤第六位[1]。在高发病率的中国,约90%的EC为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)[2]。ESCC 早期症状不明显,约60%~70%的患者就诊时即为晚期病变,5年生存率不足30%[3]。对于晚期ESCC患者,治疗方案首选全身性化疗,美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南推荐含铂双药化疗作为食管鳞癌一线治疗方案。受化疗耐药及剂量限制性毒性影响,目前中国存在大量未被满足治疗的患者。因此,探索新的有效的一线治疗方案来改善晚期ESCC患者生存率与预后十分必要。近年来,免疫治疗在晚期ESCC中取得了巨大突破,以程序性死亡受体1(programmed cell death-1,PD-1)为靶点的免疫治疗药物如帕博利珠单抗、纳武利尤单抗于2020年经NCCN及中国临床肿瘤协会(Chinese Society of Clinical Oncology,CSCO)指南共同推荐,已被陆续用于晚期ESCC二线及以上治疗[4-5]。同时,程序性死亡配体 1(programmed cell death-ligand 1,PD-L1)的表达、肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)、肿瘤突变负荷(tumor mutation burden,TMB)和微卫星不稳定性(microsatellite instability,MSI)可能是评估PD-1抑制剂疗效的有效生物标志物[6-7]。目前尚无循证医学证据证实PD-1抑制剂联合化疗相比单独化疗在晚期ESCC一线治疗中的优势。本研究系统评价了PD-1抑制剂联合化疗对比单独化疗一线治疗晚期ESCC的有效性及安全性,以期为临床决策提供最佳循证医学证据。
1 资料和方法
1.1 文献检索 检索The Cochrane Library、Web of Science、PubMed、EMbase、中国知网(CNKI)和万方等数据库,并检索Journal of Clinical Oncology、The New England Oncology、The Lancet Oncology等杂志和 ASCO、ESMO会议摘要,收集PD-1抑制剂联合化疗对比化疗一线治疗晚期ESCC患者的临床随机对照试验(randomized controlled trials,RCT)。检索时间从建库至2022年4月。以“Esophageal squamous cell carcinoma,Anti-PD-1,immunotherapy,Nivolumab,Pembrolizumab,Camrelizumab,SHR-1210,Sintilimab,Tislelizumab,Toripalimab,JS001,食管鳞状细胞癌,PD-1抑制剂,免疫治疗”为检索词,以不同组合手工检索,并追踪纳入文献的参考文献。语种不限,当多篇报道相同时,只评估最新文献。
1.2 纳入和排除标准 (1)均经病理诊断为ESCC;(2)肿瘤淋巴结转移(tumor node metastasis,TNM)分期为Ⅲ~Ⅳ期;(3)既往未接受过治疗;(4)研究类型为Ⅲ期RCT,试验组为PD-1抑制剂联合化疗,对照组为单独化疗。要求对给药途径、剂量、周期予以详细描述。排除标准:(1)研究对象及干预措施不符合纳入标准;(2)非RCT;(3)原始文献未给出Kaplan-Meier生存曲线或数据不全,无法获得风险比(hazard ratio,HR)数据的文献;(4)结局指标不明确的研究。
1.3 文献筛选和资料提取 2位研究员独立筛选文献资料及提取数据,并进行交叉核对,当产生分歧时,由第3位研究者介入达成共识。如有三臂研究,只提取符合纳入标准与和研究相关指标。结局指标包括研究名称、发表年份、临床试验名称及分期、样本量、治疗措施、总生存期(overall survival,OS)、无进展生存期(progression-free survival,PFS)及其HR和95%CI、客观有效率(overall response rate,ORR)、3~5级不良反应发生例数(按照1988年WHO抗癌药物毒副反应标准或常见不良反应事件评价标准CTCEA 5.0版)。
1.4 文献质量评价标准 应用Cochrane系统评价手册5.3,从RCT、分配隐藏、不全性结局指标、结局评价的盲法、参与者和研究人员的盲法、选择性报道及其他偏倚等7个方面对纳入的文献研究进行质量评价。依据评价结果,将纳入文献分为“高风险、低风险和情况不明”[8]。
1.5 统计学处理 应用RevMan 5.3统计软件。使用HR及其95%CI评估PFS及OS,采用RR及其95%CI分析ORR及不良反应发生率。文献无HR及95%CI者,按Prmar等[9]推荐方法,使用Kaplan-Meier生存曲线或logrank检验P值计算HR,用方差倒数法估计及合并HR和95%CI[10]。每个分析均进行异质性检验,如I2≤50%或P≥0.05,提示各研究间同质性较好,采用固定效应模型进行合并及分析;如I2>50%或P<0.05,提示各研究间存在异质性,采用随机效应模型分析。定义双侧界值P<0.05为差异有统计学意义。应用Stata 14统计软件,采用Begg检验或Egger检验对纳入文献行偏倚风险评估。
2 结果
2.1 文献检索和筛选结果 初检获507篇,剔除重复文献后余293篇,阅读题目摘要排除非RCT、个案报道及综述等余16篇,通过阅读全文,最终纳入5篇[11-15]。
2.2 数据提取和质量评价 5篇文献均为英文[11-15],共纳入晚期ESCC患者2 962例,病理分期均为Ⅲ期,其中接受PD-1抑制剂+化疗治疗1 477例(试验组);接受化疗治疗1 485例(对照组)。纳入文献基本特征见表1。质量评价结果显示,纳入文献质量均较高,见图1。
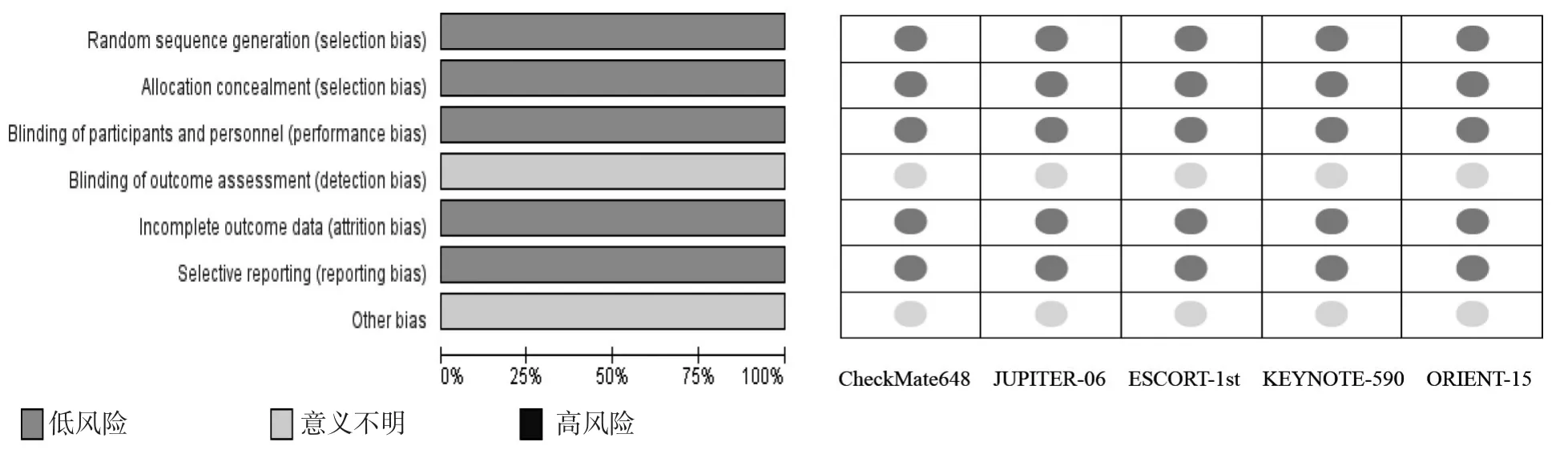
图1 文献质量评价
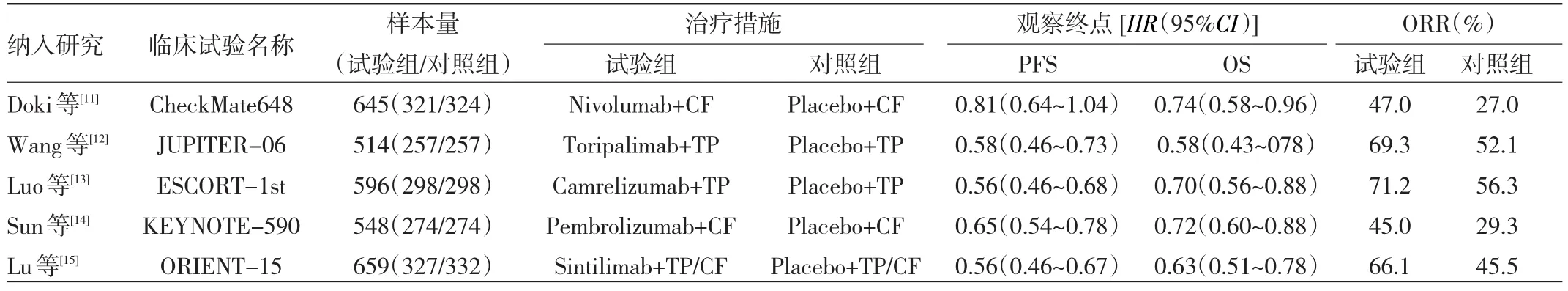
表1 文献质量评价
2.3 主要结局指标的Meta分析结果
2.3.1 OS 纳入的5篇文献均报道了OS,异质性检验结果显示P>0.05,I2<50%,采用固定效应模型。与对照组相比,试验组患者OS显著延长(HR=0.68,95%CI:0.62~0.75,P<0.01),见图2。根据PD-1抑制剂联合化疗方案的不同进行亚组分析,结果显示与PD-1抑制剂联合5-氟尿嘧啶+顺铂(CF)方案化疗相比,PD-1抑制剂联合紫杉醇+顺铂(TP)方案化疗在延长患者OS方面获益更显著,见图3。纳入的文献中有3项RCT[12,14-15]报道了PD-L1 综合阳性评分(combined positive score,CPS)≥10时患者的OS,根据PD-L1 CPS水平进行亚组分析,结果显示相比对照组,试验组患者在延长OS方面优势更显著(HR=0.61,95%CI:0.51~0.73,P<0.01),见图4。
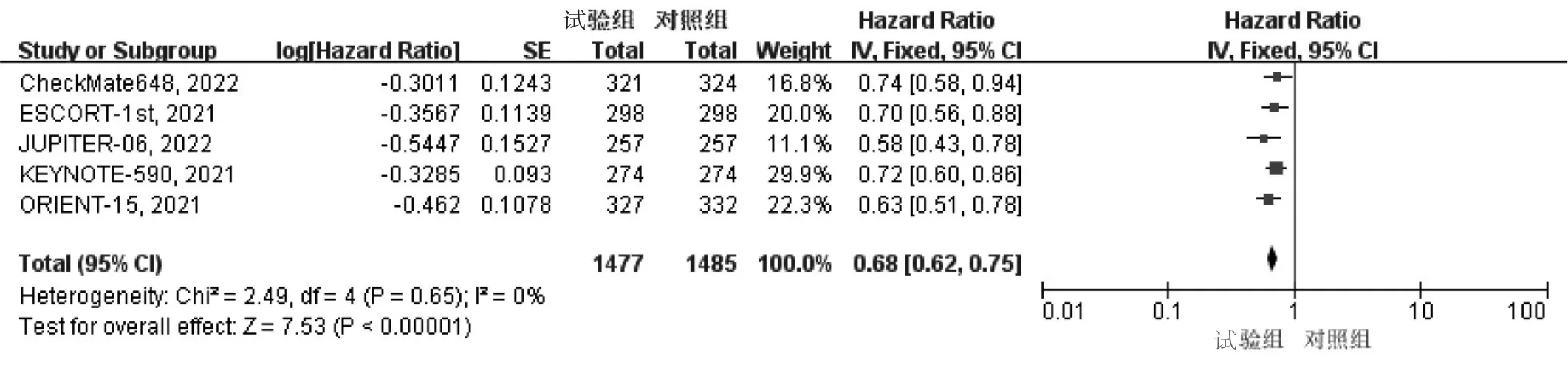
图2 两组患者OS的Meta分析
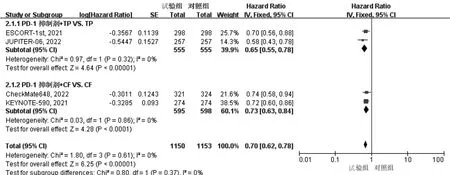
图3 PD-1抑制剂联合TP或CF方案化疗患者OS的亚组分析
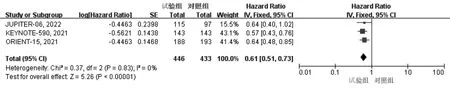
图4 PD-L1 CPS≥10时两组患者OS的亚组分析
2.3.2 PFS 纳入的5篇文献均报道了PFS,异质性检验结果显示P>0.05,I2<50%,采用固定效应模型。与对照组相比,试验组患者PFS显著延长(HR=0.62,95%CI:0.56~0.68,P<0.01),见图5。
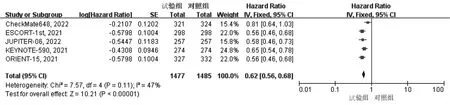
图5 两组患者PFS的Meta分析
2.3.3 ORR 纳入的5篇文献均报道了ORR,异质性检验结果显示P<0.01,I2>50%,采用随机效应模型。结果显示,试验组患者ORR是对照组的1.42倍,两组差异有统计学意义(RR=1.42,95%CI:1.23~1.63,P<0.01),见图6。
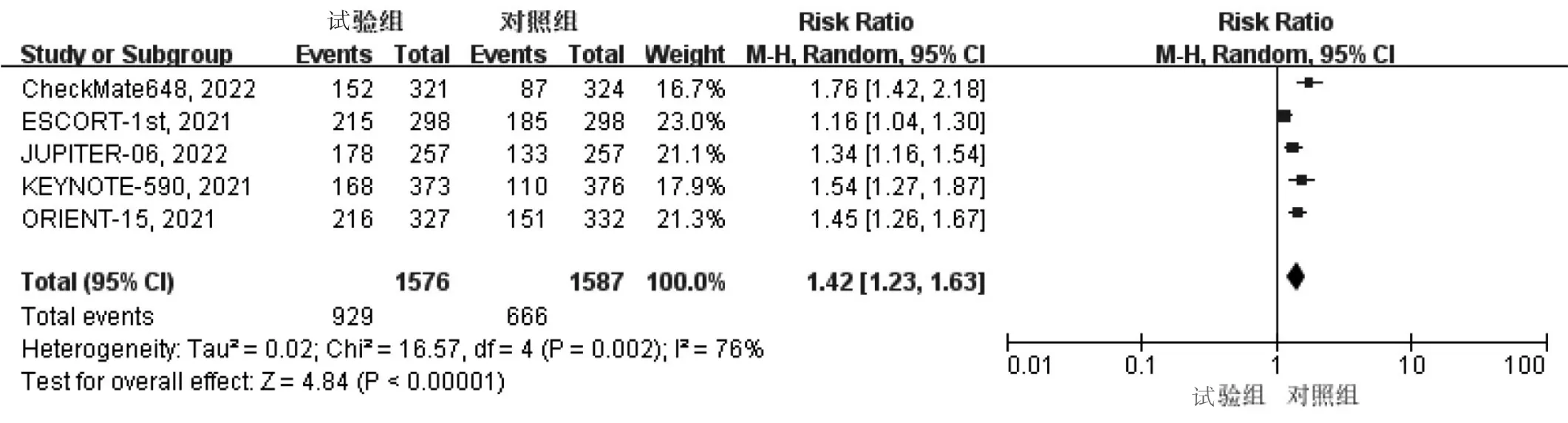
图6 两组患者ORR的Meta分析
2.3.4 3~5级不良反应 纳入的5篇文献均报道了3~5级不良反应,异质性检验结果显示P<0.01,I2>50%,采用随机效应模型。结果显示,试验组患者3~5级不良反应是对照组的1.13倍,两组差异无统计学意义(RR=1.13,95%CI:0.98~1.30,P>0.05),见图7。
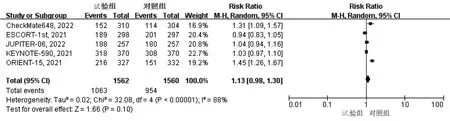
图7 两组患者3~5级不良反应的Meta分析
2.4 发表偏倚风险评估 采用Egger回归法和Begg秩相关法评价,两组患者OS的漏斗图显示,无明显发表偏倚(Beggr回归:P>0.05;Egger秩相关:P>0.05),见图8。
图8 两组患者OS的漏斗图
3 讨论
目前晚期ESCC一线治疗仍以含铂双药化疗为主,但临床获益有限,中位OS仅为1年左右,迫切需要新的药物和治疗方案来延长患者的生存期。ESCC中肿瘤细胞PD-L1表达丰富[16],约在50%的晚期患者中可检测到PD-L1表达≥1%[17]。近年来,以PD-1抑制剂为代表的肿瘤免疫治疗为ESCC患者的生存带来巨大转机。1992年Ishida等[18]发现PD-1广泛分布于CD4+T、CD8+T细胞表面,经与分布于肿瘤细胞和抗原提呈细胞表面的PD-L1结合后,直接抑制T细胞激活通路[19]。肿瘤细胞利用PD-1对组织的天然保护生理特性,促使PD-L1表达上调,以保护自身免受免疫系统监视及杀害,从而发生免疫逃逸,此过程即适应性免疫抑制[20]。即PD-1抑制剂可通过阻断PD-1的负性免疫调节机制,使T细胞恢复免疫活性,从而发挥抗肿瘤效应。目前,免疫治疗已从晚期EC的后线推进到二线、一线,乃至局部晚期的围手术期治疗。在用药方案上,也从单药向联合方案探索。然而,肿瘤的免疫治疗仍存在一些关键问题未能解决,如如何全面评估患者的免疫状态、寻找预测免疫治疗效果的生物标志物及最佳截断值;当前的免疫治疗与化疗联合应用时,如何确定具体化疗方案;如何管理免疫治疗的毒性等。本研究旨在通过系统评价进一步验证PD-1抑制剂联合化疗在晚期ESCC患者一线治疗中的作用和安全性。
本研究共纳入5项RCT研究进行系统评价,与对照组相比,试验组PFS、OS显著延长,ORR有效提高。Xu等[21]的一项多中心、单臂、Ⅱ期临床试验结果显示,替雷利珠单抗联合化疗一线治疗晚期ESCC和Gastric or Gastro-oesophageal junction(G/GEJ)腺癌时,ESCC 患者的中位缓解持续时间为12.8个月,ESCC和G/GEJ腺癌的客观缓解率和疾病控制率分别为46.7%和80.0%。联合治疗相关的不良反应主要为贫血、食欲下降、恶心和乏力,无新发不良反应。该项研究肯定了替雷利珠单抗联合化疗在晚期ESCC或G/GEJ腺癌患者中持久的反应性和可控的耐受性,为替雷利珠单抗联合化疗在晚期EC一线治疗中的应用奠定了基础。本研究根据联合的化疗方案不同进行亚组分析,结果发现与PD-1抑制剂联合CF方案化疗相比,PD-L抑制剂联合TP方案化疗存在更强的协同效应,在延长患者OS方面获益更显著。多项转化研究发现,TP方案化疗可以更多诱导肿瘤细胞的免疫原性死亡,触发正向的免疫反应,从而更容易激活免疫杀伤作用[22-24]。提示PD-1抑制剂联合化疗一线治疗晚期ESCC患者时,化疗方案可优先选择TP方案。筛选PD-1抑制剂的最大获益人群是目前主要研究方向,肿瘤细胞中PD-L1的表达是预测PD-1抑制剂治疗效果的有效生物标志物。PD-L1表达水平可以通过CPS来评估,CPS评分综合考虑了肿瘤和免疫细胞的因素,是根据PD-L1阳性细胞(肿瘤、淋巴和巨噬细胞)数与肿瘤细胞数的比值来进行评估。本研究根据PD-L1 CPS表达水平进行亚组分析,结果发现在PD-L1 CPS≥10时,试验组患者在延长OS方面获益更显著。这结果符合2022年CSCO食管癌诊疗指南推荐,对拟采用PD-1抑制剂治疗的ESCC患者推荐癌组织中评估PD-L1表达CPS评分,截断值为CPS≥10作为阳性标准。然而,ESCORT-1st研究结果发现PD-L1的表达水平与卡瑞利珠单抗的疗效之间没有明确的相关性。可见PD-L1表达水平是一个预测因子,而不是驱动性生物标志物,这可能与TILs的参与有关。在肿瘤发展和各种治疗的应用过程中,TILs迁移到肿瘤组织中作为抗肿瘤反应的效应物,肿瘤微环境中高水平的TILs已被证实与食管癌等肿瘤患者更好的预后相关[25]。
本研究比较了PD-l抑制剂联合化疗与单独化疗在晚期ESCC患者中的不良反应,结果发现文献中提到的治疗相关不良反应主要包括皮疹、肺炎、脱发、贫血、恶心、腹泻、食欲下降、肌痛、中性粒细胞减少症。与对照组相比,试验组无新发不良反应,未显著增加3~5级不良反应。总体而言患者耐受性较好。
本研究仍存在局限性,受患者特征、治疗细节(药物、剂量、治疗周期等)复杂性的影响,研究间存在一定异质性;各项临床研究本身的差异限制了研究结果的推广及各研究间的可比性,使得一些亚组的纳入文献较少或样本量相对较小,这可能会对结论的可靠性造成影响。
综上所述,本研究通过Meta分析肯定了PD-1抑制剂联合化疗在晚期ESCC一线治疗中的临床获益,相对单独化疗,PD-1抑制剂联合化疗可显著延长晚期ESCC患者的OS、PFS,提高ORR,安全性良好。未来仍需要更多高质量、大样本的RCT来证实这一结论。
