小鼠Nr1d1基因生物信息学分析及其慢病毒干扰载体的构建
2022-02-04李雅婷江海圳高登科靳亚平陈华涛
李雅婷,张 靖*,江海圳,高登科,李 超,靳亚平,陈华涛*
(1.西北农林科技大学 动物医学院,陕西 杨凌 712100;2.农业农村部 动物生物技术重点实验室,陕西 杨凌 712100)
【研究意义】NR1D1(nuclear receptor subfamily 1,group d member 1)是核受体家族的一员,最早于1989 年被发现,由于Nr1d1位于禽红母细胞增生症病毒中甲状腺激素受体α 基因(v-erbα 癌基因)互补链的相应位置,因此又称为Rev-erbα[1]。NR1D1 是一种重要的生物钟系统组分,其作为转录抑制因子参与调控多种机体生理功能,包括炎症反应[2]、脂肪代谢[3]、癌症发生[4]以及大脑皮质发生[5]等。此外,NR1D1 还参与了对药物的昼夜代谢调控,这在时间药理学中具有重要意义[6]。近年来陆续发现NR1D1的天然配体血红素(heme)以及一些人工合成的配体如GSK4112、SR9009 及SR9011 等,在体内可激活NR1D1 的转录抑制作用,从而发挥其药理活性[7]。因此,对NR1D1 的生物学功能进行更深入的研究将有助于揭示某些疾病的致病机理,为昼夜节律紊乱相关疾病的诊断和治疗提供新的思路和研究方向。【前人研究进展】在调控生物钟系统节律性振荡的过程中,NR1D1 通过直接抑制核心生物钟组分芳香烃受体核运样蛋白(brain and muscle arnt-like 1,BMAL1)的表达,形成了一个重要的负反馈环[8]。近期研究发现,在自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)中,调节NR1D1 活性可以调控辅助性T 细胞17(T helper 17,Th17)细胞中NR1D1 与酪氨酸激酶样孤儿受体(receptor tyrosine kinase like orphan receptor,ROR)反应元件的结合能力,从而影响EAE 的发展[9];Nr1d1基因全身性敲除小鼠具有脂质代谢异常的表型,表现为肝脏甘油三酯和游离脂肪酸增加[10];同时有研究发现NR1D1 的激活能抑制乳腺癌细胞的增殖[11]。此外,在Nr1d1基因敲除小鼠中发现皮质神经元在皮质形成过程中位置异常,并且皮质层神经元的轴突延伸和树突杆形成也受到抑制,说明NR1D1 的功能缺陷可能与自闭症谱系障碍(autism spectrum disorder,ASD)的病因有关[12]。【本研究切入点】慢病毒是逆转录病毒科的成员,其特点是利用病毒逆转录酶和整合酶稳定地将病毒基因组信息插入到宿主基因组。来自不同物种的慢病毒在基因组结构和致病性方面具有不同的特性,而HIV-1 型慢病毒载体系统因其具有制毒周期短、感染效率和外源基因整合效率高的特性在实验中最常被使用[13-14]。因此本试验通过构建Nr1d1基因的慢病毒干扰载体,经转染及筛选之后形成稳定抑制Nr1d1表达的细胞株。【拟解决的关键问题】本研究首先对小鼠Nr1d1基因进行生物信息学分析,并进一步构建小鼠Nr1d1基因的慢病毒干扰载体,在NIH3T3 细胞上验证慢病毒干扰载体的有效性,筛选出干扰效率最优的载体,为进一步研究小鼠Nr1d1基因的生物学功能提供前期理论基础和关键材料支撑。
1 材料与方法
1.1 主要材料
pCD513B-U6 慢病毒干扰质粒及辅助质粒(pGag/Pol、pRev、pVSV-G)均保存于西北农林科技大学农业农村部动物生物技术重点实验室。大肠杆菌DH5α 感受态细胞购自北京擎科生物科技有限公司,HEK293T细胞和NIH3T3细胞由中国科学院细胞库提供。
1.2 主要试剂
高糖DMEM 培养基购自上海源培生物科技股份有限公司;琼脂糖凝胶DNA 回收试剂盒、无内毒素质粒提取试剂盒均购自北京天根生化科技有限公司;PrimerSTAR®GXL DNA Polymerase、限制性内切酶(EcoRI 和BamHI)和Solution1 连接酶购自宝生物工程(大连)有限公司;胎牛血清(FBS)、胰蛋白酶、PBS缓冲液、青霉素-链霉素-两性霉素B混合液和TurboFect Transfection Reagent 均购自美国ThermoFisher公司;Opti-MEM 培养基购自美国Gibco公司;RIPA裂解液、EDTA、蛋白酶抑制剂、磷酸酶抑制剂和PMSF均购自碧云天生物技术有限公司;BCA 蛋白含量检测试剂盒购自凯基生物公司;脱脂奶粉购自美国BD 公司;兔源NR1D1 抗体购自美国Abcam 公司;鼠源β-actin 抗体购自中国三箭公司;HRP 共轭羊抗兔抗体、HRP共扼羊抗鼠抗体购自中国中杉金桥公司;ECL HRP底物试剂盒购自北京迪宁生物科技有限公司。
1.3 实验方法
1.3.1 生物信息学分析 应用NCBI 数据库查找小鼠、大鼠、人、黑猩猩、马、牛、绵羊、山羊、犬、兔、猪和斑马鱼等物种的NR1D1核苷酸和氨基酸序列;应用DNAstar软件制作同源性分析矩阵图;通过MEGA 软件构建系统进化树;利用ExPasy 相关在线程序(https://web.expasy.org/protparam/)分析小鼠Nr1d1基因编码蛋白的氨基酸组成;应用SOPMA 在线程序(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测小鼠NR1D1蛋白的二级结构;应用SWISS-MODEL 在线程序(https://swissmodel.expasy.org/interactive)预测小鼠NR1D1 蛋白的三级结构;应用STRING 在线程序(https://string-db.org/)预测小鼠NR1D1蛋白的相互作用蛋白。
1.3.2 shRNA 的设计与合成 通过ThermoFisher 公司的在线软件(https://rnaidesigner.invitrogen.com/rnaiexpress/),针对小鼠Nr1d1基因mRNA 的核苷酸序列(NM_145434.4)设计4对寡核苷酸干扰靶位点组合序列,并且设计1 条无义序列用作阴性对照[15]。所有序列交由北京擎科生物科技有限公司合成,具体序列如表1所示。

表1 小鼠Nr1d1 shRNA干扰序列Tab.1 Interference sequences of Nr1d1 shRNA in mice
1.3.3 慢病毒干扰载体的构建及验证 将合成好的寡核苷酸单链经退火形成双链shRNA,同时将pCD513B-U6 用BamHI 和EcoRI 限制性核酸内切酶进行双酶切反应,回收酶切产物,利用Solution1 连接酶将双链shRNA 与线性化的pCD513B-U6 载体进行连接反应。连接体系:线性化的pCD513B-U6 载体3µL、双链shRNA 7µL、Solution1 10µL,混匀后置于16 ℃恒温仪过夜。连接产物分别命名为pCD513BU6-shRNA-Nr1d1-1(sh1)、pCD513B-U6-shRNA-Nr1d1-2(sh2)、pCD513B-U6-shRNA-Nr1d1-3(sh3)、pCD513B-U6-shRNA-Nr1d1-4(sh4)、pCD513B-U6-shRNA-NC(shn)。连接完成后与20µL 的DH5α 进行转化、挑菌、摇菌并提取质粒[15]。然后以所提取的质粒为模板进行PCR 鉴定,鉴定正确后进行测序验证,测序鉴定引物如表2所示:

表2 pCD513B-U6测序引物序列Tab.2 Sequencing primer sequences of PCD513B-U6
1.3.4 慢病毒包装及滴度测定 复苏HEK293T 细胞后,分别取3×105个细胞重新接种于35 mm 的细胞培养皿中,24 h后待细胞生长至60%~70%时进行转染。取5个200µL 的无菌EP 管,分别取50µL Opti-MEM 培养基至准备好的EP 管中,加入6 µL 转染试剂Turbofect,缓慢吹打混匀后静置5 min,将重组质粒与辅助质粒pGag/Pol、pRev、pVSV-G 按照质量比3∶1∶1∶1 的比例先后加入EP 管并缓慢吹打混匀,室温静置20 min 后,逐滴加入铺有HEK293T 细胞的35 mm 的细胞培养皿中。16 h 后更换为完全培养液,24 h 后观察细胞中绿色荧光蛋白(green fluorescent protein,GFP)的表达情况,48 h 后收集细胞上清培养液,2 000 r/min 离心5 min 吸取上清,即为病毒上清,用0.22 µm 的滤器过滤、分装后置于-80 ℃保存备用。使用前需测定病毒滴度,具体操作步骤如下:将HEK293T 细胞按5×103个每孔接种至96 孔板,待细胞密度达到30%时,分别加入梯度稀释倍数为1×101~1×108的病毒液,8 h 后更换为完全培养液,48 h 后观察含有GFP 阳性细胞的个数。病毒滴度(TU/mL)=平均GFP 阳性细胞数(C)×稀释倍数(D)/接种病毒的体积(V)[16-17]。
1.3.5 慢病毒感染NIH3T3 细胞及抗性细胞克隆的筛选 在将包装好的病毒感染NIH3T3 细胞前,需进行NIH3T3 细胞感染复数(multiplicity of infection,MOI)的筛选,具体操作步骤如下:将状态良好的NIH3T3细胞按5×103个每孔接种至24孔板,以含不同MOI(0、20、30、40、50、60、70)的慢病毒原液的培养液感染细胞,每个MOI设置3个复孔。48 h后,在荧光显微镜下观察GFP表达情况,GFP表达80%以上且不影响细胞正常生长的最低MOI,则为慢病毒转染的最佳MOI。确定最佳MOI后,取NIH3T3 细胞3×105个重新接种于35 mm 的细胞培养皿中,24 h 后待细胞生长至60%~70%时,将包装好的重组慢病毒颗粒(shn、sh1、sh2、sh3、sh4)按筛选出的最佳MOI 感染细胞,同时加入终浓度为10µg/µL 聚凝胺(polybrene)增强感染效率,而空白对照组则加入相同体积的细胞完全培养液。感染48 h后观察GFP表达情况,并用1.2µg/mL的嘌呤霉素对空白对照组和实验组进行抗性细胞克隆的筛选[16-19]。
1.3.6 Western Blotting 检测小鼠NR1D1 蛋白表达水平 收集筛选后的细胞提取总蛋白进行Western Blotting 检测。首先裂解收集的细胞,裂解液配制:每1 mL 裂解液按照说明书加入20 µL 磷酸酶抑制剂,20 µL 蛋白酶抑制剂,20 µL EDTA 和10 µL 100 mmol/L PMSF 以及930 µL RIPA。混匀后,冰上保存待用。取出收集好的细胞样品加入适量的细胞裂解液,吹打混匀,充分震荡后置于冰上5 min,反复操作4~5 次后,4 ℃、12 000 r/min 离心10 min,吸取上清至新预冷的1.5 mL 离心管中,置于冰上,即为蛋白样本。依据凯基BCA 蛋白含量检测试剂盒的说明进行操作,计算得到蛋白浓度。将蛋白样品与一定量的5×SDS-PAGE 上样缓冲液在EP 管中混匀,并于95~100 ℃沸水中煮10 min,室温冷却,离心备用。
蛋白样品处理结束后进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分离总蛋白并将其转移到PVDF 膜上。将PVDF 膜用经TBST 稀释的10%的脱脂奶粉室温封闭2 h 后,用TBST 清洗4 次,每次5 min,之后用NR1D1抗体工作液(1∶3 000)进行孵育过夜。第2天取出PVDF膜,复温30 min后用TBST清洗4次,每次5 min,清洗后置于稀释好的HRP标记的山羊抗兔IgG二抗(1∶5 000)中,室温孵育2 h之后TBST清洗4次,每次5 min。加入曝光液显色,使用凝胶成像系统检测蛋白表达情况,并利用ImageJ软件进行蛋白含量灰度分析。接着将PVDF 膜使用蛋白洗脱液洗脱5~10 min后,TBST 清洗4次,每次5 min,洗净后在β-actin抗体工作液(1∶5 000)中室温孵育2 h,TBST 清洗4 次,每次5 min,清洗后置于稀释好的HRP 标记的山羊抗鼠IgG 二抗(1∶5 000)中,室温孵育2 h 之后TBST 清洗4 次,每次5 min。加入曝光液,使用凝胶成像系统检测蛋白表达情况,并利用ImageJ软件进行蛋白含量灰度分析。
1.3.7 统计学分析方法 使用GraphPad Prism 8 对3 次独立实验的实验数据进行绘图和统计学分析,转染pCD513B-U6-shRNA-Nr1d1重组载体的各实验组及pCD513B-U6 空载组数据均符合正态分布,试验数据以3次独立试验的均值±SEM表示,独立样本t检验,P<0.05为差异显著,P<0.01为差异极显著。
2 结果
2.1 生物信息学分析
2.1.1 基因序列分析 应用NCBI 的ORF Finder 程序进行分析,结果表明,小鼠Nr1d1基因编码区全长1 848 bp,可编码615个氨基酸。
2.1.2 相似性比对及系统进化树构建 基因相似性分析结果如图1所示,小鼠Nr1d1基因核苷酸序列与大鼠、人及黑猩猩的相似性分别为94.8%、90.0%和90.0%。系统进化树如图2所示,小鼠Nr1d1基因与大鼠、人及黑猩猩等哺乳动物的遗传距离相对较近,与绵羊、斑马鱼遗传距离相对较远。
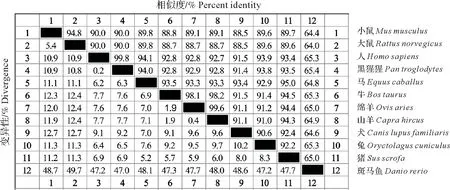
图1 小鼠与其他物种Nr1d1基因相似性比对Fig.1 Comparison of the similarity of the Nr1d1 gene among mice and other species
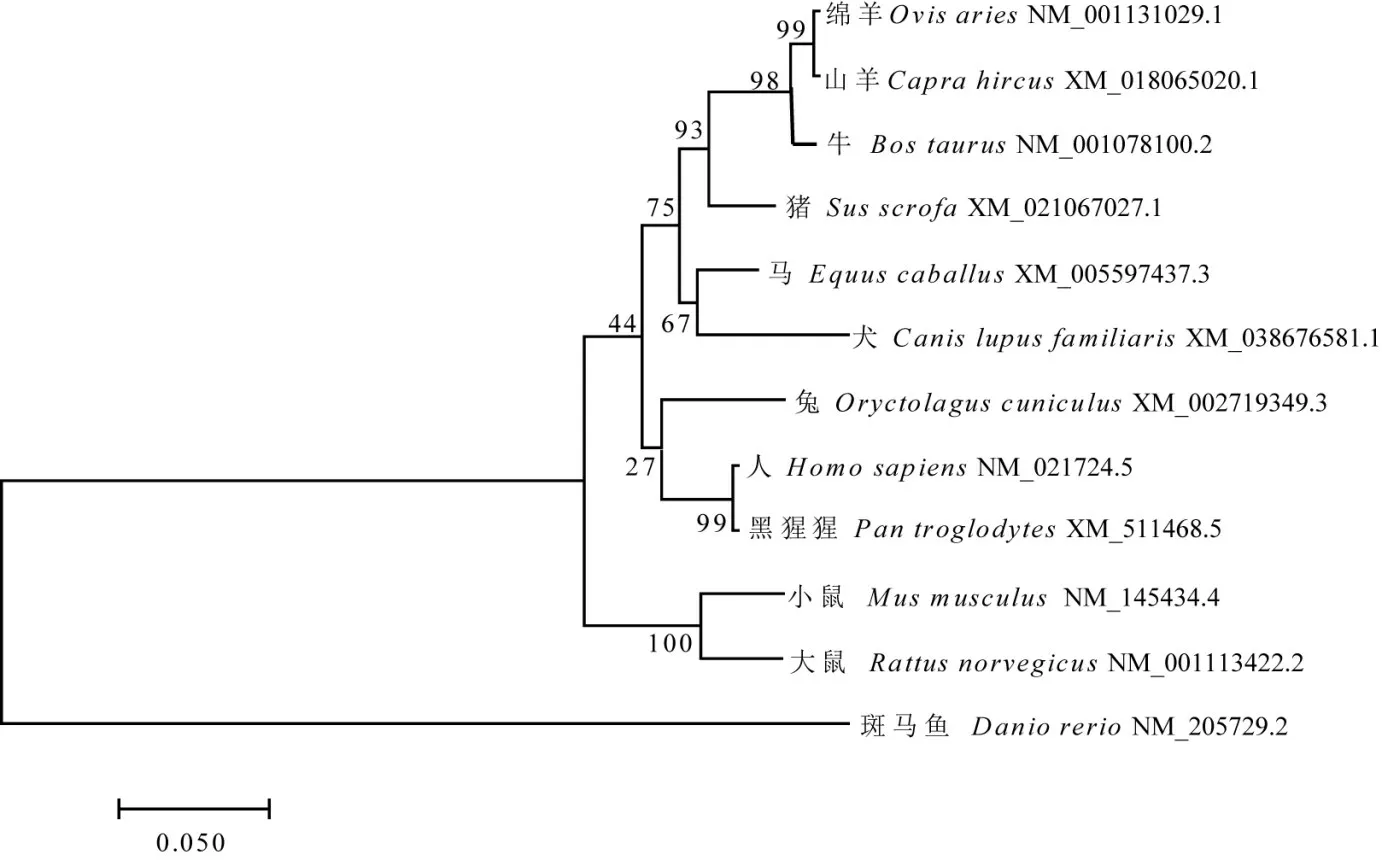
图2 小鼠Nr1d1基因系统进化树Fig.2 Phylogenetic tree of the Nr1d1 gene system in mice
2.1.3 蛋白质理化性质分析 蛋白质理化性质分析结果显示,小鼠NR1D1 蛋白理论相对分子质量为66 802.5,分子式为C2886H4553N845O914S34,理论等电点8.66,属于碱性蛋白;如表3 所示,该蛋白由615 个氨基酸组成,其中丝氨酸含量最高(14.0%),色氨酸含量最低(0.5%)。
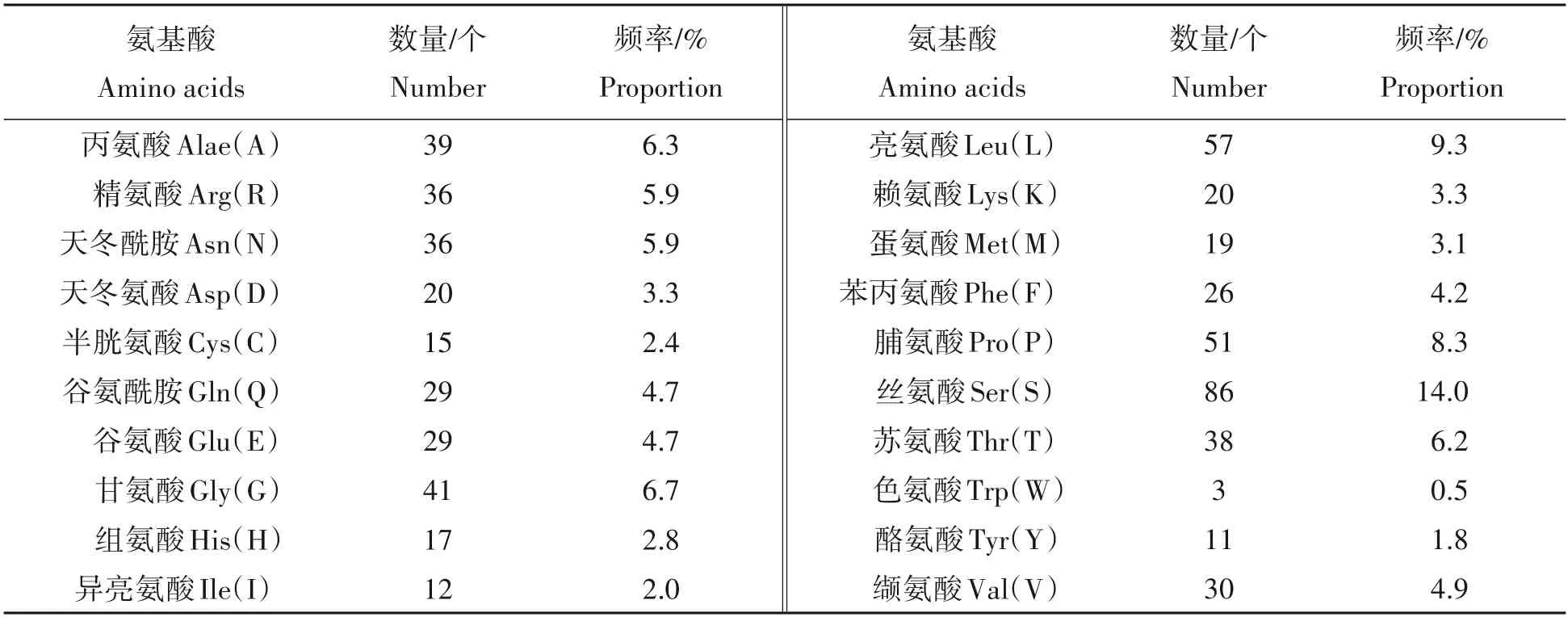
表3 小鼠NR1D1蛋白的氨基酸组成Tab.3 The amino acids composition in mouse NR1D1 protein
2.1.4 二级结构和三级结构预测 对小鼠NR1D1 蛋白二级结构进行预测,结果如图3A 所示,小鼠NR1D1 蛋白二级结构主要为无规则卷曲(54.63%),α-螺旋、延伸链和β-转角分别占26.50%、12.68%和6.18%。对该蛋白三级结构进行预测,结果如图3B所示。
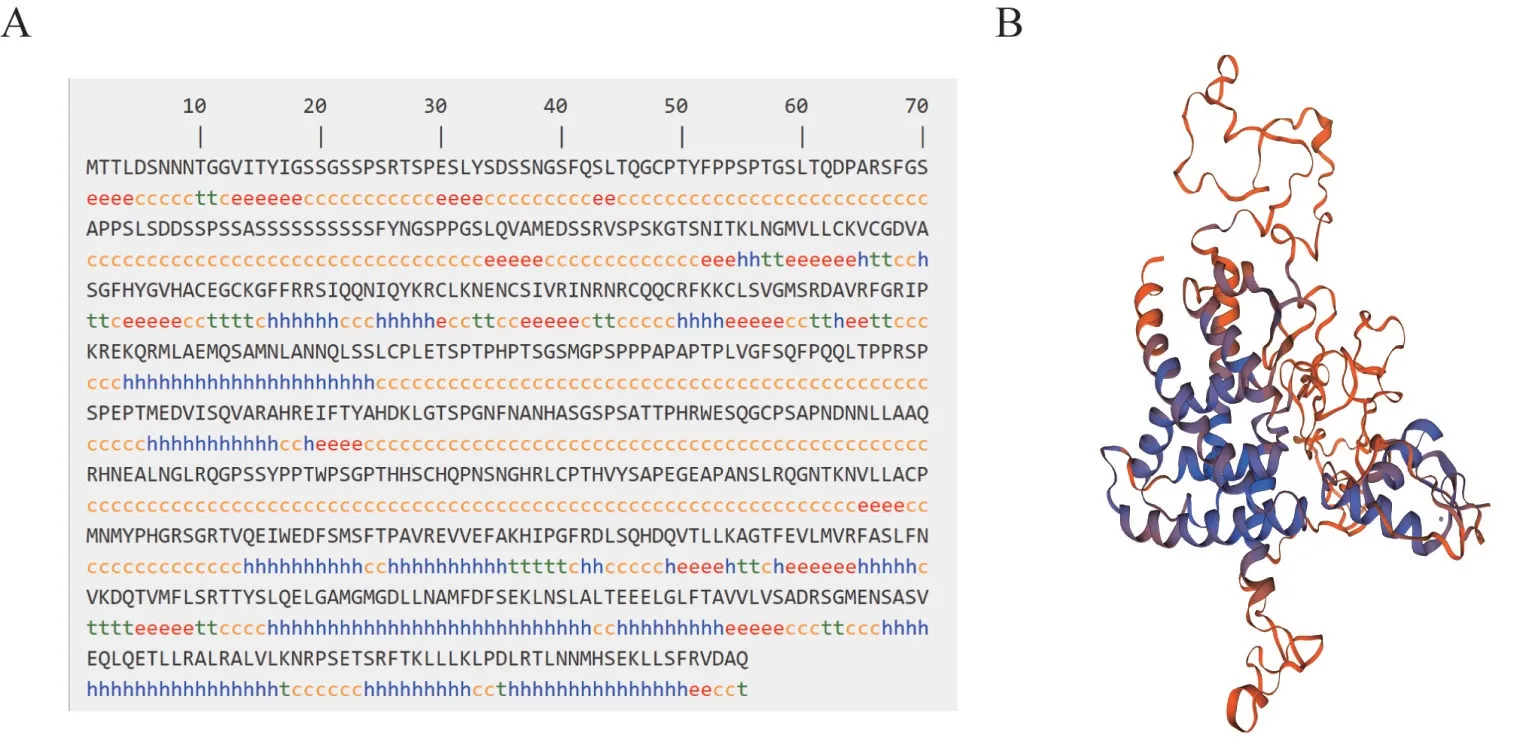
图3 小鼠NR1D1蛋白二级结构和三级结构预测Fig.3 Prediction of the secondary and tertiary structures in mouse NR1D1 protein
2.1.5 NR1D1蛋白相互作用分析 通过STRING在线程序预测NR1D1蛋白的相互作用蛋白,结果如图4所示,与NR1D1蛋白质相互作用的前10个蛋白质分别是芳基烃受体核传送器样分子蛋白(aryl hydrocarbon receptor nuclear translocator-like,ARNTL)、核受体辅助抑制因子1 蛋白(nuclear receptor corepressor 1,NCOR1)和神经元PAS 结构域蛋白2(neuronal PAS-domain protein 2,NPAS2)、时钟蛋白(clock circadian regulator,CLOCK)、隐花色素2 蛋白(cryptochrome 2,CRY2)、基本螺旋-环-螺旋家族成员e41 蛋白(BHLHE41)、过氧化物酶体增殖物激活受体γ辅助激活因子1α蛋白(PPARGC1A)、RAR相关孤儿受体A蛋白(RAR related orphan receptor A,RORA)、组蛋白去乙酰化酶3(HDAC3)、E1A 结合蛋白p300(EP300),并且与NR1D1蛋白相互作用得分较高的蛋白为ARNTL、NCOR1和NPAS2。
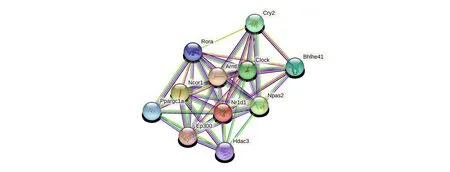
图4 NR1D1蛋白质相互作用网络预测Fig.4 The prediction of the interaction network in mouse NR1D1 protein
2.2 慢病毒干扰载体的构建及验证
通过对所提取的质粒进行PCR 鉴定,凝胶电泳检测结果如图5A 所示,pCD513B-U6 空载体的PCR产物大小大约为300 bp,含有干扰片段的重组质粒的PCR 扩增产物大小约为360 bp,与预期结果一致。通过对各质粒进行测序验证,结果显示成功构建了4个慢病毒干扰载体和1个阴性对照载体。测序图谱见图5B。
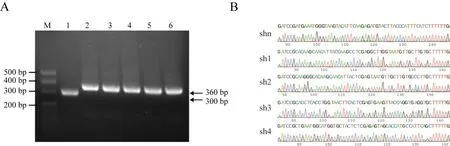
图5 pCD513B-U6-shRNA-Nr1d1重组载体序列鉴定Fig.5 Sequence identification of recombinant vector pCD513B-U6-shRNA-Nr1d1
2.3 慢病毒包装及滴度测定
将重组质粒sh1、sh2、sh3、sh4 和shn 分别与慢病毒包装辅助质粒pGag/Pol、pRev 和pVSV-G 共转染HEK293T 细胞,收毒后将慢病毒颗粒梯度稀释转染HEK293T 细胞,48 h后在荧光显微镜下观察,结果如图6所示,细胞状态正常,荧光显微镜观察到明显的GFP 表达,并对含有GFP 的阳性细胞进行计数,最终测定的病毒的滴度均在7×107TU/mL以上,可用于后续试验。
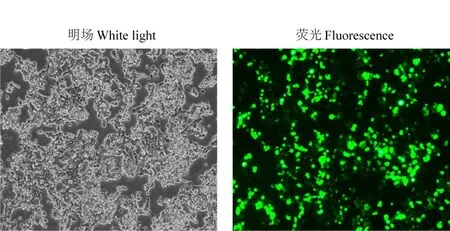
图6 慢病毒包装HEK293T细胞48 h后可见GFP表达(100×)Fig.6 GFP expression was observed in HEK293T cells packed with lentivirus for 48 h(100×)
2.4 慢病毒感染NIH3T3细胞
按上述方法筛选出NIH3T3 细胞慢病毒的最佳MOI 值为50。将病毒颗粒按MOI=50 和转染增强剂Polybrene一同感染NIH3T3细胞,结果如图7所示,感染48 h后荧光显微镜下观察到明显的GFP表达。
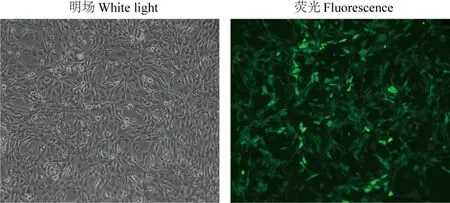
图7 病毒上清感染NIH3T3细胞48 h后可见GFP表达(100×)Fig.7 GFP expression was observed in NIH3T3 cells infected with virus supernatant for 48 h(100×)
2.5 小鼠Nr1d1基因shRNA干扰序列的筛选
分别收集通过嘌呤霉素筛选的4 个shRNA 干扰组及阴性对照组的抗性细胞克隆样品,通过Western Blotting检测NR1D1蛋白表达来验证shRNA的干扰效率。结果如图8A所示,与对照组相比,sh2、sh3、sh4组的NR1D1蛋白表达量均有较为明显的下降,表明所设计的3条序列均有干扰效果。如图8B所示,对3次独立试验的结果进行灰度分析,sh3的NR1D1蛋白表达量下降最大。
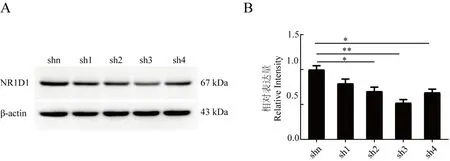
图8 Nr1d1基因shRNA干扰序列的筛选Fig.8 Screening of shRNA interference sequence of Nr1d1 gene
2.6 干扰效率的鉴定
通过Western Blotting 检测shn和sh3细胞克隆的NR1D1蛋白的表达量来鉴定sh3的干扰效率。结果如图9所示,对3次独立实验的结果进行灰度分析,sh3序列的载体干扰效果达到42%。
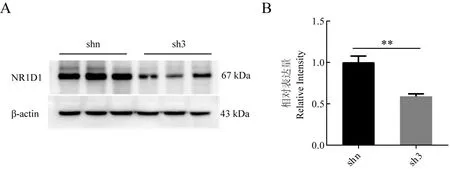
图9 Nr1d1基因shRNA干扰序列效率的鉴定Fig.9 Identification of the efficiency of shRNA interference sequences of Nr1d1 gene
3 结论和讨论
核苷酸序列决定氨基酸序列,氨基酸序列决定蛋白质结构,蛋白质结构决定蛋白质功能[20]。小鼠的Nr1d1基因位于11 号染色体,全长7 475 bp,CDS 区为1 848 bp,编码615 个氨基酸。通过对比分析不同物种的Nr1d1基因序列发现,小鼠Nr1d1核苷酸序列与大鼠、人及黑猩猩的相似性分别为94.8%、90.0%、90.0%,该基因在不同种属间相似性较高,进化上较为保守。小鼠NR1D1 蛋白二级结构主要为无规则卷曲,说明小鼠NR1D1 蛋白结构比较松散。通过STRING 在线程序预测NR1D1 蛋白的相互作用蛋白,分析可知与NR1D1 蛋白相互作用得分最高的蛋白为ARNTL、NCOR1 和NPAS2。ARNTL(又称BMAL1)是生物钟的核心转录因子,与CLOCK 蛋白形成异二聚体,激活数以千计的下游靶基因转录,其中包括周期基因(periods,Pers)和隐花色素基因(cryptochromes,Crys),以及转录抑制因子Nr1d1和Nr1d2等基因[21]。Bmal1基因在维持昼夜血压稳态和调节血管生理功能、代谢、机体免疫功能、软骨细胞合成和稳定维持方面发挥着重要的作用,同时还有文献表明Bmal1基因可作为癌症治疗的一个新靶点[22-23]。NCOR1 是连接染色质修饰酶和基因特异性转录因子的转录辅抑制因子,该调节因子在调节骨骼肌线粒体生物发生和氧化功能中具有重要作用[24-25];自噬通过促进NCOR1 的降解来促进禁食时过氧化物酶体增殖物激活受体α 的激活,从而调节β 氧化和酮体的产生[26]。NPAS2 属于转录调节因子碱性螺旋-环-螺旋/PAS 结构域转录因子家族,人体生物节律形成有赖于NPAS2 的正常表达,研究发现当NPAS2 异常表达时,与昼夜节律紊乱相关的疾病如高血压、代谢综合征、心脑血管疾病等疾病的发病率增加,NPAS2 能够通过对肿瘤相关的生物学通道来影响肿瘤的形成和生长,而且NPAS2 还参与DNA 损伤修复反应[27-28]。NR1D1 的功能与这些相互作用蛋白的功能存在许多重叠,因此本研究可为后续进一步探究NR1D1 的互作蛋白及其所发挥的生物学功能提供前期理论基础。
RNA 干扰(RNA interference,RNAi)是由双链RNA 介导的细胞中mRNA 的特异性降解,进而导致目的基因表达被抑制或沉默的一种自然过程。RNAi技术主要包括小干扰RNA(small interfering RNA,siRNA)、小发夹RNA(short hairpin RNA,shRNA)和双功能shRNA(bi-functional shRNA)。shRNA 由两个互补的19-22 bp 的RNA 序列和一个4-11 nt 的茎环(loop)组成,茎环结构的作用是分隔两个序列。shRNA 能够整合基因组,当发生转录之后,shRNA 被输出到细胞质中并被内源性酶Dicer 识别,Dicer 将shRNA 加工成双链siRNA,然后siRNA 与目的基因mRNAs 结合,并与RNA 诱导沉默复合物合并,从而降解目的基因mRNAs 发挥RNA 干扰效应[29-30]。然而,shRNA 干扰效率主要取决于所设计的shRNA 靶序列,同一基因的不同靶序列所产生的干扰效率是存在较大差异的,因此针对目的基因设计高效特异性的shRNA 序列是保证良好干扰效率的关键步骤[31]。shRNA 的设计应遵循以下几点原则:(1)两个互补的寡核苷酸两端须带有限制性酶切位点;(2)shRNA 序列的第一个碱基必须是G 以确保RNA 聚合酶转录。如果不以G 开头,则必须在正义链的上游加入一个G;(3)在正义链和反义链序列上不能出现连续4 个或以上的A 或者T,这可能导致转录的提前终止;(4)选取的碱基序列中GC 含量应为40%~60%左右,含量大约在45%时最佳[32]。本试验中成功构建了4 个pCD513B-U6-shRNA-Nr1d1慢病毒质粒,其中sh3 干扰效率相对较高,而造成sh1、sh2、sh4 干扰效率相对较低的原因可能是选取的shRNA 碱基序列中GC 含量相对较高,进而影响了其干扰效率。其次在小鼠Nr1d1基因shRNA 序列设计时,需要将靶序列和相应的基因组数据库进行比较,以确保靶序列与其他基因没有同源性,不会对其他非相关基因发生抑制作用,但在本研究中没有对此进行比较,因此可能会造成干扰效率相对较低的结果。但是本研究采用了慢病毒干扰载体构建时的常规做法,对一个目的基因设计了多个靶序列的shRNA,并通过筛选得到干扰效率相对较高的shRNA 序列。
慢病毒载体已成为基础生物学、功能基因组学和基因治疗中应用最广泛的载体之一。相比其他逆转录病毒,慢病毒的优点显而易见,慢病毒有着相对广泛的宿主,无论是对分裂或非分裂细胞均具有感染能力,且具有制毒周期短、感染效率和外源基因整合效率高的优点,是高效导入外源基因的方法[13,33-34]。HIV-1 型慢病毒载体系统发展至今,共经历了3 个阶段,本研究使用的是第3 代慢病毒载体系统。第3 代慢病毒载体系统包含4 个质粒,即pGag/Pol、pRev、pVSV-G,以及一个放置目的序列的质粒载体。同时该体系将tat 基因去除,这使意外产生活性病毒的可能性大大降低,生物安全性大大提高[35]。在本试验中慢病毒将载体携带的shRNA-Nr1d1基因转导至NIH3T3 细胞,使其插入到细胞的基因组中并稳定表达,通过嘌呤霉素的筛选得到抑制Nr1d1基因表达的细胞克隆,继续培养和传代该细胞克隆形成稳定的抑制Nr1d1表达的细胞株。对转导后的NIH3T3 细胞进行Western Blotting 检测,结果显示构建的3 个慢病毒干扰载体均能有效抑制Nr1d1基因的表达,并且挑选出干扰效果最好的sh3作为后续试验的干扰载体。
本研究对Nr1d1基因及其表达的蛋白质进行了系统的生物信息学分析,成功构建并筛选出干扰效率最优的小鼠Nr1d1基因慢病毒干扰载体,为进一步探究小鼠Nr1d1基因的生理功能提供了理论基础和材料支持。
