施肥与光照对枫香栽培土壤酶活性及其化学计量比的影响
2022-02-04张绿水陈伏生郭春兰王方超
刘 俏,刘 仁,张绿水,陈伏生,郭春兰,王方超
(1.江西农业大学 林学院/江西省森林培育重点实验室,江西 南昌 330045;2.江西农业大学 鄱阳湖流域森林生态系统保护与修复国家林业和草原局重点实验室,江西 南昌 330045;3.南昌大学 管理学院,江西 南昌 330045)
【研究意义】土壤胞外水解酶是土壤微生物在获取能量或养分时分泌的一系列酶,在催化土壤碳(C)、氮(N)和磷(P)转化中扮演着重要角色[1-2]。土壤酶活性可有效改善土壤质量,同时也受到环境因素的影响而发生改变。土壤胞外酶化学计量比,即胞外水解酶活性的比值,反映了环境中限制性养分的有效性和微生物对养分获取之间的生物地球化学平衡模式[3],是土壤酶学研究的前沿和热点[4]。【前人研究进展】施肥是影响苗木生长的重要措施之一,N和P作为苗木生长所需要的基本矿质营养元素,对苗木生长发育和土壤养分循环具有重要影响[5]。外源添加N 肥和P 肥可维持苗木生长以及土壤养分供给,有利于改变苗木生物量分配、土壤理化性质和微生物群落组成,进而改变土壤酶活性及其化学计量比。曾泉鑫等[6]研究发现,N添加降低β-乙酰氨基葡萄糖苷酶(NAG)活性和酶N/P,增加酶C/N,然而Chen等[7]却发现N 添加增加酶C/N,却对酶N/P 和酶C/P 无影响。亚热带杉木人工林N、P 添加研究表明,N 添加可显著提高土壤NAG 活性,而P 添加显著提高土壤酸性磷酸酶(AP)活性[8]。也有研究表明,在华南地区N、P 添加对人工林土壤NAG 和亮氨酸氨基肽酶(LAP)活性无显著影响[9]。施肥对土壤酶活性及其化学计量比的研究在国内外一直都是热点问题[10-11]。光照是影响苗木生长的另一重要环境因素,光照的改变会影响苗木生长发育、各器官生物量分配以及土壤温湿度等。一方面,研究表明光照的减弱通过降低植物的光合作用,进一步影响光合速率以及地下生物量的分配,显著降低根际激发效应,从而改变酶活性及其化学计量比[12-13];另一方面,有研究发现光照的减弱会改变土壤温湿度,进一步影响土壤酶活性及其化学计量比[14]。Xu等[15]研究表明,土壤BG 和NAG 活性与年平均气温和降水量显著负相关。刘仁等[16]研究也发现土壤酶活性及其化学计量比与含水率显著相关。【本研究切入点】枫香(Liquidambar formosanaHance)是我国亚热带落叶乡土阔叶树种,适应性强、种植历史长、观赏价值高、应用范围广,具有较高的生态和经济效益[17]。苗木生产是林业生产中的重要部分,施肥与光照调控措施是培育枫香优良苗木的关键管理手段。施肥对土壤酶活性及其化学计量比的影响已有一定研究,但施肥和光照对土壤酶活性及其化学计量比的交互作用及其影响机制尚不清楚。【拟解决的关键问题】基于此,本文采用盆栽试验法,重点研究N、P 肥添加和不同光照强度对苗木各器官生物量、土壤理化性质和C、N、P 转化酶活性及其化学计量比的影响,探究施肥和光照如何交互影响土壤酶活性及化学计量比,并且共同驱动哪几个土壤变量主导酶活性及化学计量比的变化。研究结果可为理解土壤胞外酶化学计量变异以及枫香苗木栽培提供支持和参考。
1 材料与方法
1.1 试验地与试验材料
试验地设于江西省南昌市江西农业大学校园(28°46′N,115°49′E),海拔约45 m。该区属亚热带季风湿润性气候,气候温和、降雨充沛。年均气温17.4 ℃,年均日照时数约1 800 h,年均降水量约1 650 mm,年均无霜期260 d[18]。
试验苗木是由江西省南昌市苗圃公司提供的一年生枫香苗,平均地径和株高分别为7.33 mm 和53.76 cm。试验用盆为不透光双桶育苗盆,上下大小规格一致,上端内径30.0 cm、下端内径20.5 cm、高30.0 cm,上桶用于种植,下桶用于蓄水。盆栽用土为当地典型红壤:pH为5.32、有机碳(OC)为7.26 g/kg、全氮(TN)为0.55 g/kg、全磷(TP)为0.10 g/kg、铵态氮(NH4+-N)为1.23 mg/kg、硝态氮(NO3--N)为0.35 mg/kg、有效磷(Olsen-P)为0.40 mg/kg。
1.2 试验设计
本试验于2019年3月下旬随机选取长势均匀的一年生枫香苗移植于双桶盆栽容器中,待缓苗后,于4 月下旬进行施肥及遮阴处理,采用双因素(施肥和光照强度)3 水平随机化试验。其中光照强度设置100%光照(无遮阴网)、60%光照(一层遮阴网)和20%光照(两层遮阴网)3种处理;在每个光照强度下设置3种施肥处理:不施肥、施N肥和施P肥,共计9处理,每种处理10盆。施肥处理每两个月(5月、7月、9月)进行一次,共3 次,N、P 肥添加的量和形式分别是每盆每次1.00 g NH4NO3和0.99 g NaH2PO4[19],将各施肥处理所需的肥料溶解至1 L的水,均匀浇灌在土壤表面,不施肥则浇灌相同体积的水。期间,各处理管理方式均一致。
1.3 样品采样与分析
1.3.1 土壤样品采集与处理 于2019 年10 月底进行破坏性取样,每种处理随机选取5 盆。首先采用挖掘法将枫香幼苗全部取出,后将植物和土壤装入编好号的对应自封袋中,带回实验室。将采集的植物样品分为叶、茎和根,放入烘箱105 ℃杀青,后80 ℃烘干至恒重,用以测定各器官生物量。土壤样品过2 mm 筛用以去除植物根系和凋落物等肉眼可见的杂物,其中的一部份立刻用于含水量(SMC)的测定;一部分鲜土放入4 ℃冰箱,用于测定NH4+-N、NO3--N 以及土壤酶活性;另一部分自然风干,用于测定pH、Olsen-P、OC、TN、TP含量。
1.3.2 土壤理化性质测定 SMC采用烘干称量法测定;pH值(土水比1∶2.5)用pH计测定;OC采用高锰酸钾-硫酸亚铁滴定法;TN和TP用HClO4-H2SO4消煮,连续流动分析仪测定;NH4+-N和NO3--N用2 mol/LKCl浸提(土液比1∶5),Olsen-P采用NH4F-HC(l土液比1∶5)浸提,连续流动分析仪测定[11]。
1.3.3 土壤酶活性测定 土壤5种水解酶活性采用微孔板荧光法测定,每种酶的缩写与活性底物如表1所示。在1.5 g新鲜土壤中加入100 mL 的乙酸钠缓冲液(50 mol/L,pH=4.5),涡旋振荡器上震荡1 min,磁力搅拌5 min,用以制备土壤悬浮液。然后使用移液枪在96微孔板中加入200µL的土壤悬浮液和50µL的底物溶液。将微孔板置于20 ℃黑暗条件下培养4 h,为停止反应,每个孔中加入10µL 的NaOH 溶液(1 mol/L),静置1 min 后,用多功能酶标仪(SpectraMax M2,美国)在365 nm 下荧光激发,450 nm 下荧光检测[20]。
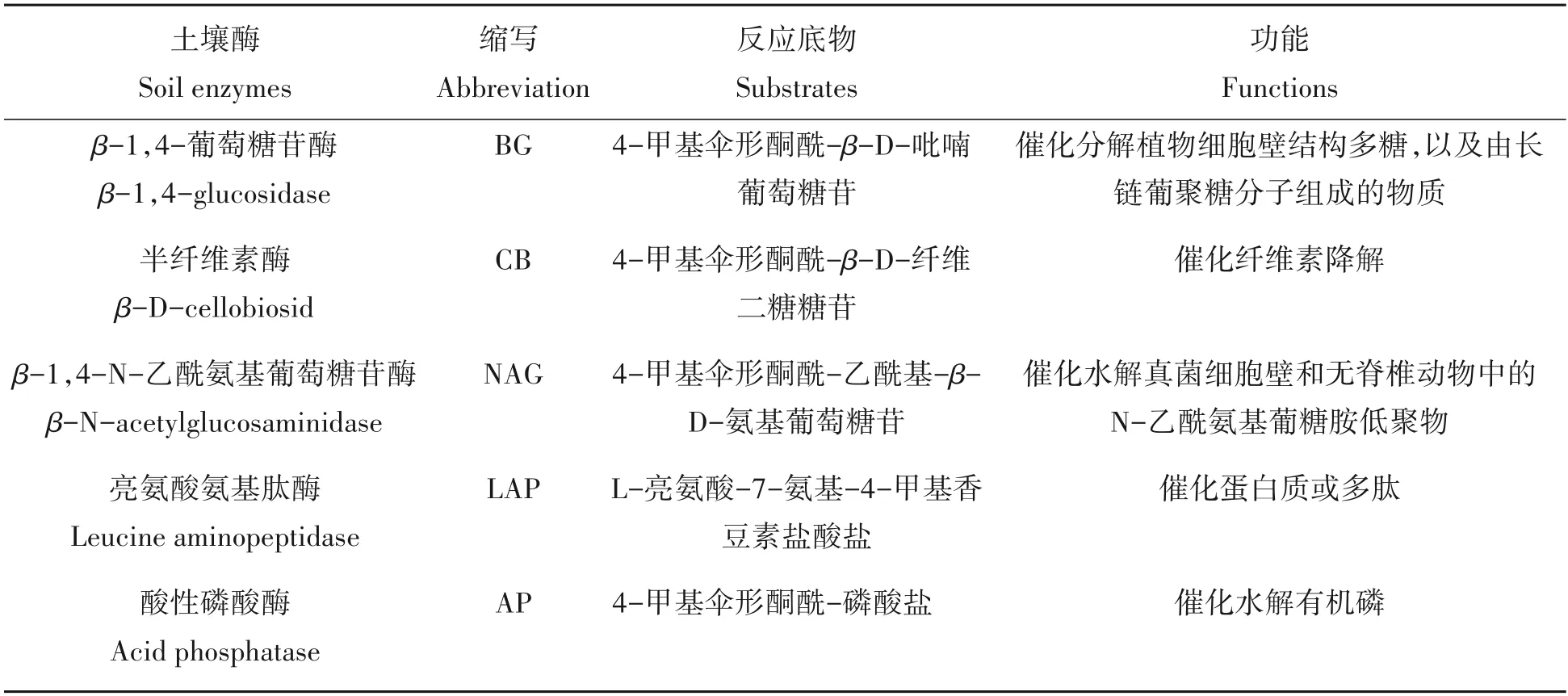
表1 土壤酶种类、缩写、反应底物以及功能Tab.1 The abbreviations of types,substrates and functions of soil enzymes
1.3.4 数据处理与分析 酶C:N 用ln(BG+CB)∶ln(NAG+LAP)表征;酶C:P 用ln(BG+CB)∶ln(AP)表征;酶N∶P 用ln(NAG+LAP)∶ln(AP)表征[11]。用Excel 2017 处理数据,采用SPSS 22.0 软件和Canoco5软件分析数据,利用SigmaPlot 10.0 软件作图。施肥、光照及其交互作用对植物生物量、土壤理化性质、土壤酶活性及其化学计量比的影响采用双因素方差分析(Two-way ANOVA),比较相同光照强度不同施肥处理和相同施肥处理不同光照强度之间植物生物量、土壤理化性质、土壤酶活性及其化学计量比的异同采用单因素方差分析(One-way ANOVA)和最小显著性差异法(LSD),土壤酶活性及化学计量比与各器官生物量和土壤理化性质之间的相关性采用Pearson 法进行分析,在此基础上利用Canoco5 软件以土壤酶活性及其化学计量比为响应变量,各器官生物量和土壤理化性质为解释变量进行冗余分析(RDA)。
2 结果与分析
2.1 施肥及光照对枫香苗生物量的影响
施肥、光照及其交互作用均对全株、叶、茎和根的生物量有显著影响(图1)。与不施肥相比,施N 肥显著提高各光照强度下全株的生物量、100%光照和60%光照下叶的生物量、20%光照下茎的生物量以及100%光照和20%光照下根的生物量(图1)。在各个施肥处理下,60%光照和20%光照全株的生物量显著低于100%光照全株的生物量;与100%光照相比,60%光照和20%光照显著降低施N肥叶和根的生物量以及施P 肥茎的生物量;而20%光照显著降低施P 肥叶和根的生物量以及不施肥根的生物量(图1)。
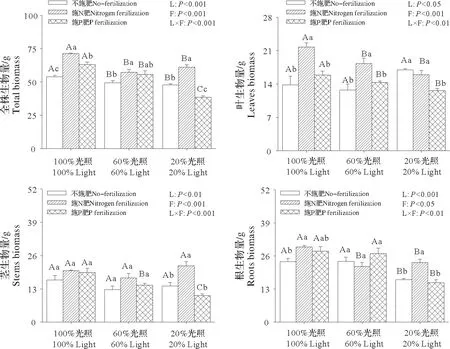
图1 施肥和光照对枫香苗全株和各器官生物量的影响Fig.1 Effects of fertilization and light on the biomass of Liquidambar formosana Hance seedlings
2.2 施肥及光照对土壤理化性质及其化学计量比的影响
施肥处理对pH、NH4+-N、NO3--N、MN、Olsen-P 和N/P 有显著影响,除OC 和C/N 外,光照处理对土壤理化性质及其化学计量比均有显著影响,施肥与光照的交互作用对NH4+-N、NO3--N、MN 和Olsen-P有显著影响(图2)。与不施肥相比,施N肥显著降低了60%光照和20%光照的pH,显著增加了各光照处理下的NH4+-N 和NO3--N 含量;施P肥均表现为Olsen-P 含量显著增加(图2)。在不同施肥条件下,除SMC 表现为随着光照的减弱而增加外,其余土壤理化性质均表现为随着光照的减弱而降低(图2)。具体而言,与100%光照相比,20%光照显著降低了不施肥下的pH、施N 肥下的TN 以及各个施肥处理下的TP,而60%光照和20%光照均显著降低施N 肥下的pH、NH4+-N 和NO3--N,不施肥下的NO3--N 和TN 以 及施P肥下的Olsen-P。20%光照使各个施肥处理下的C/P以及施N肥下的N/P显著增加(图2)。

图2 施肥和光照对枫香土壤理化性质的影响Fig.2 Influence of fertilization and light on physical and chemical properties in soil planted Liquidambar formosana Hance seedlings
2.3 施肥及光照对土壤酶活性及其化学计量比的影响
施肥和光照均显著影响AP、BG、CB、NAG 和LAP 活性,施肥与光照的交互作用对5 种水解酶均无显著影响。在20%光照下,施N 肥显著降低BG 活性,显著增加CB、NAG 和LAP 活性,与此同时,施N 肥还显著增加100%光照下的NAG 活性和60%光照下的CB 和NAG 活性(图3)。5种水解酶活性随着光照的减弱而逐渐降低,表现为20%光照下5 种水解酶活性显著低于100%光照,而60%光照显著降低各施肥处理下的AP活性、不施肥和施P肥下的BG和CB活性以及不施肥下的LAP和AP活性(图3)。
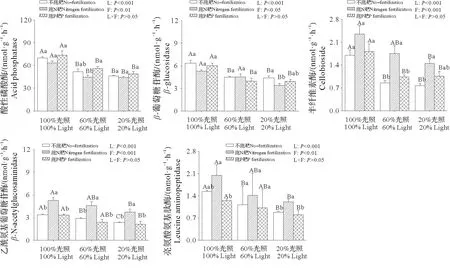
图3 施肥和光照对枫香土壤酶活性的影响Fig.3 Effects of fertilization and light on soil enzyme activities of Liquidambar formosana Hance seedlings
施肥显著影响土壤酶化学计量比,光照强度显著影响ln(BG+CB)∶ln(AP)和ln(NAG+LAP)∶ln(AP),施肥与光照的交互作用仅显著影响ln(BG+CB)∶ln(AP)(图4)。与不施肥相比,施N肥显著降低100%光照下的ln(BG+CB)∶ln(NAG+LAP),显著增加60%光照下的ln(BG+CB)∶ln(AP)以及各光照处理下的ln(NAG+LAP)∶ln(AP)。不同光照处理对ln(BG+CB)∶ln(NAG+LAP)无显著影响。在不施肥和施P肥下,60%光照和20%光照的ln(BG+CB)∶ln(AP)显著低于100%光照,在施N肥下,仅20%光照的ln(BG+CB)∶ln(AP)显著低于100%光照。就不施肥而言,20%光照的ln(NAG+LAP)∶ln(AP)显著低于100%光照(图4)。
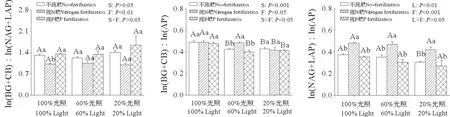
图4 施肥和光照对枫香土壤酶化学计量比的影响Fig.4 Effects of fertilization and light on soil enzyme stoichiometric of Liquidambar formosana Hance seedlings
2.4 土壤理化特性和苗木生物量与土壤酶之间的相关性
各器官生物量和土壤理化性质与土壤酶活性及其化学计量比的RDA 分析表明,第一轴解释了变量的55.70%变异,第二轴解释了变量的19.23%变异,并且解释度在30%以上的有总生物量、SMC、TN、MN、NH4+-N和NO3--N(图5)。Pearson 相关分析表明,枫香总生物量与AP、CB、NAG、LAP、ln(BG+CB)∶ln(AP)和ln(NAG+LAP)∶ln(AP)显著正相关,与ln(BG+CB)∶ln(NAG+LAP)显著负相关;叶和茎生物量与CB、NAG、LAP 和ln(NAG+LAP)∶ln(AP)显著正相关,根生物量与5 种水解酶、ln(BG+CB)∶ln(AP)和ln(NAG+LAP)∶ln(AP)显著正相关(表2)。含水量与AP、BG、CB、LAP 和ln(BG+CB)∶ln(AP)显著负相关;pH 与AP 和BG 正相关,与ln(NAG+LAP)∶ln(AP)显著负相关;NH4+-N 和NO3--N 与CB、NAG、LAP 和ln(NAG+LAP)∶ln(AP)显著正相关,与ln(BG+CB)∶ln(NAG+LAP)显著负相关;Olsen-P 与NAG 和ln(NAG+LAP)∶ln(AP)显著负相关,与ln(BG+CB)∶ln(NAG+LAP)显著正相关;OC和C/P与LAP显著正相关(表2)。
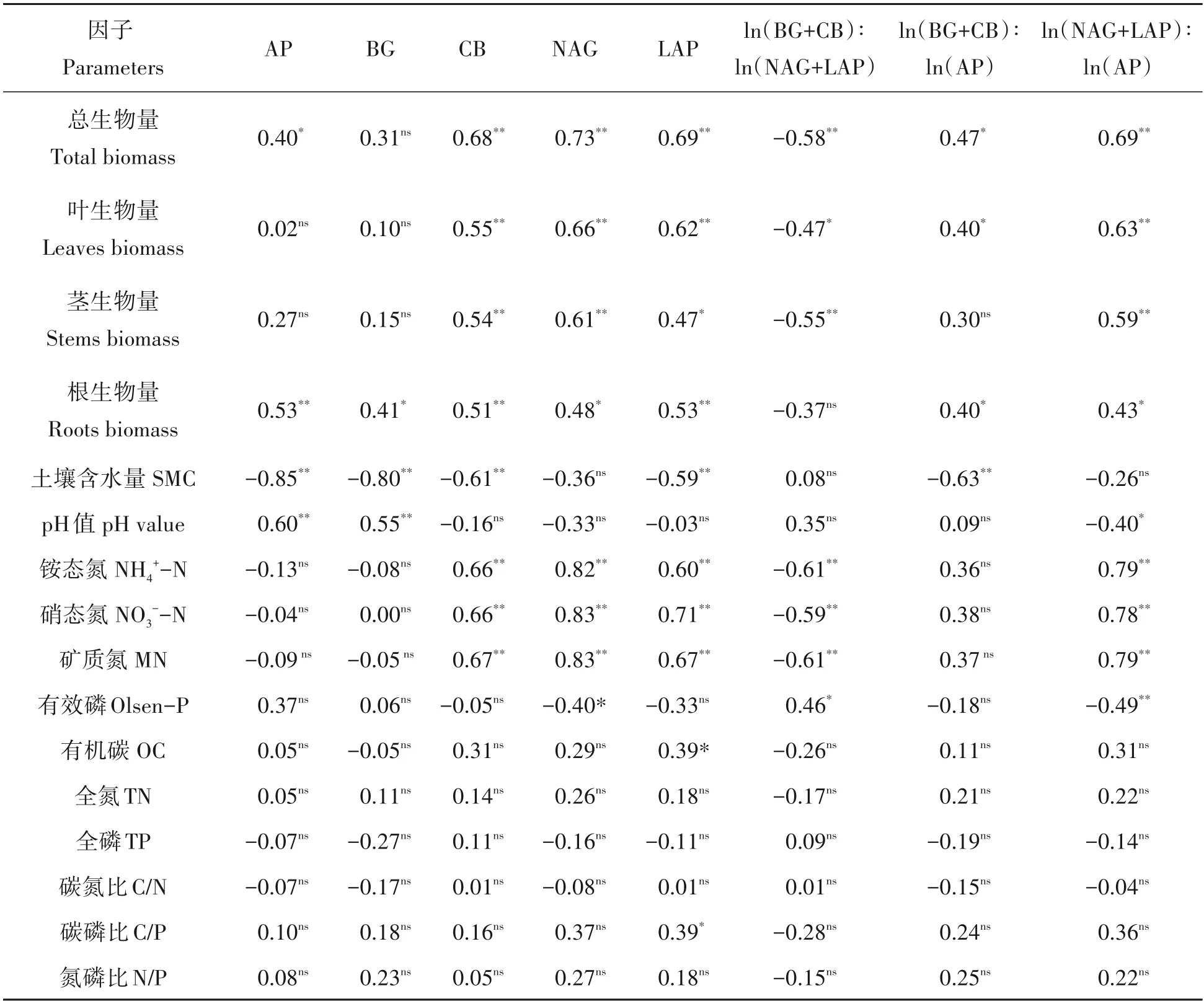
表2 土壤酶活性和酶化学计量比与植物生物量和土壤理化性质之间的Pearson相关分析Tab.2 Pearson correlations among soil enzyme activity and stoichiometric ratio with plant biomass and soil physicochemical properties
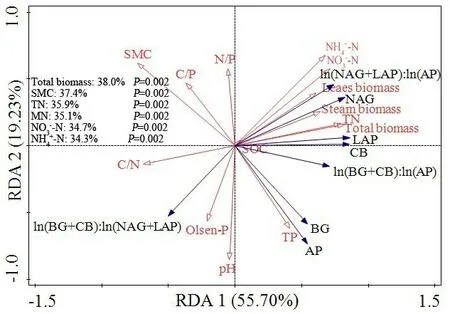
图5 土壤酶活性和生态酶化学计量比与植物生物量和土壤理化性质的冗余分析Fig.5 Redundancy analysis(RDA)of soil enzyme activity,ecoenzymatic stoichiometry ratios with plant biomass and soil physicochemical properties
3 讨论
3.1 施肥和光照处理对土壤酶活性的影响
土壤胞外水解酶可用于表征土壤养分和能量代谢水平,其活性的高低会受到植物生物量和土壤理化性质的影响[12,21]。本研究发现,N 添加增加了土壤MN、NH4+-N、NO3--N 含量和CB 活性,并且MN、NH4+-N、NO3--N 与CB 显著正相关,说明C 获取酶的活性随着N 含量的增加而增加。根据化学计量分解假说,N 添加显著提高土壤有效氮含量,可满足微生物对N 的需求,促进微生物生长和代谢,同时提高有机碳的分解,导致C 转化酶活性的提高。此外,土壤N 含量的提高,可为微生物生产转化酶提供蛋白质合成原料[22]。同时,本研究发现,N 添加显著提高土壤NAG 和LAP 活性。这可能归因于N 添加引起的土壤酸化,土壤酸碱度是调节酶活性的重要因素。酸度会影响酶的构象(酶与底物的亲和力)、酶与土壤颗粒的结合、分子的分解和营养物质的可用性[23]。一项全球分析显示,在40 个生态系统中,土壤酸碱度和N 转化酶之间存在显著的负相关关系[10],这表明土壤酸碱度的降低可能会增加NAG 和LAP活性。另外,还可能是因为N 添加提高了植物生物量归还,导致微生物群落结构和数量发生改变,进一步促进微生物对养分的利用,从而分泌更多的N 水解酶,促进NAG 和LAP 活性[8],这与笔者发现植物生物量和NAG、LAP 活性正相关一致。此外,MN、NH4+-N、NO3--N 与NAG 和LAP 显著正相关,说明土壤酶活性受到底物可利用性的影响。土壤有效养分含量可通过影响植物和微生物的生长而间接作用于土壤酶,使土壤酶活性与养分之间产生关联[24]。多数研究认为,当土壤养分利用率低时,微生物通过分泌相应的酶类满足对养分的需求[25-26],这与本研究结果不一致,土壤酶活性表现出相对复杂的变化,可能是由于土壤酶活性受养分需求和养分供应的共同调控,导致酶活性与养分之间缺乏明确的关系[15]。
本研究发现,随着光照强度的减弱,5种土壤酶(AP、BG、CB、NAG 和LAP)活性随之降低。光照强度的减弱增加土壤的含水量,可能是导致土壤酶活性降低的主要原因。土壤微生物活性和功能在很大程度上取决于土壤含水量,Xiao 等[27]研究表明土壤含水量与土壤酶活性呈显著负相关,这与本研究结果一致。一方面,光照强度的减弱降低了植物的蒸腾作用,增加土壤含水量,降低土壤孔隙度和孔隙连通性,进而抑制微生物活性,最终降低土壤酶活性[28-29];另一方面,光照强度的减弱可通过增加土壤的含水率进而减缓土壤矿化的相关生态过程,如生物量的产生以及群落组成的变化,最终抑制了土壤酶活性[30]。除此之外,本研究还发现,光照强度的减弱会降低地下根系的生物量,并且地下根系生物量与土壤酶显著正相关。光照强度不同会引起生物量及分配格局的变化,在强光照下植物将更多的光合产物运输到地下用于资源获取;而在弱光条件下植物光合产物供应不足,将更多的C 用于叶片自身生长来增加对光能的捕获,进而减少地下根系生物量的投资[31]。地下生物量降低的同时地下C 输入也将减少,可能是导致土壤酶活性降低的原因。由于根系及其分泌物作为不稳定C 输入的来源,其含量的减少在一定程度上会抑制微生物活性,进而降低土壤酶活性[32]。并且根系生物量的减少将改变根系分泌物的组成,特别是糖、羧酸和氨基酸的比例来降低土壤微生物的活性,从而降低土壤酶活性[33]。综上所述,光照通过调节土壤水分和枫香地下生物量驱动土壤酶活性。
3.2 施肥和光照处理下土壤生态酶化学计量特征
土壤酶化学计量比反映了微生物对C、N 和P 的相对需求[10]。研究表明,全球尺度上土壤酶活性ln(BG+CB)∶ln(AP)为0.62 和ln(NAG+LAP)∶ln(AP)为0.44[10]。而本研究发现,各处理下,ln(BG+CB)∶ln(AP)和ln(NAG+LAP)∶ln(AP)均显著低于全球尺度土壤酶活性比,说明该丘陵红壤可能缺乏微生物可利用的P,这与Liu 等[11]、Fang 等[34]的研究结果一致。可能是因为与通过多种途径(包括大气N 沉积和微生物矿化)输入的有效N 相比,有效P 向生态系统的输入相对较小且较慢[24],并且N 的输入会使土壤酸化,使得土壤P 易被含量较高的活性铁和铝强烈吸附,形成难溶性磷酸铁和磷酸铝等,导致亚热带地区有效P 含量低,进一步加剧丘陵红壤区的P 限制[34]。并且,本研究发现,在60%光照下,与不施肥相比,施N 肥显著增加ln(BG+CB)∶ln(AP)和ln(NAG+LAP)∶ln(AP),表明适当光照与N 添加互作并没有加剧P 限制,可能是因为适度光照下的N 添加虽然降低了土壤的pH 值,但光照的减弱通过增加土壤的含水量,加剧了H+的淋溶作用[25],在一定程度上缓解P 限制。通常认为当微生物受到养分限制时,能通过调节自身的生长和代谢过程,重新调整参与土壤养分循环有关的酶活性之间的比例[26]。一般来说,当微生物存在P 限制时,微生物就会分泌更多的AP 促进土壤有机P 矿化,并通过调节相关酶的化学计量比,进而缓解自身的P 限制[35]。然而,本研究发现,P 添加并没有改变ln(BG+CB)∶ln(AP)和ln(NAG+LAP)∶ln(AP),说明P 添加并没有缓解P 限制,可能是因为在这种P 相对缺乏的土壤中进行P 添加,P 会很快被植物吸收或土壤吸附沉淀,使得微生物难以利用[36],所以土壤中仍然缺乏微生物可利用的有效P。
另外,本研究发现,MN、NH4+-N、NO3--N 与ln(BG+CB)∶ln(NAG+LAP)显著负相关,与ln(NAG+LAP)∶ln(AP)显著正相关,说明土壤酶化学计量比受资源有效性的调控,有效氮显著影响土壤酶化学计量比。这与Liu 等[11]研究发现土壤有效性养分会影响微生物养分利用效率而改变微生物酶活性的结果一致,也与刘仁等[26]发现土壤有效氮是影响土壤酶化学计量比的关键因子之一研究结果一致。可能是因为施N 肥和光照减弱后影响了土壤的透气性、温度和各种离子的浓度,进而驱动土壤有效养分浓度的变化,影响土壤微生物活性与强度,最终影响土壤酶活性,并影响土壤养分限制,改变土壤酶化学计量比[37]。本研究还发现植物生物量与ln(BG+CB)∶ln(NAG+LAP)显著负相关,与ln(BG+CB)∶ln(AP)和ln(NAG+LAP)∶ln(AP)显著正相关,说明植物生物量是影响土壤酶化学计量比的重要因素,并且RDA 结果表明,植物总生物量解释了土壤酶化学计量比38.00%的变异,也说明了植物生物量是土壤酶化学计量比主要的影响因子,原因是光照的减弱和施肥可以通过提高植物生物量、改变各器官生物量的分配来增加土壤C 的输入[31],土壤C 的输入可改变微生物对养分的获取,进而改变土壤酶化学计量比[38]。
4 结论
施N 肥和光照强度显著影响土壤C、N 水解酶活性。N 添加提高C 转化和N 转化酶活性,P 添加对土壤酶活性无显著影响,光照强度的减弱降低土壤酶活性。整体上,ln(BG+CB)∶ln(AP)和ln(NAG+LAP)∶ln(AP)均显著低于全球尺度土壤酶活性比,表明该枫香栽培土壤缺乏微生物可利用P,而光照适度减弱与N 添加可在一定程度上缓解P 限制。植物生物量、土壤水分和土壤氮是土壤酶活性及其化学计量特征的主要驱动因素。综上所述,光照和施肥可通过改变植物生物量、土壤水分和土壤有效氮等因子驱动土壤胞外酶活性和生态酶化学计量变化,该结果可为枫香栽培土壤养分管理提供一定的依据,但有待开展大田试验进一步检验。
