茄子黄萎病苗期抗性鉴定技术的优化及抗源筛选
2022-02-04贲海燕曲红云霍建飞姚玉荣郝永娟王万立张雪岩胡建坤黄瑞荣
贲海燕,曲红云,霍建飞,姚玉荣,高 苇,郝永娟,王万立,张雪岩,胡建坤,黄瑞荣*
(1.天津市农业科学院 植物保护研究所,天津 300381;2.黑龙江省农业科学院 园艺分院,黑龙江 哈尔滨 150069;3.江西省农业科学院 植物保护研究所,江西 南昌 330200)
【研究意义】由大丽轮枝菌(Verticillium dahliaKleb)侵染引起的茄子黄萎病(Verticillium wilt)是一种世界性土传病害[1]。该病原菌的寄主范围广泛,除侵染茄子外,还可对棉花、向日葵、番茄、草莓、马铃薯等600 多种作物造成危害[2]。【前人研究进展】1914 年美国首次发现由大丽轮枝菌引发的棉花黄萎病,而后在1935 年我国因引进美国的棉花品种而传入黄萎病菌[3]。在20 世纪50 年代初期,茄子黄萎病仅在我国东北局部地区发生,随着茄果类蔬菜种植面积的不断扩大而迅速蔓延,发病范围也日益南扩,目前在我国茄子主栽培区均有该病害的发生。茄子黄萎病发病率较高,一般年份发病率在40%~50%,严重年份可达70%以上,致使毁种失收,对茄子产量和品质均造成严重的影响,已成为制约茄子产业发展的重要病害[1,4]。黄萎病属于典型的土传维管束病害,其致病菌大丽轮枝菌的主要存活结构和初侵染源是微菌核,由于其抗逆性强,在土壤中存活时间较长,化学防治并不理想;倒茬轮作虽然有效,但在茄子生产茬口安排会带来实际困难;嫁接技术是减轻茄子黄萎病发生有效的方法,但由于其操作环节多、技术要求较高以及增加投入成本等问题,很难在实践生产中推广应用。选育及利用抗病品种是防治茄子黄萎病最直接、安全、高效的措施之一,其中筛选抗病种质资源是抗病育种中重要的基础工作。自然病圃法是抗病性鉴定中最传统、应用最普遍的方法,目前其鉴定结论仍是新品种审定时主要的依据,但由于其鉴定周期长,且受季节的影响,鉴定材料数量受到限制[5]。此外,病圃中病菌数量的不确定、分布不均以及气候环境条件的变化等一系列因素均会影响鉴定结果的准确性。【本研究切入点】苗期室内人工接种法,不受季节影响,能更好地控制选择压,并且可大量、重复性筛选材料[6]。目前作物黄萎病采用的接种方法多为蘸根法、伤根法,这在棉花和向日葵等作物上研究的较为深入,而茄子上的接种鉴定方法报道较少[7-10]。进一步完善、改进茄子黄萎病人工接种技术仍有必有。【拟解决的关键问题】因此,本研究以茄子为试验材料,采用现有报道的接种方法比较在同一品种上的接种效果,并综合探究了不同类型强致病力菌株、菌液浓度、茄子苗龄等因素对接种成效的影响、以期优化最佳接种技术,从而构建高效、稳定、简便的茄子黄萎病苗期抗病性鉴定评价体系,为茄子黄萎病基础研究、抗病育种与利用及抗源筛选等提供技术支撑。同时,采用本研究优化的茄子黄萎病抗性鉴定技术对收集到的50份茄子资源品种的抗性进行鉴评,通过与田间病圃中各品种的抗性鉴定结果进行比对,以验证优化技术的实用性和鉴定结果的准确性。并期待挖掘到抗耐黄萎病的茄子资源种质,以缓解当前生产抗耐黄萎病品种不足及茄黄萎病育种抗源材料匮乏问题。
1 材料与方法
1.1 试验材料
供试品种:茄子品种龙杂茄10 号,为本课题组培育的耐病品种。供试菌株:不同培养性状的强致病力菌株25 株,其中A 型菌株11 株,为菌核型,菌落生长缓慢,菌核多;B 型菌株7 株,为菌核型,菌落为灰黑色,菌落生长较慢,菌核多;C 型菌株3 株,为丝核型,气生菌丝发达,菌核较多,菌落生长较快;D 型菌株4株,为菌丝型,气生菌丝发达,为灰白色[11]。所有菌株均由本课题组单孢分离、纯化后保存(表1)。
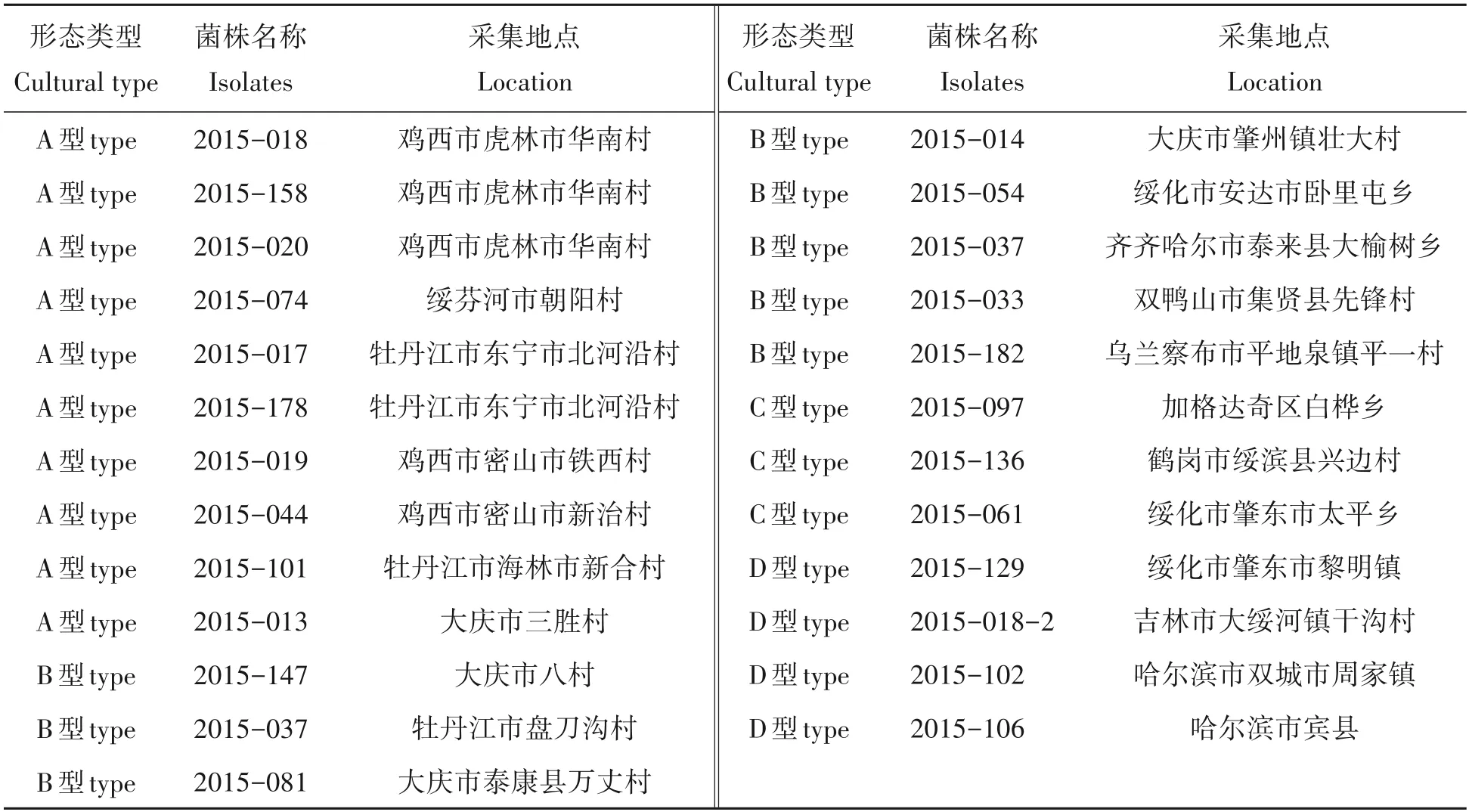
表1 茄子黄萎病菌25株菌株来源Tab.1 The origin of 25 isolates of Verticillium dahliae
1.2 茄子黄萎病菌产孢力的测定
将25 个供试菌株在PDA 培养基上进行活化,25 ℃黑暗条件下培养4 d 后,在无菌工作台中,使用灭好菌的打孔器打取菌碟,每150 mL马铃薯液体培养基中放入2块,25 ℃,130 r/min摇床培养4 d产孢量较多时,四层纱布过滤,收集滤液15 mL,用蒸馏水定容至100 mL,配制成孢子悬浮液,取少量用血球计数板测量,计算每毫升孢子个数,每个菌株3次重复。
1.3 茄子黄萎病菌最佳接种浓度的筛选
从上述产孢力强的菌株中选择4 种不同培养类型菌株各1 株(A 型菌株2015-078;B 型菌株2015-037;C 型菌株2015-061;D 型菌株2015-102),25 ℃、130 r/min 摇床液体培养4 d 后,纱布过滤,浓度分别稀释至108,107,106,105,104个孢子/mL。茄苗长至3~4 片真叶期,采用伤根后10 mL 菌悬液灌根接种法,每个处理32棵茄子苗,每个处理3次重复。
1.4 茄子黄萎病菌接种方法的筛选
在试验温室内,茄苗长至3~4 片真叶期,采用上述筛选出的接种菌株“2015-61”,接种浓度为1×105个孢子/mL,以5 种处理方式接种:①蘸根法,把茄子幼苗轻轻拔起,根部泥土清洗干净后蘸根30 min;②灌根法,在根际1 cm 部位斜切一刀后,将10 mL 孢子悬浮液进行灌根;③拌土法,把孢子悬浮液拌入土壤中均匀,使土壤接种终浓度为1×105个孢子/mL;④注射法,将10 mL 孢子悬浮液用灭菌针头注入茄苗茎基部;⑤无底钵伤根法,采用8连排特制营养钵,将钵底部长出的须根剪断后浸泡在菌悬液中30 min。以无菌水处理为对照组(CK)。每个处理3次重复,每次重复32棵茄子苗。
1.5 无底钵伤根法接种苗龄的筛选
采用无底钵伤根法对茄子不同真叶期(3~4 片、5~6 片和7~8 片)进行最佳接种苗龄的筛选。接种菌株为“2015-61”,接种浓度1×105个孢子/mL,剪断钵底须根后浸泡在菌悬液中30 min。每个处理32 株苗,3次重复。
1.6 无底钵伤根法最佳接种时间的筛选
在试验温室中,茄苗长至3~4 片真叶,剪断无底钵须根后,分别进行10,20,30 min 不同浸泡时间的处理。接种菌株为“2015-61”,接种浓度为1×105个孢子/mL。每个处理32 株苗,3 次重复。试验期间茄苗按常规方法管理,但防虫不治病。
1.7 病情调查及分级标准
所有试验均在黑龙江省农科院试验温室内进行,白天平均温度27.3 ℃,夜间平均温度为17.5 ℃。
接种后,待茄子黄萎病典型发病症状出现后进行第一次病情调查,之后每10 d 调查一次,至发病稳定不再扩展。依据如下分级标准进行病情级数调查,计算病情指数。
茄子黄萎病苗期分级标准:0级,植株生长健康,无发病症状;1级,植株1~2真叶发黄、卷曲或叶片脱落;2 级,植株3 片及以上真叶发黄、卷曲或脱落;3 级,整个植株的真叶几乎全部发病,出现萎蔫、黄化或脱落,而植株顶部新叶片健康或发黄但未脱落,全株未完全枯死;4级,植株全株枯死或只剩光杆。
发病率及病情指数按照以下公式计算:

1.8 茄子黄萎病抗病性鉴定与评价
采用以上建立的无底钵伤根法对本研究室保存的50份茄子种质资源进行抗性鉴定。依据这些材料品种在本单位占地700 m2的茄子黄萎病标准病圃的结果进行比较验证。茄子黄萎病抗病性鉴定分级标准如下:
免疫(I):DI=0;抗病(R):DI≤15;中抗(MR):15<DI≤30,耐病(T):30<DI≤50;中感(MS):50<DI≤70;感病(S):DI>70。
1.9 统计分析
应用DPS统计分析软件进行原始数据处理,并用Duncan氏新复极差法进行差异显著性分析。
(3)经营产品线:对经销商的代理产品进行全面调研,代理产品中一定不能有公司竞品,其主要经营资金等应集中在B公司的产品上。
2 结果与分析
2.1 茄子黄萎病菌株类型的筛选
试验结果表明,25株强致病力菌株中7株有较好的产孢力(表2),其中A型菌株3 株,B 型菌株2 株,C 型菌株1 株,D 型菌株1 株,25 ℃摇床培养第4 天产孢量达到最大,孢子滤液定容稀释后的浓度为1.1×107~2.3×107个孢子/mL,推算原滤液孢子浓度在7.33×107~15.33×107个孢子/mL。茄子黄萎病菌常见的接种浓度为1×107个孢子/mL,本试验中筛选到这7 株菌株产孢快,可作为接种试验的接种菌株。其他菌株由于产孢量不足或达到最佳产孢量所需时间较长,影响接种鉴定试验效率,因此不用于本试验的接种鉴定。

表2 不同培养性状的强致病力菌株25株产孢量的比较Tab.2 The spore-producing rates of 25 Highly pathogenic strains with different culture traits were compared
2.2 茄子黄萎病菌接种浓度的筛选
试验选取的四种类型菌株均有较强的致病力,但植株整体发病的严重程度存在一定差异(表3)。其中A 型菌株“2015-178”发病较轻,接种25 d,不同接种浓度的平均病情指数为61.6~65.8;D型菌株“2015-102”整体发病最重,接种25 d的平均病情指数为73.4~84.4。C型菌株“2015-61”以菌液浓度1×107个孢子/mL 接种的病情指数最高达86.9,但其致病力与D 型菌株“2015-102”比较,在相同菌液浓度下无显著性差异。各菌株不同浓度接种后发病趋势基本相似,即接种浓度越大,发病越严重(表3),当接种浓度为1.0×106个孢子/mL 及以上时,各菌株病情指数差异不显著,发病趋于稳定。
试验中发现菌株“2015-61”有更好的致病效率(表3),其处理浓度为1×105个孢子/mL 时,接种15 d和25 d的病情指数分别为44.3和78.1,与1×106个孢子/mL及以上的病情指数差异不显著,可达到同样的致病效果。因此,接下来的鉴定方法试验和抗病性鉴定试验均应用菌株“2015-61”接种,以减少菌种扩繁工作量,提高试验成效。

表3 不同接种浓度对茄子黄萎病发病程度的影响Tab.3 Effects of different inoculum concentrations on resistance to eggplant Verticillium wilt
2.3 茄子黄萎病菌接种方法的筛选
试验调查结果显示,5 种接种方法均能诱导茄苗发病,但病害显症及病情差异较大(表4)。蘸根接种,发病速率快,接种第8 天即表现出底部叶片变黄、半边退绿的症状,接种第25 天平均病指最高达85.7。灌根法在接种伤根时较难把控,接种第25天的病情指数为77.1,整体表现为发病不均匀。注射法接种,病情进展相对较慢,病情严重度低于蘸根接种和灌根接种;该法操作困难,功效低。拌土法接种,显症慢,接种第12天才开始显症;整体发病轻,接种15 d和25 d的平均病情指数分别为20.1和62.2,明显低于其他接种方法,且发病不均匀。无底钵伤根法接种发病速率较快、均匀度好,操作简便,接种后第15、25 天的平均病指分别为44.5 和80.5,接种成效与蘸根接种和灌根接种无差异,病情指数与鉴定寄主的实际抗感情况较为一致。

表4 不同接种方法对茄子黄萎病发病程度的影响Tab.4 Effects of different inoculum methods on resistance to eggplant Verticillium wilt
2.4 无底钵伤根法不同接种苗龄对发病的影响
结果显示,茄子植株不同苗龄进行接种对黄萎病发病程度的影响较大(表5),其中3~4 片真叶期发病效果最好,处理25 d后病株率和病情指数分别为100%,59.8,好于其它处理,此时清水对照处理植株生长良好,无发病;而4~5 片真叶、6~7 片真叶期病情指数在53.7 以上,但其清水对照处理植株叶片出现大面积黄化,花叶斑,植株老化严重,干扰其病情指数的调查,影响最终的调查结果。因此无底钵伤根法最佳接种苗龄为3~4片真叶期为宜。

表5 不同接种苗龄对茄子黄萎病发病程度的影响(无底钵伤根法)Tab.5 Effects of different inoculum seedling age on resistance to eggplant Verticillium wilt(root-cutting with bottomless bowl)
2.5 无底钵伤根法不同接种时间对发病的影响
两次调查结果表明,无底钵伤根法不同浸泡时间对发病程度的影响差异不明显(表6)。接种第15天,浸根10 min的病情指数为31.0,发病率为90.6%,浸根30 min的病情指数为33.9,发病率为87.5%;接种第25 天,各处理发病趋于稳定,处理10~30 min 的病情指数为74.7~75.5,发病率均为100%,较长时间地浸泡没有引起更严重的发病,因此采用10~30 min 的浸泡时间均可,为了提高试验效率,节省时间,可选择浸泡10 min。
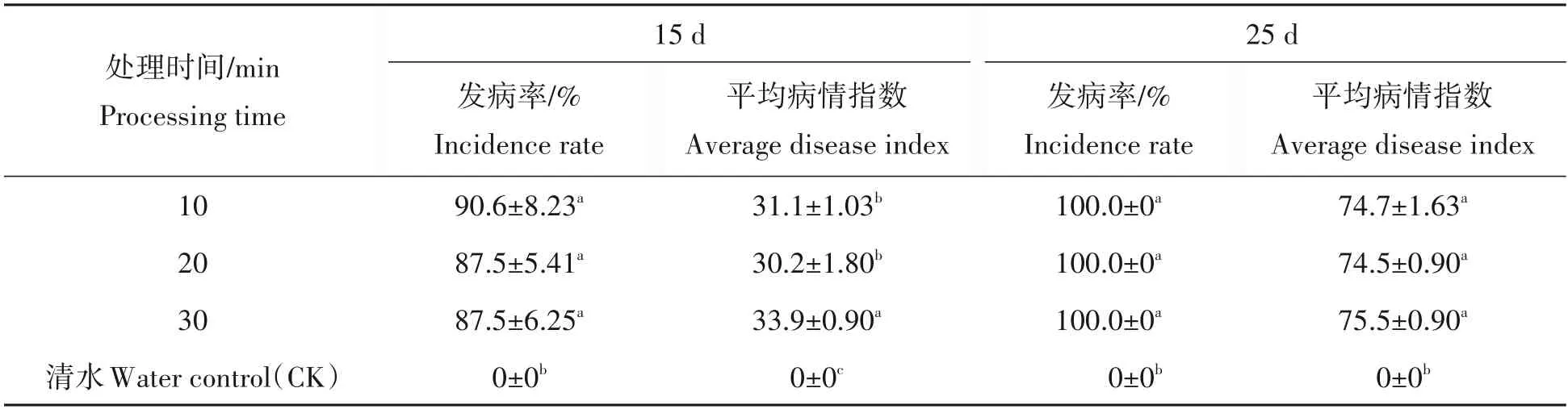
表6 不同接种时间对茄子黄萎病发病程度的影响(无底钵伤根法)Tab.6 Effects of different time on resistance to eggplant Verticillium wilt(root-cutting with bottomless bowl)
2.6 茄子黄萎病抗病性鉴定与评价
应用以上建立、优化的无底钵伤根法对本研究室现保存的50 份茄子种质资源进行了黄萎病苗期抗性鉴定试验(表7)。从结果中看出,茄子黄萎病接种第8 天开始发病,接种第20 天病情指数调查结果显示,“蒜芥茄”和“俄罗斯龙葵”均未发病为免疫品种(I);“托鲁巴姆”、“砧好和”和“EP 6279”病情指数24.0~29.3,为中抗品种(MR);耐病品种(T)有13 个,病情指数37.4~48.5;中感品种(MS)19 个,病情指数52.7~68.6;感病品种(S)13 个,病情指数71.9~97.3。其中“蒜芥茄”、“俄罗斯龙葵”和“EP 6279”对黄萎病的抗病性较好,可作为潜在砧木开发材料。以上材料的抗感情况与其每年田间病圃的抗性类型基本一致。
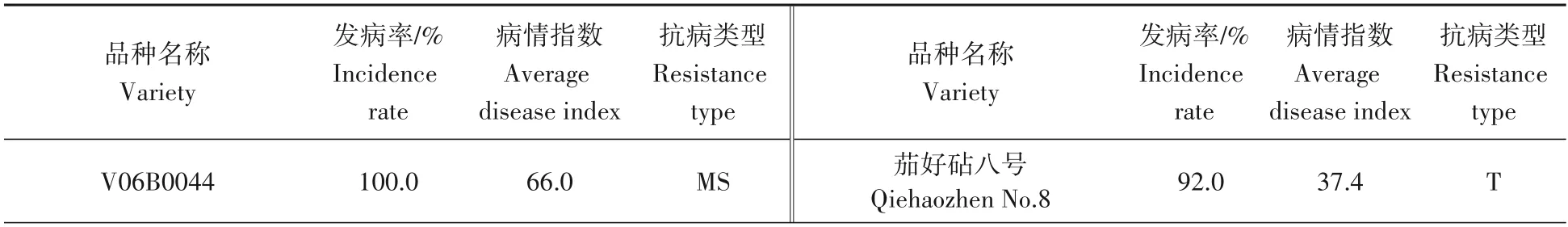
表7 不同茄子品种和育种材料对黄萎病的抗性评价(无底钵伤根法)Tab.7 Identification of resistance type of eggplant varieties against Verticillium wilt(root-cutting with bottomless bowl)

续表Continuted tab.
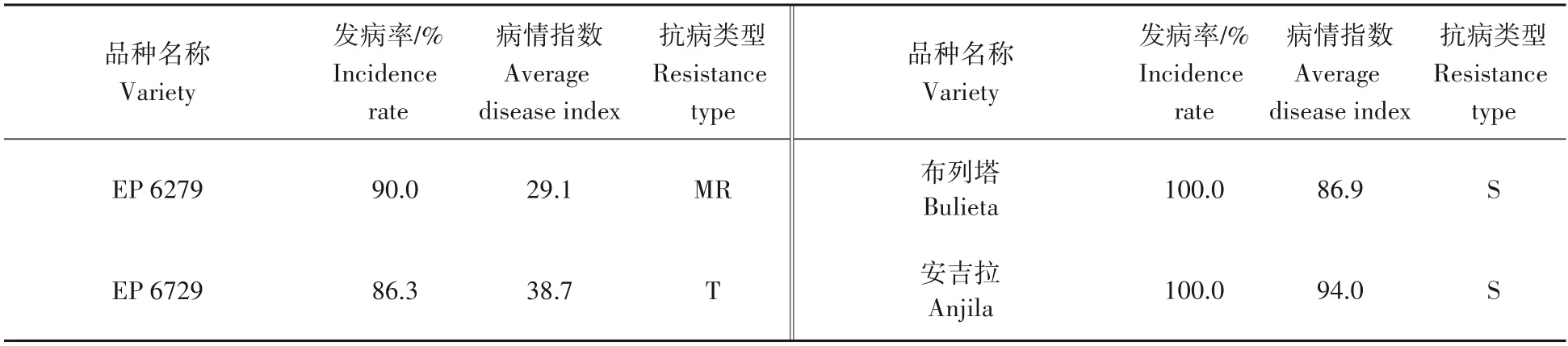
续表Continuted tab.
3 结论与讨论
研究结果表明,采用蘸根法、灌根法等5 种方法接种黄萎病菌均能诱导茄苗发病,但病害显症及病情差异较大。蘸根法、灌根法和拌土法等是土传病害苗期抗病性鉴定常用到的接种方法[18-19],本试验采用以上几种方法与无底钵浸根接种法进行对比,较全面地分析评判了各个方法的利和弊。蘸根法是黄萎病接种较推荐的方法[17],本试验中发现该方法接种发病速率快,接种第8 天既显现出黄萎病淡黄绿色斑点等症状,但整体病情较实际偏重,这对筛选抗源材料是有利的,但不利于耐病茄子品种的筛选与研判。灌根法在黄萎病接种试验中应用也较多[9,20],本研究发现以该方法接种需要缓苗较长时间,且存在发病不均匀现象,这应与接种操作时伤根把控难以做到一致性有关,由此可导致数据的准确性存在偏差。胡建坤等[20]在茄子黄萎病接种方法研究中也有类似结论。前人有关土壤带菌量不均匀导致单株发病不一致的报道[17]。本研究还发现拌土接种法的显著弊端在于茄苗接种后初始显症明显较其他方法滞后4~6 d,病情进展缓慢,病株病级偏差,影响至接种试验效率及其结果评判的可靠性。注射法接种在病害显症和病情严重度上与蘸根接种和灌根接种没有太大的区别,但此法操作困难,费工费力功效低,不值得推崇。
本研究无底钵伤根法的接种装置是八连排接种钵,每排为4 个钵,一套装置是32 个钵(可根据需要取出或挪动其中的一排或多排),每个钵体下方开口处,将露出的须根减掉,并整盘浸泡在装有孢子悬浮液的配套塑料盒装置中[21]。整个过程真实地模拟了致病菌从根部伤口处侵染,保证每棵茄子苗均匀带菌,实际发病均匀一致,很少出现同一处理有的植株发病严重,有的发病轻甚至不发病,或者重复之间发病不一致的情况。此方法与蘸根法的相似处是对植株根部进行伤根再蘸取菌悬液,但是无底钵伤根法不需要将植株连根拔除,节省了重新种苗的步骤,并且避免了较长时间缓苗导致的发病不一致,存在较大发病误差。目前,国内外已经利用类似的接种方法进行了棉花、苜蓿等作物的抗黄萎病材料的筛选并应用到实际生产,并且降低了田间鉴定中由于病原菌分布不均匀和气象因素等影响带来的结果不确定性[5,22]。接种浓度、生育期及接种时间等是影响黄萎病抗性鉴定方法准确性的重要因子[23],为此本研究对无底钵伤根法进行了优化,构建了在常温下(17.5~27.5 ℃)以产孢效率较高的茄子黄萎病菌株“2015-61”为抗性鉴定使用菌株,接种菌液浓度1×105个孢子/mL,接种茄苗叶龄3~4 叶,伤根处菌液浸泡处理10 min 的无底钵伤根法茄苗期黄萎病人工接种技术体系。其优点在于在于技术要领易于掌握,操作简便;病害发生整齐度一致,抗性鉴定结果可靠,评判准确;接种菌悬液浓度相对偏低,节省用菌量,提高功效。该项技术可广泛用于黄萎病菌致病力分化、生理类型鉴定、致病机理及药物筛选等相关试验研究。

图1 部分茄子品种和育种材料对黄萎病的抗病性鉴定结果Fig.1 Identification of resistance type of some eggplant varieties against Verticillium wilt
将上述优选法接种技术运用于茄子抗黄萎病资源的筛选,其结果与笔者多年来获得的大田自然病圃茄子抗黄萎病的数据结果较为吻合。试验鉴定到“蒜芥茄”、“俄罗斯龙葵”和“EP 6279”等抗性资源种质,可作为茄子抗黄萎病嫁接技术的砧木开发利用。
致谢:天津市宝坻区重大项目(201911)和天津市农业科学院青年科研人员创新研究与实验项目(2021004)同时对本研究给予了资助,谨致谢意!
