水稻雄蕊发育晚期赤霉素生物合成特性分析
2022-02-04何永明
张 芳,陆 涵,何永明
(江西农业大学 作物生理生态与遗传育种教育部重点实验室/江西省作物生理生态与遗传育种重点实验室,江西 南昌 330045)
【研究意义】水稻是我国重要的粮食作物,其产量通常由株高、分蘖数、穗粒数及千粒质量等农艺性状决定,而穗粒数和千粒质量又受控于花器官的发育。阐明水稻雄蕊发育的调控机制,为培育高产水稻品种提供理论支持,对保证粮食安全具有重要意义。【前人研究进展】赤霉素(gibberellins,GAs)是一类广泛存在于植物等生物中的四环二萜类化合物,由4 个异戊二烯单位组成,其基本结构是赤霉素烷。GAs作为经典5大类植物激素之一,是一种高效能的广谱植物生长调节剂,参与调控植物的种子萌发、节间伸长、纤维发育、叶片生长、花器官发育、打破种子休眠等众多生理过程[1-2]。目前已鉴定获得的天然GAs多达136 种,但除GA1、GA3、GA4、GA7外的绝大多数GAs 并无生物活性,而是作为活性GAs 的前体或无活性的代谢物[3-4]。遗传学证据表明,尽管植物中已分离鉴定出GA3,但是在许多植物中GA1和GA4是主要的活性GAs[5-7]。经过60 多年的研究,植物体内GAs 的生物合成途径已经比较清楚,主要分为3 个阶段:第一阶段在质体中完成,底物牻牛儿基牻牛儿基焦磷酸(geranylgeranyl diphosphate,GGPP)在内根-古巴焦磷酸合成酶(ent-copalyl diphosphatesynthase,CPS)和内根-贝壳杉烯合成酶(ent-kaurene synthase,KS)催化下环化为赤霉素的前身内根-贝壳杉烯(ent-kaurene)。CPS是正式进入赤霉素生物合成的早期关键基因,如果CPS完全突变,植物将无法产生任何赤霉素,种子不能萌发[8]。拟南芥中的CPS 是由单基因AtCPS/GA1编码,AtCPS只在顶端、根尖、发育中的花药和种子等快速生长的组织中特异性表达[9];第二阶段主要在内质网膜上完成,内根-贝壳杉烯经内根-贝壳杉烯氧化酶(ent-kaurene oxidase,KO)和内根-贝壳杉烯酸氧化酶(ent-kaurene acid oxidase,KAO)氧化生成GA12,它是GAs 的最初产物;最后一阶段在细胞质基质中完成,GA12的C13 经羟基化和非羟基化后生成GA53和GA12,随后,GA53和GA12在GA20 氧化酶(GA 20-oxidase,GA20ox)和GA3氧化酶(GA 3-oxidase,GA3ox)的作用下经过一系列的氧化步骤分别形成具有生物活性的GA4和GA1[10-11]。GA20ox 和GA3ox 催化活性GAs 生物合成的后期步骤,对活性GAs 的调节起关键作用。在拟南芥基因组中GA20ox和GA3ox分别存在5 个(At20ox1-At20ox5)和4 个(At3ox1-At3ox4)拷贝,在水稻基因组中分别含有4 个(OsGA20ox1-OsGA20ox4)和2 个(OsGA3ox1、OsGA3ox2)拷贝[12-14];这些基因的突变均导致活性GAs合成的缺陷,引起植株矮小、开花延迟以及短雄蕊和短花瓣等现象[15-17]。水稻“绿色革命”基因sd1(semi-dwarf1)编码GA20ox2,d1编码玉米中的GA3ox2,基因缺失后,突变体呈现出植株矮小、雌雄同花等表型[18-19]。研究[20-21]表明,GAs失活对活性GAs浓度的有效调节及其在植物体内的平衡是非常重要的。GAs 的代谢失活主要有两种途径,其一是通过EUI(elongated uppermost internode)蛋白使GA4的16,17-双键环被氧化从而失去活性,水稻中由OsEUI单基因编码EUI,该基因缺失导致突变体节间伸长,GA4和GA1含量增加[22-23];另外一种是借助GA2氧化酶(GA 2-oxidase,GA2ox)将GA4和GA1分别氧化为无活性的GAs,水稻基因组中含有6 个拷贝的OsGA2ox(OsGA2ox1-OsGA2ox6)[24-25]。植物体内活性GAs 水平通过前馈和反馈作用维持GA 稳态,当活性GAs 含量低时,GAs 作为信号分子促进合成基因GA20ox和GA3ox的表达,抑制失活基因GA20ox的表达;当植物体内活性GAs 含量较高时,GAs 对GA 合成关键基因的调控则相反。如在ga1-3突变体中,GA20ox1和GA3ox1表达明显增加,而GA2ox1的转录水平则下降;相反,当外加活性GA 处理时,GA20ox1和GA3ox1的表达受抑制,但却促进GA2ox1的表达[26]。【本研究切入点】水稻是开花受精植物,其颖花开放包括稃片张开、花丝伸长、花药开裂以及稃片闭合。花诱导后,活性GAs 对花器官的生长发育起着非常关键的作用,尤其是对雄蕊、花瓣与子房。【拟解决的关键问题】本研究拟以粳稻中花11为试验材料,利用Real-time PCR 鉴定开花前2 d至颖花开放期间,雄蕊中GAs生物合成关键酶基因的表达模式,并测定活性GA1和GA4含量,从而解析水稻雄蕊发育晚期赤霉素的生物合成特性和探究GAs在水稻颖花开放过程的调控作用。
1 材料与方法
1.1 试验材料及雄蕊样品的采集
试验品种为粳稻中花11,常规管理种植于江西农业大学科技园试验田,抽穗期为7月上旬。通过定株定时调查,本试验条件下抽出1 d后的稻穗才会开花,颖花开花的高峰时间约为11:30。选择顶部已有少量开过颖花(颖花成熟度主要根据其在穗上的着生位置和花药长度[27])的主穗,分别于开花前2 d、1 d、4 h(07:00—07:30)、0 h(11:00—11:30)挑取颖花,选取的颖花样品立即放入液氮中速冻,带回室内后在液氮中进一步剥取雄蕊,将样品保存于-80 ℃冰箱中备用。
1.2 试验方法
1.2.1 基因芯片数据分析 利用水稻基因表达谱芯片数据库RiceXPro分析赤霉素合成和代谢过程中相关基因在水稻不同组织部位及不同生育时期的表达模式(RiceXProhttp://ricexpro.dna.affrc.go.jp/index.html)。
1.2.2 Real-time PCR 植物样品总RNA 的提取采用Trizol试剂(北京全式金公司),DNase I(Invitrogen)去除基因组DNA 的污染后,用M-MLV 逆转录酶(Invitrogen)反转录合成cDNA。Real-time PCR 采用SYBRPremix Ex TaqII试剂盒(Takara)。Real-timePCR 反应体系20µL:SYBRPremix Ex Taq10µL,正反向引物各0.4µL,cDNA模板2µL,ROX Reference Dye(50×)0.4µL,ddH2O 6.8µL。反应条件为:95 ℃30 s,95 ℃5 s,60 ℃38 s,循环数为40。以OsGAPDH为内参基因,目标基因和OsGAPDH引物序列详见表1,结果根据2-ΔCt方法计算分析。每份样品2次生物学重复,3次技术重复。

表1 Real-time PCR 表达分析的基因引物序列Tab.1 Primers used to amplify for real-time PCR
1.2.3 赤霉素的提取与测定 雄蕊样品于液氮中研磨至粉末,准确称量1 g,加入10 mL提取液V(乙腈)∶V(水)∶V(乙酸)=90∶9∶1),4 ℃避光提取过夜,12 000 g 4 ℃下离心5 min,吸取上清,加入5 mL提取液再提取1次,合并2次所得上清液;用氮吹仪以N2气经吹干,以400µL甲醇溶解过夜,过0.22µm尼龙滤膜,保存于-20 ℃待测。采用高效液相色谱(Aglient1290)-质谱(SCIEX-6500Qtrap)系统检测GA1和GA4,色谱柱为poroshell 120 SB-C18反相色谱柱;流动相:A∶B=(甲醇/0.1%甲酸)∶(水/0.1%甲酸);外标法定量,每份样品3次重复[28]。
2 结果与分析
2.1 水稻赤霉素合成与代谢相关基因在不同组织器官中的表达模式
利用水稻(日本晴Nipponbare)表达谱基因芯片数据库RiceXPro 中的数据分析赤霉素合成和代谢过程中相关基因在水稻不同时期、不同组织的表达情况。结果显示,赤霉素合成早期基因OsKS1和OsCPS1、OsKAO2分别在雌蕊和花药里强烈表达;赤霉素合成后期基因OsGA20ox3和OsGA3ox1主要集中在花药中表达,其它组织部位中表达微弱;OsGA20ox2和OsGA3ox2在茎秆和花器官中都有较强的表达;OsGA20ox1和诱导活性GAs 失活的OsGA2ox在营养器官和花器官各组织都有较丰富的表达;而诱导GA4失活的OsEUI主要集中在水稻花药中表达。
2.2 赤霉素合成早期基因在水稻雄蕊发育中的表达特性
为进一步鉴定赤霉素合成早期基因OsCPS1、OsKS1、OsKO和OsKAO2在水稻雄蕊发育过程中的表达情况,于颖花开放前不同时间点(开花前2 d、1 d、4 h和0 h)分别取样检测。结果(图2)显示,随着开花的临近,水稻雄蕊中OsCPS1的表达显著性增强,并在开花前4 h达到最高值,同时OsKS1和OsKO也表现出类似的变化趋势,而OsKAO2的表达持续下降;另外,相较开花前2 d,在颖花开放时,雄蕊中这4个基因的表达量均下降到最低值;说明水稻颖花开放事件中所需的GAs在开花前已经完成合成的前期步骤。
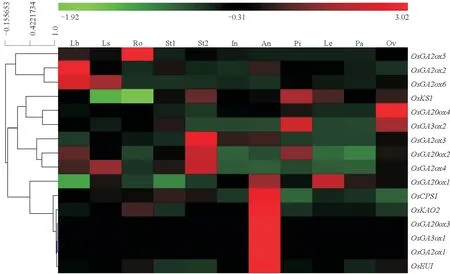
图1 水稻中赤霉素合成与代谢相关基因的表达谱分析(RiceXPro)Fig.1 Representative gene expression analyses of gibberellin synthesis and deactivation of rice(RiceXPro)

图2 水稻雄蕊中OsCPS1、OsKS1、OsKO、OsKAO2的表达分析Fig.2 Expression analyses of OsCPS1,OsKS1,OsKO,OsKAO2 in stamens of rice plant
2.3 赤霉素合成后期基因在水稻雄蕊发育中的表达特性分析
利用Real-time PCR 鉴定OsGA20ox、OsGA2ox和OsGA3ox等基因在水稻雄蕊中的表达情况(图3)。结果显示,颖花开放时雄蕊中OsGA20ox2和OsGA3ox2的表达水平迅速上升,表达量相较开花前2 d 分别增加了2.1 和2.8 倍(图3A)。而OsGA20ox1、OsGA20ox3、OsGA20ox4和OsGA3ox1的表达均随开花的临近逐渐下降,其中OsGA20ox3和OsGA3ox1的降幅最大,表达量分别仅为开花前2 d 的16.7%和9.6%(图3A)。雄蕊中OsGA2ox1、OsGA2ox2、OsGA20ox4和OsEUI的表达随着开花的临近逐渐下降,且表达量在开花时达到最低值,而OsGA2ox3和OsGA2ox6的表达大幅度提高,增幅分别高达1.5 和20.1 倍(图3B)。水稻颖花开放时花丝迅速伸长,并同步发生花药的开裂,而此时雄蕊中OsGA20ox2和OsGA3ox2的表达量大幅度增加,因此,OsGA20ox2和OsGA3ox2可能在促进雄蕊伸长过程中起着重要的作用。
2.4 水稻雄蕊中的GA4和GA1的含量分析
进一步测定水稻雄蕊中赤霉素含量显示,颖花开放时雄蕊中GA4的含量大幅度降低,仅为开花前1 d的16.1%,降幅高达84.88%(图4A);而GA1的含量在此期间却表现出与GA4相反的变化,水稻开花时,雄蕊中GA1的含量是开花前1 d 的2.4 倍(图4B)。这与前期基因表达结果一致,水稻颖花开放时,GA4合成的关键基因OsGA20ox3、OsGA3ox1和其负反馈调控基因OsGA2ox1、OsGA2ox2、OsGA20ox4、OsEUI的表达均较开花前大幅度下降(图3),进而大幅度降低了GA4的含量;相反GA1合成的关键基因OsGA20ox2、OsGA3ox2表达量显著高于开花前(图3A),从而促进GA1的大量合成。说明在水稻雄蕊发育晚期GA1可能调控颖花开放的花丝伸长。

图3 水稻雄蕊中OsGA20ox、OsGA3ox、OsGA2ox、OsEUI的表达分析Fig.3 Expression analyses of OsGA20ox,OsGA3ox,OsGA2ox,OsEUI in stamens of rice plant
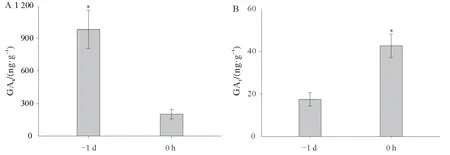
图4 水稻雄蕊中GA4和GA1的含量Fig.4 Concentrations of GA4and GA1 in the stamens of rice plant
3 讨论
GAs 是调节植物生长发育不可缺少的植物激素之一,调控植物生长发育多个过程,包括种子萌发、茎和叶柄的伸长、花的诱导以及花器官发育等[29-30]。大量研究表明尽管GA3是农业生产最为常用的赤霉素,但在多数植物体内GA1和GA4具有更为广泛的生理活性[1-2,31],且在拟南芥和水稻中,GA4生物活性约为GA1的1 000倍[5,31]。OsGA13ox异常表达导致活性更高的GA4在水稻中的富集减少,形成水稻半矮化突变体[32]。水稻突变体shb由于赤霉素合成减少,表现出根尖分生区皮层细胞更短、更少的表型[33]。拟南芥雄蕊的正常发育要较高含量的GAs。GA-合成缺陷突变体(ga1-3,ga1-6)或GA-受体缺陷突变体(gai)的拟南芥花芽都具有典型的短花瓣与短雄蕊,花丝的细胞伸长受到抑制[14,26]。长期研究认为在水稻中GA1是营养器官中的主要活性GAs,调控茎秆伸长等过程,水稻拔节时期GA1 的含量较高;GA4集中富集于花和穗子等繁育器官,调控雄蕊发育等[17,34]。本研究发现,随着开花的临近水稻雄蕊中OsGA20ox2和OsGA3ox2表达增强,且GA1含量显著增加,而GA4含量则大幅下降,这暗示着GA1可能调控水稻颖花开放过程的花丝伸长。
植物需要产生和积累合适水平的活性GAs以确保正常的生长发育。GAs可以从合成位点转运至生长发育过程中需要GAs的组织或器官中。活性GAs自身可作为信号,通过正、负反馈作用调控活性GAs生物合成相关基因的表达,维持植物体内赤霉素稳态。大多数试验结果表明,GA 生物合成受到活性GAs 的负反馈调节,小麦Rht2、玉米Dwarf8 和拟南芥gai 矮化突变体体内都含有异常高水平的活性GAs,这种高水平的活性GAs可能中断GA信号传导途径,抑制GA的生物合成[26,35]。GA4处理拟南芥后AtGA2ox表达水平降低,说明AtGA2ox表达受到赤霉素的反馈调节,同样的OsGA2ox在两个赤霉素缺失型突变体的表达量高于正常植株,外源赤霉素处理则减少基因表达量[11,24,35]。本研究结果显示水稻雄蕊发育晚期GA4含量显著降低,而此期间GA4合成的关键基因OsGA20ox3、OsGA3ox1以及编码调控活性GAs失活的相关氧化酶基因OsGA2ox1、OsGA2ox2、OsGA2ox4、OsEUI的表达量均大幅度下降;这与前人研究结果相一致,再次证明了GA4调控植物体内活性GAs平衡的重要作用。
