沙地盐胁迫对油莎豆幼苗生理生长影响的模拟研究
2022-02-03马兴羽黄彩变曾凡江李向义张玉林高艳菊徐梦琪
马兴羽, 黄彩变, 曾凡江, 李向义, 张玉林,5, 丁 雅,5,高艳菊, 徐梦琪
(1.中国科学院新疆生态与地理研究所新疆荒漠植物根系生态与植被修复重点试验室,新疆 乌鲁木齐 830011;2.中国科学院新疆生态与地理研究所荒漠与绿洲生态国家重点试验室,新疆 乌鲁木齐 830011;3.新疆策勒荒漠草地生态系统国家野外科学观测研究站,新疆 策勒 848300;4.中国科学院大学,北京 100049;5.新疆大学,新疆 乌鲁木齐 830046)
我国目前有各类可利用盐渍土面积达3.69×107hm2,其中具有农业利用前景的盐渍土面积约6.7×106hm2[1-2]。新疆是我国盐渍化最严重的地区之一,可占到全国盐渍土总面积的22.01%[3],主要为绿洲和沙化盐渍土,是我国目前具有较好农业开发价值、具备农业改良利用潜力的盐渍土地之一。有效治理开发可利用盐渍土地,不但可以有效扩增区域耕地资源,拓展农业发展空间[4],还可缓解粮食安全压力。引进和种植耐盐植物可显著增加土壤有机质和生物多样性,对盐渍化土壤微生态环境也具有显著改善作用[2],因此,引进适宜于盐渍化土地生长的植物,尤其是综合利用价值较高作物,是盐渍化土地改良利用和土地生产力提高的重要措施之一。油莎豆(Cyperus esculentus)是莎草科莎草属多年生草本植物(在农业生产上作为一年生作物栽培),是一种集粮、油、牧、饲、药、绿化观赏于一体的高产经济作物,具有抗逆性强、适应性广、耐瘠薄等特性[5-6],近年来在新疆南北部绿洲和风沙区均已试种成功[7-8]。但是关于油莎豆能否在沙化且有不同程度盐渍化的土地上成功种植还了解较少,且缺乏对油莎豆在沙化盐渍土地规模化种植的有效的理论指导。因此,研究沙化土地油莎豆对盐胁迫的响应及适应机制,对其在新疆沙质盐渍土地进行规模化种植和土地高效利用方面具有重要意义。
盐胁迫对植物生长发育的伤害主要通过渗透胁迫、离子毒害、营养失衡和氧化损伤等次生反应过程来实现[9-10]。为适应盐胁迫,植物已进化出一系列生理生化保护机制,如通过渗透调节物质的合成、抗氧化酶活性的提高及耐盐基因的上调表达等一系列的响应机制来进行自我调节和缓解[11-13]。不同植物的耐盐机制和响应机制也不同,如耐盐小麦(Triticum aestivum)幼苗通过其较强的K+/Na+、Ca2+/Na+调节能力和抗氧化酶体系缓解盐胁迫[14];藜麦(Chenopodium quinoa)幼苗采取提高体内可溶性糖和脯氨酸含量,增强抗氧化酶活性,降低丙二醛(MDA)含量等自我保护机制以适应盐胁迫[15];小报春(Primula forbesii)幼苗可通过提高可溶性蛋白和脯氨酸含量及超氧化物歧化酶和过氧化物酶活性来抵御盐害[16];唐榕等[17]对以蛭石为培养基质油莎豆幼苗在短时间内的耐盐性进行研究,也发现其可通过提高叶片内抗氧化酶活性、积累脯氨酸与可溶性糖等来提高其耐盐能力。但是延长胁迫时间,油莎豆幼苗是否仍有较强的耐盐能力尚不明确。为此,本研究以塔里木盆地南缘绿洲-荒漠过渡带的风沙土为培养基质,在温室大棚内采用盆栽试验,通过监测油莎豆幼苗在不同盐胁迫时间和盐浓度下植株的生长表现、Na+和K+含量,以及叶片有机渗透调节物质累积和MDA含量变化等,分析油莎豆幼苗对沙化土壤盐胁迫的生长生理响应及耐盐性,以期为油莎豆在新疆沙质盐渍土地的大面积推广种植提供理论参考。
1 材料与方法
1.1 材料培养与处理
试验在新疆乌鲁木齐植物园温室大棚中进行(43˚53′N,87˚33′E),供试油莎豆品种为新科1号,前期进行种子萌发预实验,种子萌发率达90%。播种前挑选籽粒饱满、无霉化、无机械损伤,且大小均一的种子放入蒸馏水中浸种48 h 备用。供试土壤采集于塔里木盆地南缘策勒绿洲-沙漠过渡带0~30 cm 土层,土壤类型为风沙土,pH 为8.81,盐分含量为0.108%,有效磷含量为0.9 mg·kg-1,碱解氮含量为2.16 mg·kg-1,速效钾含量为128 mg·kg-1。K+含量为4.40 mg·kg-1,Na+含量为7.44 mg·kg-1。据调查油莎豆在新疆的种植时间一般在4 月下旬至5 月下旬,该时段气温还不是很稳定,平均气温不超过15 ℃[18]。因此,幼苗生长期间,温室日平均温度控制在15.64±1.74 ℃,平均湿度为68.18±7.93%,日平均光照度为9089.54±3399.09 lux,日照时长为10 h。
于2021年9月10日,将风干处理后的土壤装入高34 cm、上口径23 cm、下口径20 cm 的塑料花盆中,每盆装土重10 kg,盆下垫托盘,以便后期浇水时渗漏液被再次吸收利用。次日施肥和播种,每盆基施尿素0.08 g·kg-1,磷酸二氢钾0.12 g·kg-1,之后每盆播入3粒种子,随后灌入300 mL水。待油莎豆植株生长至三叶一心时(播种后20 d)开始间苗,每盆留苗1 株,且生长情况基本一致。于10 月2 日开始盐胁迫处理,土壤盐胁迫梯度参照黄绍文等[19]依据Cl-含量划分的盐渍化程度分级标准(表1),共设置5个NaCl 浓度梯度,分别为对照(0 g·kg-1,CK),轻度盐分胁迫(0.5 g·kg-1,S1),中度盐分胁迫(1.0 g·kg-1,S2),重度盐分胁迫,(2.0 g·kg-1,S3),盐土(3.5 g·kg-1,S4),每个处理30 盆,共150 盆。为避免盐基效应,S1,S2和S3处理按每日递增0.5 g·kg-1Na⁃Cl 融入清水浇入土壤中,S4处理按每日递增0.7 g·kg-1NaCl 浇入土壤中,CK 处理补入清水。经测量盆内土壤的田间持水量为18%,采用称重法补充水分,保持土壤含水量为田间持水量的75%。分别在播种后50 d 和70 d(盐胁迫后的30 d 和50 d)进行采样。

表1 土壤盐渍化分级参考标准Tab.1 Classification standard of soil salinization
1.2 测定项目及方法
1.2.1 生长指标测定 在盐分处理30 d和50 d时测量油莎豆幼苗的株高,每个处理选15 盆,记录并取平均值。之后每个处理随机选取3 盆,每盆为1 个重复,剪去所有叶片,带回实验室,用清水洗净并擦干,利用扫描仪(惠普G3110)扫描叶片,通过Image J软件计算叶面积。将油莎豆幼苗扫描叶片,地上部剩余部分和地下部分分别清洗后放入烘箱,在105 ℃下杀青30 min,随后在75 ℃烘干至恒重,并称量获得各部位干重。其中地上部分包括茎与叶,地下部分包括根系与块茎。根冠比计算公式如下[20]:

参照邹琦[21]的饱和称重法测定叶片相对含水量,每个处理另选3 盆。选取油莎豆幼苗相同部位的成熟叶片,保存于便携冰箱内,带回实验室,用蒸馏水迅速冲洗叶片表面,吸干表面水分后称其叶片鲜重,然后将叶片浸入15 mL 试管中,加满蒸馏水(期间注意避免叶片损伤),使叶片完全浸入水中,在阴暗环境下浸泡24 h,将叶片取出并轻轻吸干表面水分。称取叶片饱和鲜重后,放入105 ℃烘箱中杀青30 min,75 ℃烘干至恒重,称取干重。利用下式计算油莎豆叶片的相对含水量:

1.2.2 生理指标及离子含量测定 每个处理随机选取3盆,剪下成熟叶片,采用硫代巴比妥酸(TBA)显色法[22]测定MDA含量;脯氨酸含量参照李合生[23]的磺基水杨酸提取法测定;可溶性糖含量采用蒽酮比色法测定。可溶性蛋白含量采用考马斯亮蓝G-250比色法测定[24]。MDA、脯氨酸、可溶性糖和可溶性蛋白含量均是按叶片鲜重计算。叶片和根系的Na+、K+含量参照王宝山等[25]的方法提取与测定,其含量均按干重计算。
1.3 耐盐性综合评价
根据盐胁迫后测定的油莎豆幼苗的指标(生长、生理生化指标和叶片Na+、K+含量),选用模糊隶属函数法分别计算盐胁迫30 d 和50 d 的油莎豆幼苗隶属函数值,数值越大表示耐盐性越强[15],计算公式如下:

式中:R为隶属函数值;X为各指标某一测定值;Xmin为该指标的测定最小值;Xmax为该指标的测定最大值。当耐盐性与指标呈正相关关系时,采用公式(3)计算,负相关时采用公式(4)计算。
1.4 数据统计分析
使用Microsoft Excel 2019软件进行数据处理,使用IBM SPSS statistics 23软件进行数据统计分析,应用单因素方差分析(One-Way ANOVA)及多重比较(Duncan)检验各生长及生理指标在不同盐浓度胁迫下的差异性(95%置信区间)。利用Person相关系数分析各指标间相关关系;采用Origin 2021软件作图。
2 结果与分析
2.1 盐胁迫对油莎豆幼苗生长的影响
盐胁迫对油莎豆幼苗生长有显著影响(图1)。在盐胁迫处理30 d后,地上部分干重随盐胁迫程度加剧而明显下降(图1a),轻度盐分胁迫S1处理与CK处理无明显差异,均显著高于其他处理;S2和S3处理差异也不明显,但显著高于S4。地下部分干重在S1处理下最高,与其他处理差异却不显著(图1b)。株高在盐分处理后也显著下降(图1c),S1与S2处理差异不明显,但显著高于S3与S4。叶面积对盐胁迫的响应与地上部分干重一致(图1d)。

图1 不同盐分梯度下油莎豆幼苗干物质、株高和叶面积的变化Fig.1 Changes in dry matter,plant height and leaf area of Cyperus esculentus seedlings under different salt stress treatments
在盐分处理50 d 后,地上部分干重在S1与CK间差异不明显,但均显著高于其他处理;S3与S4差异也不明显,均显著低于其他处理。地下部分干重在S1处理下较CK 下降了23.6%,但二者差异不明显,其他处理均显著低于CK。株高在盐分处理后均显著下降,在S2处理下最低,但与S3和S4处理差异不显著。叶面积也在各盐分处理后显著下降,分别比CK处理降低了25.3%,65.8%,64.9%和72.6%。
与盐胁迫30 d相比,在盐分处理50 d后同一处理的地上部分干重均有不同程度增加,CK~S4处理分别增加了32.1%,36.2%,29.8%,2.4%和27.6%;地下部分干重除CK增加47.2%外,其他处理分别下降了18.2%,38.9%,40.9%和32.9%。CK~S4处理的株高分别增加了19.5%,7.6%,1.5%,27.8%和15.1%。叶面积仅CK处理增加了30.1%,其余各处理叶面积下降幅度分别为2.5%,39.3%,27.8%和17.0%。
由图2可以看出,在盐分胁迫30 d后,叶片相对含水量在S1处理下略有增加,且显著高于其他盐分处理(图2a);不同盐分处理的根冠比均较CK 有所增加,但不明显(图2b)。盐分胁迫50 d 后,叶片相对含水量在S1处理下最高,但与其他处理差异均不明显;根冠比在所有盐分处理下均出现下降,S1与S4处理下降不明显,但S2与S3显著低于CK。与盐分胁迫30 d 相比,叶片相对含水量在CK 与S1处理下分别增加了2.4%和8.0%,其他盐分处理变化很小;除CK的根冠比在50 d时稍有增加,其他盐分处理均出现降低。
2.2 盐胁迫对叶片有机渗透调节物质的影响
2.2.1 盐胁迫下油莎豆叶片脯氨酸含量的变化 由图3a 可以看出,在盐分处理30 d 后,各盐分处理下叶片中脯氨酸含量均高于CK,其中S1和S2处理差异不明显,与其他各处理间差异也不明显;S3和S4处理差异也不明显,与CK相比分别显著提高了35.6%和40.5%。在盐分处理50 d 后,叶片脯氨酸含量在S1,S2和S3处理下差异不明显,分别比CK 降低了24.6%,18.3%和23.2%。脯氨酸含量在S4处理下最高,且显著高于其他处理。与盐胁迫30 d 相比,盐分处理50 d后,CK和S4处理的脯氨酸含量分别增加了19.4%和11.3%;S1,S2和S3处理分别降低了20.3%,14.6%和32.4%。

图3 不同盐分梯度下油莎豆幼苗叶片有机渗透调节物质及MDA含量变化Fig.3 Changes in organic osmotic regulatory substances and MDA contents of C.esculentus seedlings leaves under different salt stress treatments
2.2.2 盐胁迫下油莎豆叶片可溶性糖含量的变化 在2 个胁迫时间,叶片可溶性糖含量均随盐分胁迫加剧呈先升高后降低的趋势(图3b)。在盐分处理30 d后,S2处理的可溶性糖含量最高,与S3处理差异不明显,但显著高于其他处理。在盐胁迫处理50 d后,各盐分胁迫处理间差异不明显,但S1和S2分别比CK 显著增加20.3%和19.5%,而S3和S4处理略高于CK 16.2%和8.3%。盐分胁迫50 d后,各处理叶片可溶性糖含量均比30 d 有所升高,S1处理增加最多为19.3%。
2.2.3 盐胁迫下油莎豆叶片可溶性蛋白含量的变化 由图3c可以看出,各盐分处理的可溶性蛋白含量均高于CK。盐胁迫处理30 d后,叶片可溶性蛋白含量随盐分胁迫加强略有上升,但各处理间差异却不显著。盐胁迫50 d后,各盐分处理的可溶性蛋白含量均显著高于CK,并随盐胁迫程度增加而显著上升。与盐胁迫30 d 相比,在盐胁迫50 d 后除CK 处理下可溶性蛋白含量降低了6.7%,S1~S4分别增加了23.5%,53.2%,51.6%和68.4%。
2.3 盐胁迫下油莎豆叶片MDA含量的变化
在盐分胁迫30 d后,叶片MDA含量随盐分胁迫程度加剧先升高而后降低(图3d)。MDA 含量在S1处理下最高,显著高于CK 25.2%,S2和S3处理与CK差异不明显,S4处理显著低于其他处理,较CK 显著下降62.6%。在盐分胁迫50 d 后,S1和S2处理的MDA 含量与CK 没有明显差异,在S3处理下显著下降,并在S4处理下又升至最高,较CK 处理显著提高了12.7%。与盐胁迫处理30 d 后相比,S1处理在盐分处理50 d后降低了6.2%,其他处理均有不同程度增加,其中S4处理增加了278.2%。
2.4 盐胁迫对油莎豆植株中的Na+、K+、Na+/K+比的影响
2.4.1 盐胁迫下油莎豆叶片Na+、K+、Na+/K+比的变化 由图4a可以看出,油莎豆叶片K+含量随盐胁迫程度加剧而下降。在盐分处理30 d 后,K+含量在4个盐分处理下均显著低于CK,分别较CK 降低了20.7%,24.1%,27.8%和30.9%。Na+含量和Na+/K+比均随盐分胁迫程度增加而显著增加,在S4处理下显著高于其他处理(图4b,图4c)。在盐分胁迫处理50 d后,叶片K+含量在各浓度盐分处理下均显著降低,S1~S4处理分别比CK 下降了11.9%,19.0%,30.7%和27.0%。Na+含量和Na+/K+比均随盐胁迫加剧而显著增加。

图4 不同盐分梯度下油莎豆幼苗叶片和根系Na+和K+含量及Na+/K+比值变化Fig.4 Changes in Na+and K+contents and Na+/K+ratio in leaves and roots of C.esculentus seedlings under different salt stress treatments
与盐胁迫30 d 相比,S1处理的叶片K+含量在盐分胁迫50 d 后提高了0.3%,CK 和S2~S4处理分别下降了9.8%,3.8%,13.5%和4.9%。Na+含量除在S4处理下降了9.6%,其他各处理均有不同程度增加。CK,S1,S2和S3处理的叶片Na+/K+比分别增加了31.2%,12.5%,36.0%和39.7%;S4处理却降低了3.6%。
2.4.2 盐胁迫对油莎豆根系Na+、K+、Na+/K+比变化的影响 由图4d 可以看出,在盐分处理30 d 后,S1~S4处理的根系K+含量分别比CK减少了43.3%,55.4%,49.0%和44.3%,各盐分处理间差异不显著。Na+含量和Na+/K+比随盐分梯度增加而显著上升,在S1和S2处理下差异不明显(图4e,图4f)。盐分处理50 d后,各盐分处理的根系K+含量均显著低于CK,S1与S2,S3处理之间差异均不显著,但显著高于S4处理。Na+含量和Na+/K+比随盐分胁迫加剧而显著增加,其中S2和S3处理之间差异不明显,但显著低于S4处理。根系随盐分浓度升高而增加,在S4处理下达到最大,且显著高于其他处理。
与盐分胁迫30 d 相比,盐分胁迫50 d 后,CK 和S1~S4处理的根系K+含量分别升高了4.8%,47.6%,43.6%,25.1%和8.8%。Na+含量在各处理下也分别提高了16.9%,30.4%和100.3%,40.9%和30.1%。根系Na+/K+比在S1处理下略有降低,其他处理下分别升高了12.1%,41.7%,11.1%和20.2%。
2.5 不同浓度盐胁迫下油莎豆的隶属函数值及耐盐性评价
采用隶属函数法对油莎豆的耐盐能力特性进行综合评价(表2)。在2个胁迫时间,油莎豆的隶属函数值大小顺序均是:CK>S1>S2>S3>S4。由图5 看出,在盐胁迫30 d 和50 d 后在轻度盐分胁迫处理S1的耐盐性综合评价值与CK 差异均不显著,但显著高于其他盐分处理。盐胁迫30 d 的综合评价值随胁迫程度加剧而显著下降,而在盐胁迫50 d后S2,S3和S4却差异不明显。

图5 油莎豆幼苗耐盐性综合评价得分Fig.5 Comprehensive evaluation scores of salt tolerance of C.esculentus seedlings
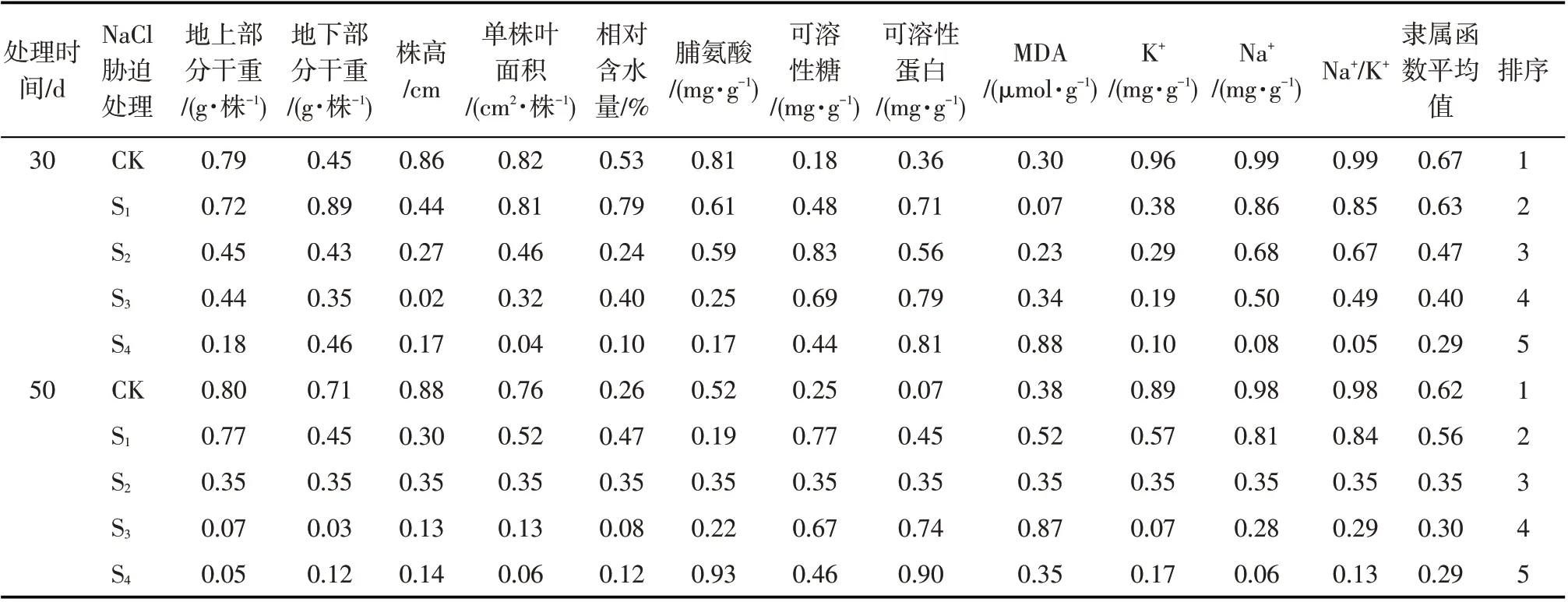
表2 不同盐分梯度下油莎豆的隶属度函数值及耐盐性评价Tab.2 Subjection values and salt tolerance evaluation of C.esculentus under different salt stress treatments
3 讨论
3.1 盐胁迫对油莎豆生长的影响
植物遭受盐损伤会出现植株矮小,叶面积减少,根系生物量下降等现象[15,26],但不同植物的响应不同,耐盐程度也有差异。对湖南稷子(Echino⁃chloa frumentacea)[27]、冰草(Agropyron cristatum)[28]等植物研究均发现,低盐胁迫可促进株高和生物量累积的增加,而高盐浓度则起到抑制作用。本研究表明,轻度盐分胁迫(S1)30 d 后对油莎豆地上部干重和叶面积没有明显影响,对地下部干重略有促进,但株高显著下降。随盐胁迫时间延长,S1处理的地上部干重受影响仍较小,但其株高、叶面积均显著下降,且地下部干重也受到抑制。在中度和重度盐胁迫下,油莎豆地上和地下干重、株高及叶面积均遭到明显抑制。这表明短期内低盐胁迫不会对油莎豆产生负面影响,但胁迫时间过长则会抑制地下部生长和光合叶面积的扩大。豆昕桐等[14]对小麦幼苗的研究也发现,不同程度盐胁迫短时间对小麦幼苗生长有一定的促进作用,但随着胁迫时间的增加,幼苗的生长则会受到抑制。这说明除了盐胁迫强度外,胁迫时间也会同样影响到油莎豆幼苗的生长。
很多研究认为,盐胁迫下植物根系生长的敏感性要高于地上部,在盐分浓度过大时会通过减缓根系生长[29-30],降低盐分的吸收,减少其向地上部的运输来防御盐害[31],因此在盐胁迫下植物根冠比会下降[20]。但也有研究认为,在盐胁迫下根系的敏感程度要低于地上部,植物通过增加生物量在根系的分配[32],以加强根对水分和养分的获取,因此其根冠比也会明显增加[33]。本研究表明,在盐胁迫30 d后,各盐分处理的根冠比均略有增加,但在盐胁迫50 d 后,各盐分处理的根冠比均出现不同程度下降。这可能是由于油莎豆幼苗根系对盐胁迫的敏感性比较滞后,但是长时间的盐分胁迫将不利于根系生长,进而造成根冠比下降。
3.2 盐胁迫对油莎豆叶片渗透调节物质的影响
渗透胁迫是植物暴露于盐渍土壤时的主要胁迫,它会造成植物的生理干旱[34],直接影响植物的生长。植物为了抵御盐累积所造成的渗透胁迫,通过可溶性糖、可溶性蛋白、脯氨酸等渗透调节物质积累以提高细胞的渗透调节能力,维持植物的正常吸水和代谢活动[35-37]。脯氨酸是一种优质的具有渗透调节功能的氨基酸,可有效缓解盐胁迫伤害,维持膜结构稳定性[38]。可溶性蛋白是参与各种代谢的酶类,具有保护植物细胞膜和代谢相关酶类的功能[37]。可溶性糖是合成其他有机溶质的碳架和能量来源,对细胞膜和原生质胶体起稳定作用[39]。本研究表明,在盐胁迫30 d 后,各盐分处理下油莎豆叶片脯氨酸、可溶性糖和可溶性蛋白含量均高于CK,但是随盐分胁迫程度加剧脯氨酸含量增加最明显,可溶性糖先显著增加而后又降低,可溶性蛋白变化却不明显。这表明在盐胁迫早期油莎豆主要通过叶片脯氨酸大量积累来减轻盐胁迫。随胁迫时间延长,脯氨酸含量随盐胁迫程度增强先显著下降而后又显著增加,可溶性糖含量则显著增加到一定水平后变化不明显,可溶性蛋白则呈线性显著增加趋势。可以看出,长时间盐胁迫后油莎豆主要通过可溶性蛋白和可溶性糖的大量累积来提高其渗透调节能力,在高盐条件下脯氨酸也会出现大量累积。大多研究表明,随着盐分胁迫程度加剧,脯氨酸、可溶性糖和可溶性蛋白含量呈上升趋势[13,40],但也有研究发现,盐浓度过高时三者均会出现下降[15,27],这与本研究中可溶性糖的变化趋势一致。有研究认为,这主要是不同有机渗透调节物质对盐胁迫的响应差异,可能与各自贡献率不同相关[41]。长时间的盐胁迫导致植物累积了更多的有害物质,需要合成更多的酶类加以清除[42],因此在盐胁迫50 d后可溶性蛋白在细胞渗透调节中起到了更大的作用,成为油莎豆叶片中主要的渗透调节物质,这与对石竹(Dianthus chinensis)[13]的研究结果一致。此外,该时段重度盐胁迫(S4)下过氧化产物MDA的大量累积也反映了油莎豆的细胞膜受到了严重损伤和破坏,所以脯氨酸含量急剧升高,可能是叶片需要累积更多的脯氨酸来维持膜结构的稳定。据此也说明,油莎豆在盐胁迫条件下具有较强的渗透调节能力。
3.3 盐胁迫对油莎豆植株Na+、K+含量及Na+/K+的影响
Na+和K+代谢是植物适应盐渍环境非常重要的生理代谢活动,若打破它们之间的平衡,将对生理作用产生不良影响。Na+对于大多数植物而言是有害的,其过量吸收会引起植物的渗透胁迫,并会抑制K+吸收[43],降低酶活性,扰乱细胞代谢过程[44]。K+则参与了细胞膨压的控制,光合代谢和酶活化,其含量的下降会导致植株生长减缓[45]。本研究表明,随盐分胁迫程度加剧,油莎豆幼苗叶片和根系Na+含量均显著增加,K+含量则显著下降,这与大多数研究结果一致[43,46]。本研究还发现,叶片中K+含量要高于根系,且在中、高度胁迫时叶片和根系K+含量均维持在一个相对稳定的水平,这说明油莎豆对K+具有较强的选择性吸收能力。盐胁迫下将更多的K+运输至叶片中,有利于降低叶片中的渗透胁迫[47],同时还有脯氨酸、可溶性蛋白等渗透调节物质的累积,减缓了植物细胞的失水趋势,所以在高盐胁迫下油莎豆叶片的相对含水量也比较稳定(图3)。因此,适宜的K+累积在一定程度上能够增强油莎豆的生长适应能力。
Na+/K+比是衡量植物耐盐能力的重要的指标,维持适宜的Na+/K+比是植物保障气孔正常功能和一些生理代谢的必要前提,为此Na+/K+比可作为反映植物组织盐离子伤害的一个典型指标[48]。较低的Na+/K+比通常意味着更强的耐盐能力,耐盐植物往往会吸收足够的K+含量来应对盐害[49],本研究中,随NaCl浓度的升高,叶片和根系的Na+/K+比也显著增大,说明细胞质中Na+增加的同时K+外渗,离子平衡遭到破坏,油莎豆生长受到抑制,这与大多研究结果一致[40]。随盐胁迫时间的延长,中度和重度盐胁迫下根系与叶片的Na+/K+比均有不同程度增加。这表明盐胁迫时间越长,Na+/K+比越难维持在合适植物生长的范围,这主要与Na+在油莎豆细胞质中的积累也越严重有关。因此,轻度盐胁迫可能更有利于油莎豆幼苗生长。
3.4 基于隶属函数的盐胁迫下油莎豆耐盐性评价
植物耐盐性会受到多种因素的共同影响,单独选取某一指标进行耐盐性评价会使评价结果片面化,利用模糊数学隶属函数评定油莎豆耐盐性,有助于消除评价结果的局限性[50]。综合评价表明,油莎豆在沙质土壤不同程度盐胁迫下的耐盐性大小为:CK >S1>S2>S3>S4,且CK与S1差异不明显。可以看出,油莎豆的耐盐性随盐胁迫程度加剧而降低。轻度盐胁迫下油莎豆的适应性很强,且有良好的的生长表现。盐胁迫50 d 的耐盐性评价值在各处理之下均低于盐胁迫30 d,说明在沙质土壤中长时间的盐胁迫不利于油莎豆幼苗生长。盐渍化土壤中盐化和碱化相伴而生,有研究发现,轻度盐渍化沙质土壤更利于油莎豆种子出苗[51],但在偏碱性沙质土壤中也能正常生长[52]。本研究中培育油莎豆幼苗的沙土也偏碱性,油莎豆幼苗在沙土轻度盐胁迫下生长良好的主要原因可能是因为碱性环境对低盐胁迫有缓解作用[53]。此外,砂质土壤土质疏松,对油莎豆根系和块茎的生长及后期收获都十分有利[54],因此油莎豆是可以在新疆沙质轻度盐渍化土地和沙质偏碱性轻度盐渍化土壤进行推广种植。
4 结论
通过研究不同浓度盐胁迫下油莎豆幼苗的生长发育变化及生理响应,探讨了油莎豆作为经济作物被种植于沙质盐渍化土壤中的可行性,综合油莎豆在盐胁迫下各生长及生理指标发现:
(1)轻度盐胁迫处理的(≤0.5 g·kg-1)油莎豆幼苗地上和地下部均生长良好,但随胁迫程度加剧和胁迫时间延长明显受到抑制。
(2)油莎豆幼苗在盐胁迫早期主要通过脯氨酸的大量积累来减轻盐胁迫,在后期主要通过可溶性蛋白和可溶性糖的大量累积来提高其渗透调节能力。随盐胁迫程度的加剧,油莎豆幼苗体内叶片和根系Na+含量和Na+/K+比均显著增加,K+含量则显著下降,且下降到一定程度时维持在一个相对稳定的水平。
(3)大量渗透调节物质的累积使盐胁迫下叶片的相对含水量变化较小。表明油莎豆幼苗可通过保持较高的叶片持水能力和渗透调节能力来适应沙质土壤的盐胁迫,但高盐胁迫不宜持续过长时间。本研究对油莎豆在新疆沙质盐渍化土地的推广种植具有重要指导意义。
