外周血细胞因子和炎性细胞在肺癌患者中的表达变化及临床意义
2022-02-03石梦瑶张娜娜王麟彭冲刘明军孙桂荣
石梦瑶,张娜娜,王麟,彭冲,刘明军,孙桂荣
(青岛大学附属医院检验科,山东青岛 266003)
肺癌是我国发病率和死亡率较高的恶性肿瘤,5年生存率低于20%。肿瘤局部的免疫反应和炎症反应所形成的炎症微环境是肿瘤微环境(tumor microenvironment, TME)的重要组成部分,促进肿瘤的发生、发展、侵袭和转移。有资料表明由免疫细胞及组织细胞分泌、在细胞间发挥相互调控作用的细胞因子参与了前列腺癌、乳腺癌及结直肠癌等恶性肿瘤的发生发展过程[1-3]。本研究通过检测不同组织学分型、TNM分期和治疗前后肺癌患者外周血细胞因子和炎性细胞的表达变化,探讨其在肺癌发病中的参与作用及临床意义。
1 材料和方法
1.1研究对象 选取2020年3月至2022年6月青岛大学附属医院经病理诊断确诊、未经任何抗肿瘤治疗的肺癌患者458例,其中男250例,女208例,年龄(57.06±9.35)岁。按2015年版世界卫生组织(World Health Organization,WHO)肺肿瘤组织学分型标准[4],分为非小细胞肺癌(non-small cell lung cancer,NSCLC)组414例(其中腺癌363例、鳞状细胞癌51例)及小细胞肺癌(small cell lung cancer,SCLC)组44例。按国际肺癌研究学会(The International Association for the Study of Lung Cancer, IASLC)第八版肺癌TNM分期标准[5]进行分期,包括肺腺癌组Ⅰ期217例、Ⅱ期50例、Ⅲ期58例、Ⅳ期38例;肺鳞癌组Ⅰ期11例、Ⅱ期12例、Ⅲ期17例、Ⅳ期11例,SCLC组Ⅰ期5例、Ⅱ期7例、Ⅲ期12例、Ⅳ期20例。全部入组病例均排除患支气管和肺部其他疾病(包括上下呼吸道感染、哮喘、慢性阻塞性肺疾病、间质性肺疾病、支气管扩张、肺结核等)、超敏反应、其他器官急性感染、自身免疫病、免疫缺陷病、外伤、急性心脑血管损伤、血液系统疾病,肝、肾功能不全、糖尿病以及其他组织器官恶性肿瘤等疾病。选取同期本院体检健康人员44例作为健康人对照组,其中男25例,女19例,年龄(56.89±10.5)岁,体格检查、实验室检验、胸部影像学、B超等均未见异常,且与肺癌组患者比较,性别和年龄差异均无统计学意义(P>0.05)。
本研究另对同期诊于本院的87例初诊的肺癌患者(肺腺癌Ⅲ期3例、Ⅳ期29例,肺鳞癌Ⅲ期12例、Ⅳ期8例,SCLC Ⅲ期17例、Ⅳ期18例)进行疗效监测,观察这些患者经一线化疗4周期后血浆细胞因子和炎性细胞的变化。所有患者按实体瘤疗效评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)V1.1[6]判定近期疗效,并分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、病情稳定(stable disease,SD)和病情进展(progressive disease,PD)4种级别,并进一步分为两大组,即疾病控制组(CR+PR+SD)和疾病进展组(PD)。本研究经青岛大学附属医院医学伦理委员会批准(批准文号:QYFY WZLL 27257),纳入对象均知情同意。
1.2主要仪器与试剂 12项细胞因子检测试剂盒(青岛瑞思凯尔公司),Navios流式细胞分析仪(美国Beckman Coulter公司),XN-9000全自动血液分析仪及其配套试剂(日本Sysmex公司)。
1.3标本采集 用EDTA-K2抗凝采血管采集健康查体人员和肺癌患者治疗前、后(经4周期化疗后)的清晨空腹静脉血标本。1 000×g离心10 min,取分离出的血浆进行细胞因子检测。全血充分混匀后在全自动血液分析仪上进行炎性细胞检测。
1.4实验室指标检测
1.4.1血浆细胞因子检测 血浆白细胞介素(interleukin, IL)-1β、IL-2、IL-4、IL-5、IL-6、IL-8、IL-10、IL-17、IL-12P70、干扰素(interferon, IFN)-α、IFN-γ、肿瘤坏死因子(tumor necrosis factor, TNF)-α共12种细胞因子检测采用多重微球流式免疫荧光发光法,按照细胞因子检测试剂盒和Navios流式细胞分析仪说明书检测。
1.4.2炎性细胞检测 中性粒细胞计数(absolute neutrophil count, ANC)、淋巴细胞计数(absolute lymphocyte count, ALC)、单核细胞计数(absolute monocyte count, AMC)检测采用荧光流式细胞技术,按照XN-9000全自动血液分析仪及其配套试剂说明书检测,并经计算获得中性粒细胞计数与淋巴细胞计数比值(neutrophil-to-lymphocyte ratio, NLR)、单核细胞计数与淋巴细胞计数比值(monocyte-to-lymphocyte ratio, MLR)。
1.5统计学分析 用SPSS 26.0软件进行。检测数据呈偏态分布,用中位数(四分位数)表示,多组间比较采用Kruskal-WallisH检验,两组间比较采用Mann-WhitenyU检验,治疗前后比较采用Wilcoxon秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1肺癌患者12种血浆细胞因子水平比较 经非参数Kruskal-WallisH检验,对照组、SCLC组和NSCLC组3组间5种血浆细胞因子IL-2、IL-5、IL-6、IL-8和TNF-α水平差异均有统计学意义(H值分别为6.025、10.292、29.821、7.589、11.361,P均<0.05),其余7种细胞因子水平差异无统计学意义;对差异有统计学意义的指标进行两两组间比较,结果表明,与对照组比较,SCLC组血浆IL-6、IL-8、TNF-α水平均明显升高(U值分别为346、663、632,P均<0.05),IL-2和IL-5水平无明显变化,NSCLC组除血浆IL-6、IL-8、TNF-α水平明显升高外,IL-5水平也明显升高(U值依次分别为5 605.5、7 031、6 410.5和6 414.5,P均<0.05),而IL-2水平则明显降低(U值为7 055,P<0.05);与NSCLC组比较,血浆IL-6水平明显升高(U值为6 491,P<0.01),其余4种细胞因子水平无显著变化;与肺腺癌组比较,肺鳞癌组血浆IL-2、IL-6水平明显升高(U值分别为7 138、5 817.5,P均<0.01),其余3种细胞因子水平无明显变化。见表1。

表1 对照组、SCLC组和NSCLC组各血浆细胞因子水平比较[pg/mL,M(P25,P75)]
2.2肺癌患者3种炎性细胞及其比值NLR、MLR水平比较 经非参数Kruskal-WallisH检验,对照组、SCLC组、NSCLC组3组间3种炎性细胞ANC、ALC、AMC和NLR、MLR水平差异均有统计学意义(H值分别为21.725、22.653、21.885、43.562、62.339,P均<0.001)。对差异有统计学意义的指标进行两两组间比较,结果表明,与对照组比较,SCLC组和NSCLC组ANC、AMC、NLR、MLR水平均明显升高(SCLC组U值分别为481、466、302和223,NSCLC组U值分别为5 427、5 568、4 330和3 621,P均<0.001),ALC水平均明显降低(SCLC组U值为474,NSCLC组U值为6 096.5,P均<0.001);与NSCLC组比较,SCLC组NLR、MLR水平明显升高(U值分别为6 587.5和5 554,P均<0.01),ALC水平则明显降低(U值为666 1,P<0.01),ANC和AMC水平无明显变化;与肺腺癌组比较,肺鳞癌组ANC、AMC、NLR、MLR水平明显升高(U值分别为5 309.5、5 044.5、5 738和4 849,P均<0.001),ALC水平则无显著变化。见表2。
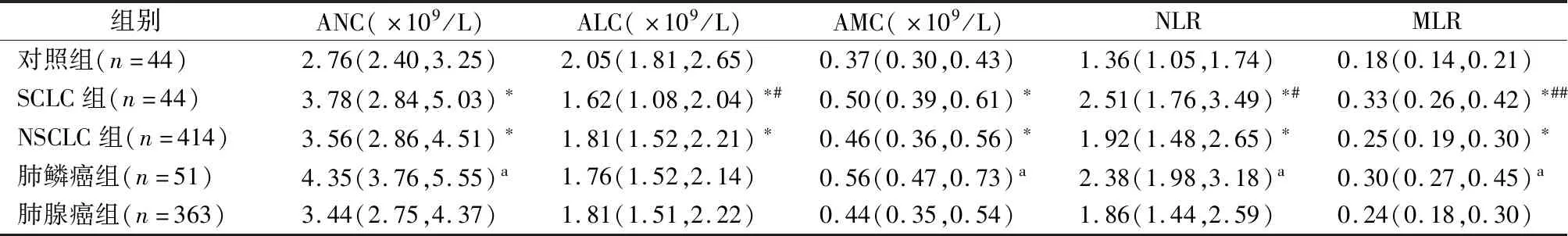
表2 肺癌组与对照组各炎性细胞水平比较[M(P25,P75)]
2.3不同TNM分期肺癌患者血浆细胞因子和炎性细胞水平变化 分析肺癌患者差异表达的5种血浆细胞因子IL-2、IL-5、IL-6、IL-8、TNF-α水平及3种炎性细胞ANC、ALC、AMC和NLR、MLR水平在不同TNM分期肺癌患者中的表达变化,结果见表3、表4。Mann-WhitneyU检验分析结果表明,SCLC组Ⅲ/Ⅳ期患者仅血浆IL-6水平明显高于Ⅰ/Ⅱ期(U值为97.5,P<0.05),其余4种细胞因子水平差异则无统计学意义;NSCLC组Ⅲ/Ⅳ期患者血浆IL-5、IL-6、IL-8水平明显高于Ⅰ/Ⅱ期(U值分别为14 954.5、11 048、15 243,P均<0.05),其余3种细胞因子水平无显著变化,结果见表3。同时,SCLC组Ⅲ/Ⅳ期NLR、MLR明显高于Ⅰ/Ⅱ期(U值分别为90、65,P均<0.01),ALC则明显低于Ⅰ/Ⅱ期(U值为96,P<0.05),ANC、AMC水平差异则无统计学意义;NSCLC组Ⅲ/Ⅳ期患者ANC、AMC、NLR、MLR表达均高于Ⅰ/Ⅱ期(U值分别为12 237.5、14 370.5、12 617.5和14 245,P均<0.01),ALC水平无明显变化。
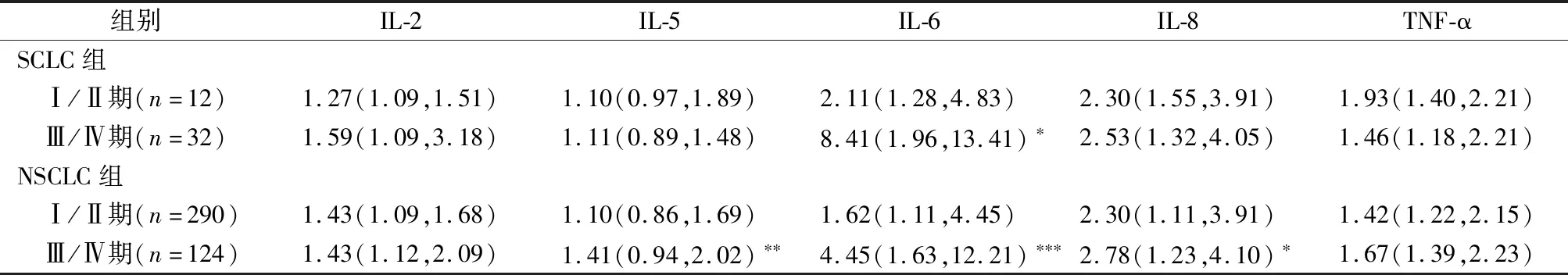
表3 不同TNM分期肺癌患者5种血浆细胞因子水平变化[pg/mL,M(P25,P75)]
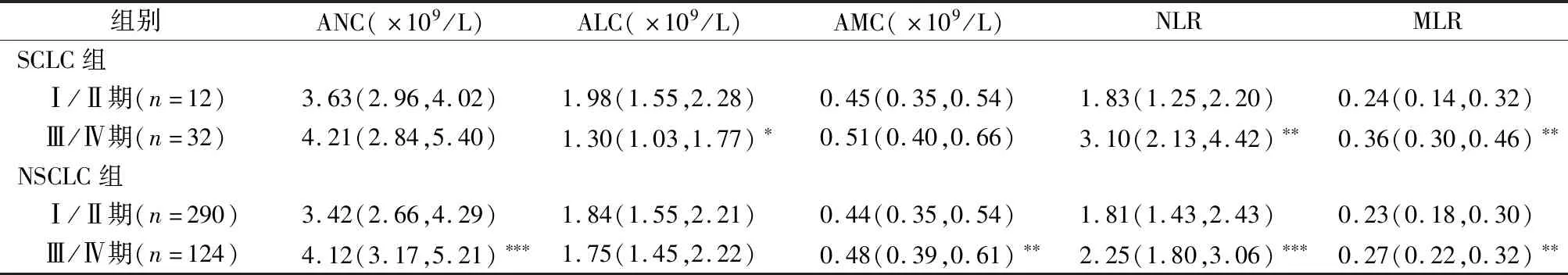
表4 不同TNM分期肺癌患者炎性细胞水平变化[M(P25,P75)]
2.4不同疗效晚期肺癌组患者化疗前、后血浆IL-6、IL-8、TNF-α细胞因子水平及ANC、ALC、AMC、NLR、MLR炎性细胞水平变化 87例初诊的肺癌患者经一线化疗4周期后血浆IL-6、IL-8、TNF-α及ANC、ALC、AMC、NLR、MLR水平变化见表5和表6,按RECIST实体瘤分级V1.1标准判定的近期疗效评估结果为: CR患者0例,PR患者28例,SD患者34例,PD患者25例。疾病控制组(CR+PR+SD)和疾病进展组(PD)两组在治疗前血浆IL-6、IL-8、TNF-α水平差异无统计学意义(P均>0.05)。经4周期治疗后,疾病控制组血浆IL-6、IL-8、TNF-α水平较治疗前明显降低(P均<0.05),而疾病进展组明显升高(P均<0.05),并且经4周期治疗后疾病进展组血浆IL-6、IL-8、TNF-α水平明显高于疾病控制组(U值分别为441.5、415.5、372,P均<0.01)。同时,治疗前两组间ANC、ALC、AMC、NLR、MLR水平差异也均无统计学意义(P均>0.05),经4周期治疗后疾病控制组ANC、ALC、NLR水平明显低于治疗前(P均<0.05),AMC、MLR水平则无明显变化;疾病进展组治疗后ANC、AMC、NLR、MLR水平均较治疗前明显升高,ALC水平则明显降低(P均<0.05),并且经4周期治疗后疾病进展组ANC、AMC、NLR、MLR水平明显高于疾病控制组(U值分别为244.5、385.5、372,P均<0.001),而ALC水平则明显降低(U值为552.5,P<0.05)。
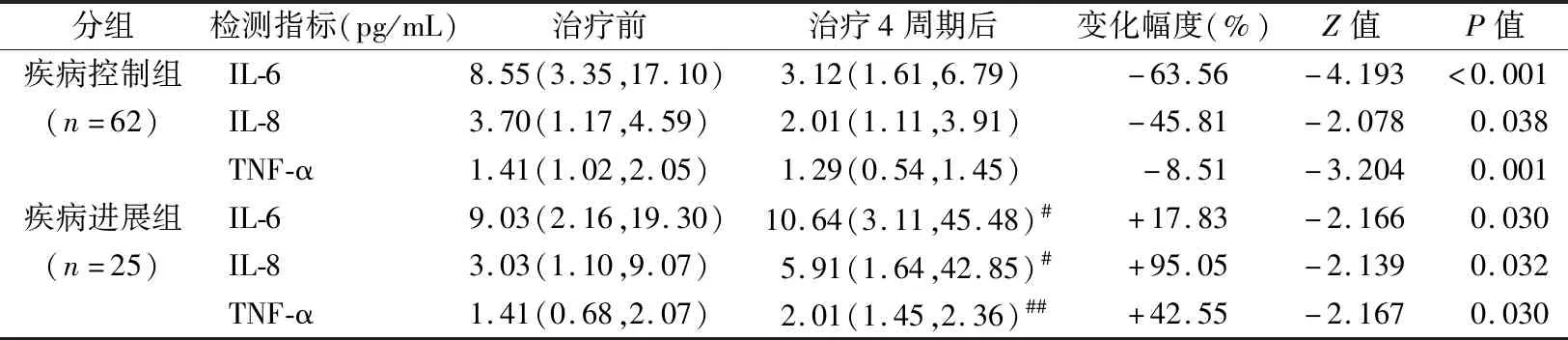
表5 不同疗效晚期肺癌组患者化疗前后血浆IL-6、IL-8、TNF-α水平变化[M(P25,P75)]
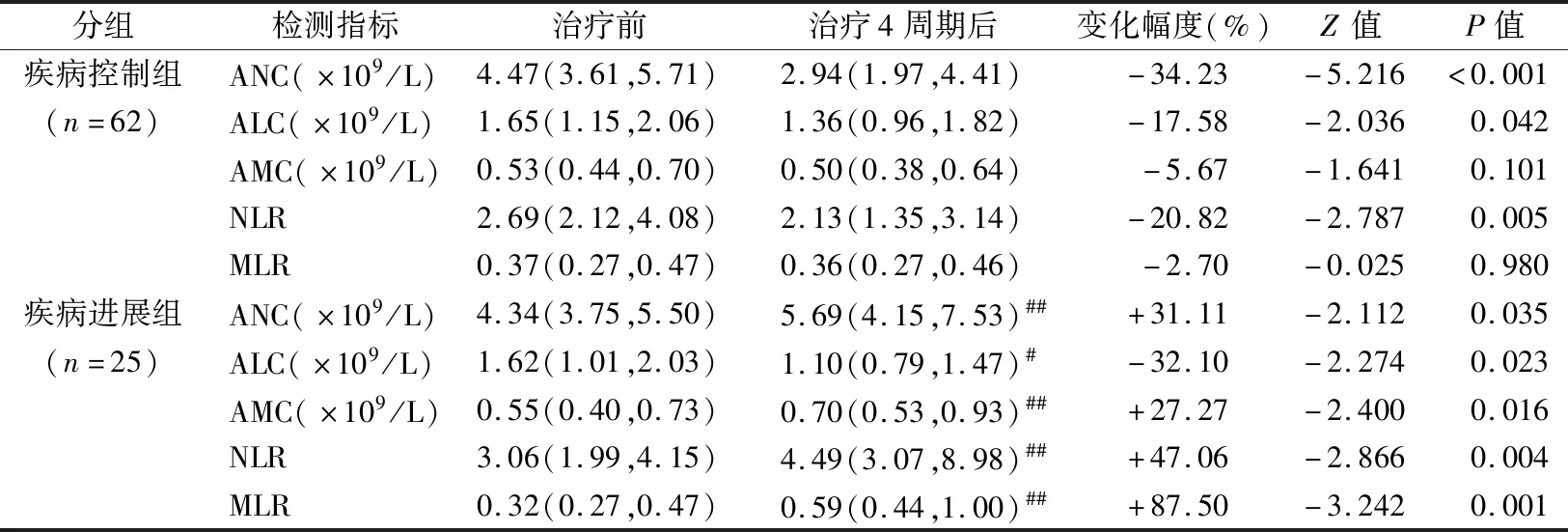
表6 不同疗效晚期肺癌组患者化疗前后ANC、ALC、AMC、NLR、MLR水平变化[M(P25,P75)]
3 讨论
TME主要由肿瘤细胞和免疫细胞(中性粒细胞、单核/巨噬细胞、T/B淋巴细胞)以及其产生的细胞因子、趋化因子和生长因子等所构成,彼此间相互作用,形成复杂的网络,从而影响机体的免疫状态[7-8]。细胞因子在机体免疫调节、宿主防御等机制中扮演重要角色,其中IL-6作为多效性细胞因子广泛表达于单核/巨噬细胞、淋巴细胞、内皮细胞、成纤维细胞中,IL-2、IL-4、IL-5、IL-10、IL-17主要由淋巴细胞分泌,IL-1β、IL-8、IL-12主要来源于单核/巨噬细胞,IFN-α、IFN-γ作为IFN家族成员代表主要由淋巴细胞、巨噬细胞等分泌[9]。本研究结果显示,SCLC组、NSCLC组和对照组3组间血浆IL-2、IL-5、IL-6、IL-8和TNF-α水平差异显著,其余7种细胞因子水平3组间比较则无明显差异,预示前5种细胞因子可能是肺癌相关细胞因子。进一步分析发现,SCLC组仅血浆IL-6、IL-8、TNF-α 3种细胞因子水平发生变化,明显高于对照组;NSCLC组血浆IL-5、IL-6、IL-8和TNF-α水平明显高于对照组,IL-2水平明显低于对照组,另见SCLC组血浆IL-6水平明显高于NSCLC组,肺鳞癌组血浆IL-2和IL-6水平明显高于肺腺癌组,这些结果均表明,血浆IL-2、IL-5和IL-6的表达因肺癌的组织病理学类型不同而异。IL-2作为Th1型细胞因子,在NSCLC患者表达受抑制可能与患者外周血Th1细胞数目减少有关。IL-5主要由Th2型细胞分泌,Th2型细胞介导的体液免疫抑制Th1型细胞介导的细胞免疫,使肿瘤细胞更易发生免疫逃逸[8],Th1/Th2型细胞的失衡所致的Th1/Th2漂移可能与NSCLC发生发展的病理学机制有关。SCLC患者血浆IL-6水平和NSCLC患者血浆IL-5、IL-6、IL-8水平均随肺癌分期的升高而升高,表明IL-5、IL-6、IL-8协同作用促进肿瘤细胞增殖。肺癌晚期患者经4个周期系统化疗后,病情控制组血浆IL-6、IL-8和TNF-α水平较治疗前明显降低,而病情进展组三者不仅没有降低反而又进一步明显升高,综上表明,多种细胞因子参与了肺癌的疾病发生和发展。有资料表明IL-6广泛表达于包括肺癌在内的多种恶性肿瘤中,通过与肿瘤浸润免疫细胞表面IL-6受体结合,激活下游JAK/STAT3信号通路,诱导肿瘤促进因子、VEGF等的表达,参与肿瘤细胞增殖、侵袭和转移,也可直接作用于肿瘤细胞诱导其 STAT3 靶基因的表达,从而驱动肿瘤细胞的增殖和存活[2-3,10]。IL-8可通过自分泌和旁分泌的形式作用于肺癌细胞,主要通过IL-8通路或EGFR的反式激活发挥促肺癌细胞有丝分裂作用,以及通过CXCL8和VEGF协同作用促进内皮细胞迁移和肿瘤血管生成[11-13]。肿瘤浸润细胞刺激TME中的单核/巨噬细胞产生大量TNF-α,高表达的TNF-α激活TNF-α/TNFR2信号通路,上调的TNFR2通过激活NF-κB诱导多种激酶活化从而引起肿瘤生长[2,14],同时TNF-α表达增加进一步促进巨噬细胞分泌IL-6,IL-6和TNF-α又可增加肺泡上皮细胞中VEGF的表达,促进肿瘤血管生成[13]。IL-2通过刺激T细胞、NK细胞和B细胞等效应细胞的表达发挥抗肿瘤作用[15],肿瘤进展时,机体免疫系统失衡出现免疫抑制,IL-2表达受到抑制[8],本研究也发现NSCLC组肺癌患者血浆IL-2水平明显低于对照组,也可能是IL-2表达受到抑制所致。IL-5参与B细胞的分化及嗜酸性粒细胞的活化[9],但关于IL-5在肿瘤生物学中的作用机制尚不明确。Hayama等[16]发现NSCLC患者恶性胸腔积液中IL-5过表达,且与恶性细胞数量相关,因此推断IL-5在肺癌的发展、侵袭等过程中发挥重要作用。研究发现嗜酸性粒细胞增多与NSCLC的进展和不良预后相关[17],由此可见其机制可能与IL-5促进嗜酸性粒细胞聚集相关,通过调节有利于肿瘤生长的TME促进肿瘤细胞增殖。
本研究有关外周血炎性细胞的研究结果显示,SCLC组、NSCLC组和对照组3组间外周血ANC、ALC、AMC、NLR和MLR水平差异存在统计学意义,说明肺癌患者机体内存在炎症反应和免疫失衡。进一步分析发现,SCLC组和NSCLC组外周血ANC、AMC、NLR、MLR水平均明显高于对照组,ALC水平明显低于对照组。与NSCLC组比较,SCLC组NLR、MLR水平明显升高,ALC水平明显降低;另见肺鳞癌组ANC、AMC、NLR、MLR水平明显高于肺腺癌组,以上结果均说明不同病理学分型肺癌患者的外周血炎性细胞的表达存在差异,提示TME中免疫细胞分布比例也可能存在差异。随肺癌分期的升高,SCLC患者NLR、MLR水平升高,而ALC水平降低,NSCLC患者ANC、AMC、NLR、MLR水平均升高,表明炎性细胞在SCLC和NSCLC疾病进展中的参与机制不尽相同。SCLC进展主要与淋巴细胞免疫调节能力减弱相关,而NSCLC进展则与中性粒细胞、单核细胞发挥促肿瘤作用更密切,肺癌晚期患者经4个周期系统化疗后,病情控制组ANC、ALC、NLR水平较治疗前明显降低,而病情进展组ANC、AMC、NLR、MLR水平明显升高,ALC水平明显降低,进一步反映了肺癌的发生发展与炎症反应密不可分。有资料表明淋巴细胞作为肿瘤免疫应答的核心,其中主要以T淋巴细胞介导的细胞毒作用和所释放的细胞因子抑制肿瘤细胞的增殖、转移[8,17];在肿瘤发生早期中性粒细胞在CXCL8等的刺激下活化并渗透到TME中形成肿瘤相关中性粒细胞(TANs),TANs通过抑制免疫反应及产生炎症因子、蛋白酶等衍生物来促进肿瘤细胞的运动和存活;外周血单核细胞是肿瘤相关巨噬细胞(TAMs)的主要来源,TAMs通过分泌促有丝分裂的相关因子促进肿瘤生长及增强免疫抑制作用,同时通过释放VEGF等促进肿瘤血管生成和肿瘤细胞的侵袭[7,17-18]。
综上所述,细胞因子IL-2、IL-5、IL-6、IL-8和TNF-α和炎性细胞ANC、ALC、AMC、NLR和MLR在不同组织学分型肺癌的发生发展中发挥了既相同又相异的作用,检测外周血细胞因子和炎性细胞可以为肺癌的病理学分型、TNM分期和疗效评估提供有价值的参考依据。
