OsWD40过表达水稻根系响应盐胁迫的转录组分析
2022-02-03闻丹妮鲍聆然刘蒙蒙
闻丹妮 鲍聆然 刘蒙蒙 沈 波
(杭州师范大学生命与环境科学学院,311121,浙江杭州)
水稻是重要的粮食作物,提高其产量和扩大其种植面积对确保世界粮食安全具有举足轻重的作用。盐胁迫是影响水稻产量的主要因素之一,其主要危害是产生离子毒性和渗透胁迫,干扰细胞质中的K+/Na+稳态,导致胞浆K+/Na+比值降低[1]。根系作为水稻生长发育必不可少的器官,直接接触土壤中的盐离子,并在离子运输中起着关键作用,是最先感受逆境胁迫的器官[2]。过量的Na+和Cl–积累导致离子失衡,损害根系细胞膜的选择性,从而间接影响水稻地上部产量、品质和抗逆性等诸多农艺性状的表现[3-4]。
WD40蛋白在真核生物中极其丰富,且高度保守[5]。WD40结构域可介导蛋白质―蛋白质或蛋白质―DNA相互作用,从而形成动态复合物或者作为支架蛋白发挥作用,调节多种细胞过程,参与RNA处理、核输出、细胞分裂调控、信号转导和激素反应等重要的细胞活动[6-9]。Xu等[10]发现,拟南芥WD40蛋白XIW1与核转运受体XPO1相互作用,促进脱落酸(ABA)响应并抑制种子萌发,同时促进盐胁迫对种子萌发的抑制作用。Kong等[11]在小麦中鉴定出1个TaWD40D新基因,表现为盐胁迫和渗透胁迫响应的正向调控因子。而在水稻盐胁迫响应的全基因组分析中,发现5个编码对盐胁迫有响应的WD40蛋白基因(SRWD1~SRWD5),其中,SRWD1的表达可能与水稻品种对盐胁迫的敏感性相关[12]。这些结果说明,WD40蛋白在植物盐胁迫反应中具有重要作用。
目前,转录组测序(RNA-Seq)技术已成为研究基因表达谱的常用方法,如对耐盐水稻Xian 156和盐敏感水稻IR28进行转录组分析,发现激素和钙的信号传导途径、离子代谢和转移、氮代谢和次生代谢等参与对盐胁迫的响应[13]。本实验室前期运用生物信息学和同源克隆的方法,在水稻中找到了1个编码WD40重复蛋白的基因OsWD40,通过转基因技术获得OsWD40过表达水稻株系。OsWD40编码1个功能未知的含7个WD40重复序列的蛋白质,其表达受到NaCl胁迫及ABA影响。前期试验[14]显示,OsWD40过表达水稻株系在200mmol/L NaCl处理12、24和48h时的根系活力均高于日本晴,分别为日本晴的1.30、1.90和3.85倍。本研究主要对盐胁迫下OsWD40过表达水稻苗期根系进行转录组分析,以期揭示OsWD40参与耐盐的分子机制。
1 材料与方法
1.1 试验材料
本研究所用水稻材料为日本晴(Oryza sativa L.ssp.japonica.cv.Nipponbare)和以日本晴为受体的T6代OsWD40过表达转基因水稻株系。
1.2 试验设计
1.2.1 盐胁迫处理 日本晴和OsWD40过表达株系种子经浸种和催芽后,移入96孔植物水培盒,在30℃光照培养箱内培养,光照强度12 000lx,光照周期为14h光照/10h黑暗。待水稻幼苗2周龄时,用含200mmol/L NaCl的水稻营养液处理,分别在0、12、24和48h时对根系取样,液氮速冻,存入-80℃低温冰箱。委托杭州联川生物技术股份有限公司完成RNA的提取、质控、建库及Illumina Novaseq™6000测序工作,每个时间点取样均进行3次重复。
1.2.2 原始数据的过滤与组装 使用cutadapt软件对下机原始数据进行去除接头处理,然后对数据进行去除低质量序列和重复序列后得到有效数据。使用HISAT2将得到的有效数据比对到日本晴水稻参考基因组上。使用StringTie软件对基因或转录本进行初组装,将所有样本的初组装结果进行合并,用gffcompare软件检测转录本与参考注释的比较得到最终的组装注释结果。
1.2.3 差异表达基因筛选及功能富集分析 使用ballgown包提供文件输入进行FPKM定量。采用DEGseq 2软件比较日本晴和OsWD40过表达株系在盐胁迫相同时间(分别记为ST0 vs NT0、ST12 vs NT12、ST24 vs NT24和ST48 vs NT48)的基因表达量,并进行显著差异分析,将差异倍数在2倍以上,即Fold Change≥2倍或Fold Change≤0.5倍且P<0.05的基因定义为差异基因,将其注释到GO和KEGG数据库中,获得差异表达基因的功能注释及相关代谢通路信息。
1.2.4 qRT-PCR验证 参照RNA提取试剂盒(康为世纪生物科技股份有限公司)说明书提取水稻根系总RNA。用NanoDrop检测RNA质量和浓度。参照HiFiScript cDNA Synthesis Kit试剂盒说明书合成cDNA的第1条链。根据已知的基因序列,设计引物(表1)。参照SYBR Premix Ex TaqTMII(TaKaRa公司)说明书进行实时荧光定量PCR,在CFX96TM型荧光定量PCR仪(BIO-RAD)中进行扩增反应,每个反应重复3次。基因相对表达量计算方法采用 2-ΔΔCT。

表1 荧光定量引物及序列Table 1 The primer and sequences of qRT-PCR
1.3 数据处理
采用SPSS 20.0进行单因素方差分析(oneway ANOVA),以Duncan’s进行多重比较,利用SigmaPlot 10.0软件进行作图。
2 结果与分析
2.1 测序质量分析
测序样品产生的原始数据经去除低质量和带测序接头的数据后,其每个样本的Q20%(测序错误率小于0.01)均在99.97%及以上,Q30%(测序错误率小于0.001)均大于97.97%,GC含量在50.5%~52.5%,有效数据占原始数据的比例在93.34%~96.98%(表2),说明数据的可靠性高。以日本晴为参考基因组,将短数据比对到参考基因组上,每个样本的比对率均在88.71%及以上,双端比对率均在72.54%~84.38%。与此同时,比对到参考基因组的正链和负链的数据量相近,进一步说明测序数据的高准确性。
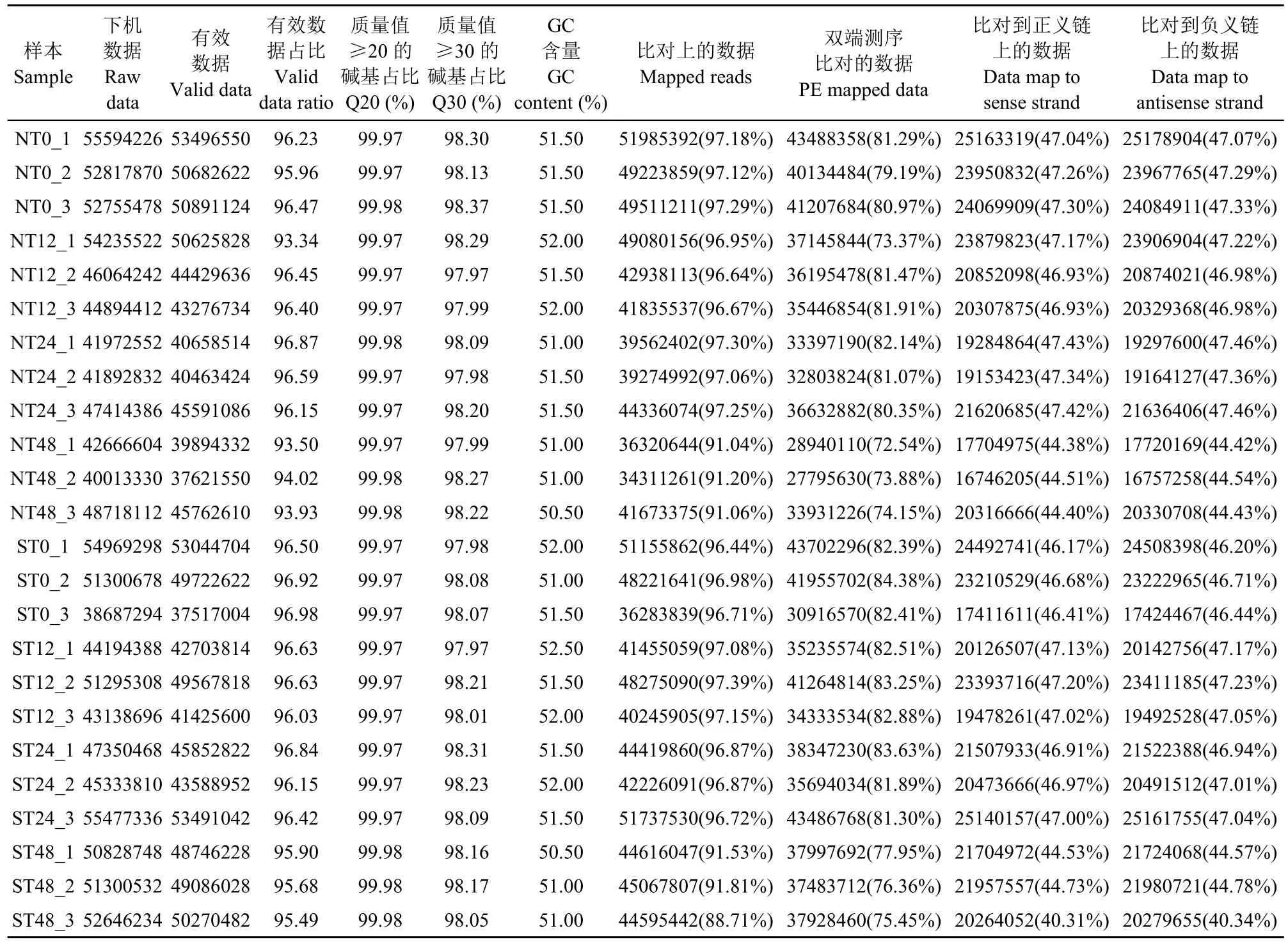
表2 各样本测序总数量及有效数据在参考基因组上的比对Table 2 The number of sequencing obtained from each sample and the clean reads mapped to the reference genome
2.2 样本关系分析
样本间的主成分分析(图1a)显示,对照(0h)与盐胁迫样本间距离较远,说明盐胁迫导致各样本在基因表达水平上发生显著的差异。与此同时,日本晴盐胁迫24与48h的样本聚集在一起,样本间基因表达水平差异较小,而OsWD40过表达株系盐胁迫24与48h的样本之间距离相对较远,基因表达水平差异较大,说明OsWD40过表达株系在盐胁迫后的表达响应具有持续性。从测序样本相关性热图(图1b)可知,相同处理测序样品间Pearson相关性系数极高(R>0.990),不同处理及品种间样品基因表达水平存在较大差异,相关性系数小,说明相同处理测序样品间重复性高,系统误差较小,结果可信度极高。


图1 测序样本关系Fig.1 The relationship of all surveyed samples
2.3 差异表达基因分析
转录组测序数据(图2)显示,盐处理0、12、24和48h,OsWD40基因在过表达株系的表达量分别为317.97、280.65、183.68和93.45,而在日本晴中的表达量均小于1,说明OsWD40基因在转基因株系中确实过表达。比较日本晴和OsWD40过表达株系在盐胁迫相同时间(ST0 vs NT0、ST12 vs NT12、ST24 vs NT24和ST48 vs NT48)的基因表达量,在没有盐胁迫时,有954个基因显著上调,996个显著下调;盐胁迫12h后有1027个基因显著上调,619个显著下调;盐胁迫24h后总差异表达基因数目显著增加,达到3499个,其中2955个基因显著上调,544个显著下调;盐胁迫48h后有416个基因显著上调,1061个显著下调。盐胁迫24h,2个株系之间的总差异基因数目最多,其中上调的基因数占到了84.45%。推测这些差异基因可能是导致2个株系耐盐性不同的关键基因。

图2 各比较组的差异表达基因数Fig.2 Number of differently expressed genes in each comparison group
韦恩图分析(图3)发现,有258个基因在4个盐处理相同时间的比较组中均呈现差异表达,其中包括许多参与非生物胁迫响应的重要基因,如OsRLCK5、OsWRKY41和OsWRKY61等。蛋白激酶OsRLCK5在OsWD40过表达株系中显著上调,其可以与谷氧还蛋白OsGRX20相互作用,参与抗坏血酸―谷胱甘肽循环系统的激活,从而调节活性氧平衡以增强水稻对非生物胁迫的抗性[15]。有136个基因在盐胁迫12、24和48h时呈差异表达,但在没有盐胁迫时没有显著差异,这些差异表达基因包括钾转运蛋白(OsHAK5)、E3泛素连接酶基因(Os02g0682300)、脱落酸8′-羟化酶基因(OsABA8ox2)和根系发育调控基因(Os04g0556350)。OsHAK5属于HAK钾转运蛋白家族成员,是分蘖发育、侧根生长、根毛生长和生长素运输途径之间的汇合点。在胞外存在大量Na+的条件下,OsHAK5表现出对Na+不敏感的K+转运蛋白活性,能够用来提高植物细胞对盐的耐受性[16-17]。

图3 不同比较组间的差异表达基因韦恩图Fig.3 Venn diagram of differently expressed genes between different comparison groups
2.4 差异表达基因的GO功能分析
对日本晴和OsWD40过表达株系在盐胁迫相同时间(ST0 vs NT0、ST12 vs NT12、ST24 vs NT24和ST48 vs NT48)的差异基因进行GO功能富集分析。生物进程的GO功能富集分析柱状图结果(表3)显示,防御响应(GO:0006952)、蛋白质磷酸化(GO:0006468)、以DNA为模板的转录调控(GO:0006355)、对ABA的响应(GO:0009737)、对盐胁迫的响应(GO:0009651)和次生代谢产物的生物合成过程(GO:0044550)等条目在没有盐胁迫及盐胁迫所有时间富集到的差异基因数目均较多。细胞组分富集的差异表达基因较多的条目包括核(GO:0005634)、质膜(GO:0005886)、膜的组成部分(GO:0016021)和细胞外区域(GO:0005576)等。分子功能GO分析结果表明,与蛋白结合(GO:0005515)相关的差异表达基因最多。

表3 各比较组中重要GO条目的差异表达基因数目Table 3 The number of DEGs of important GO terms in each comparison groups
显著富集到的GO功能条目分别有178、165、225和142个(P<0.05)。每组显著排名前20的GO条目如图4所示,其中细胞外区域(GO:0005576)在没有盐胁迫和盐胁迫12h时显著富集;几丁质酶活性(GO:0004568)在盐胁迫12和48h时显著富集;氧化还原酶活性(GO:0016709)在没有盐胁迫及盐胁迫12和48h时显著富集。
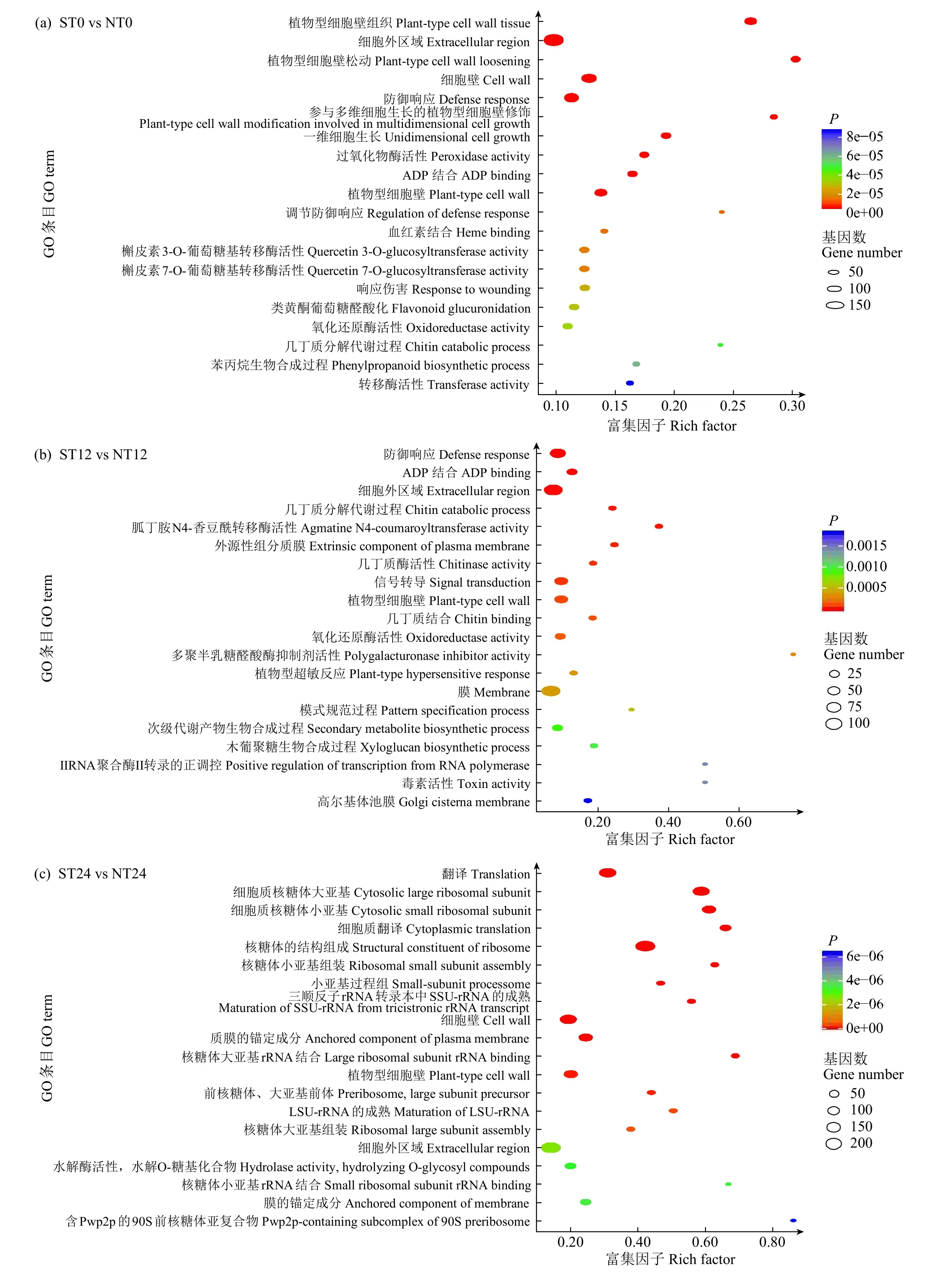

图4 差异表达基因的GO功能富集分析气泡图Fig.4 Bubble chart of GO enrichment analysis of differently expressed genes
2.5 差异表达基因的KEGG代谢通路分析
对日本晴和OsWD40过表达株系盐胁迫相同时间(ST0 vs NT0、ST12 vs NT12、ST24 vs NT24和ST48 vs NT48)的差异表达基因进行KEGG富集分析,分别有609、460、1208和444个基因得到注释(表4)。表4显示了各比较组差异基因数目较多的重要代谢通路。这些重要的代谢通路主要有植物激素信号转导(ko04075)、植物MAPK信号传导途径(ko04016)、半胱氨酸和蛋氨酸的代谢(ko00270)、淀粉和蔗糖代谢(ko00500)、苯丙烷生物合成(ko00940)、类黄酮生物合成(ko00941)和二萜类生物合成(ko00904)等。其中,分别有53、28、67和33个差异表达基因参与植物激素信号转导的,有63、39、67和30个差异表达基因参与苯丙烷生物合成。推测这些通路在OsWD40过表达水稻根系响应盐胁迫中发挥着重要作用。

表4 差异表达基因数较多的重要KEGG代谢通路Table 4 Important KEGG metabolic pathway with a large number of differently expressed genes

续表4 Table 4(continued)
2.6 转录因子相关基因分析
转录因子在植物对抗非生物胁迫中发挥着非常重要的作用。对各比较组的差异表达基因分析(表5)显示,WRKY、MYB和bHLH等转录因子在盐胁迫0、12、24和48h时都呈现出差异表达。盐胁迫24h时差异表达的转录因子数高达68个,其中,上调55个,约占79.03%,而下调的转录因子仅13个,上调的转录因子包括13个MYB和13个bHLH家族转录因子。盐胁迫48h时共有33个转录因子差异表达,其中8个转录因子上调,25个下调,下调的转录因子数明显多于上调的转录因子数。没有盐胁迫和盐胁迫12h时上调基因数与下调基因数在同一数量水平。
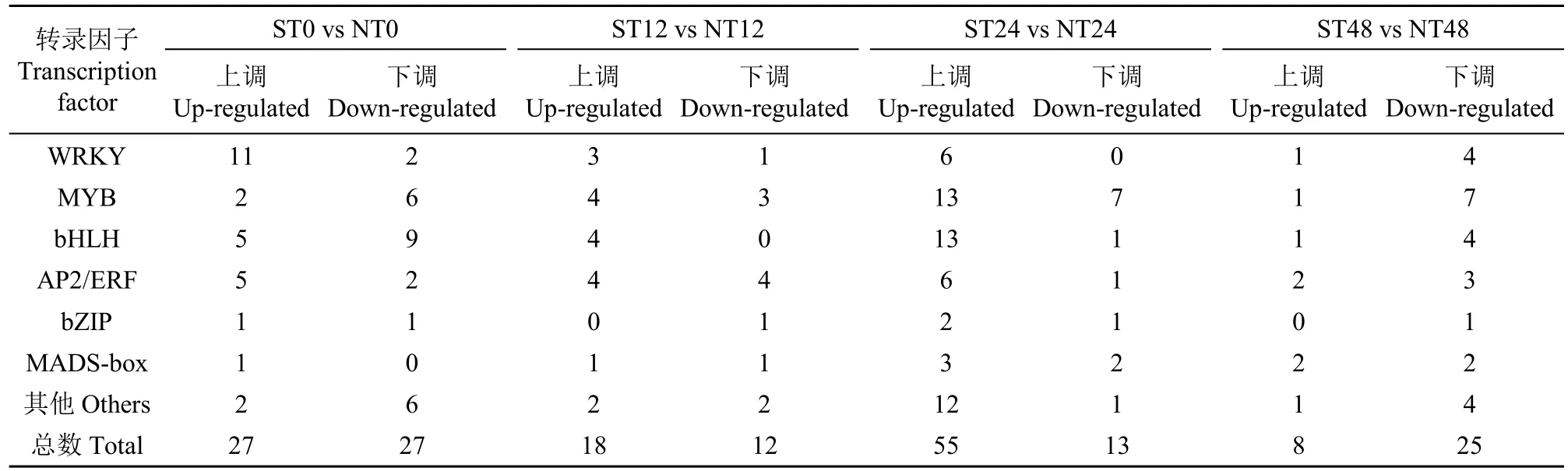
表5 日本晴和OsWD40过表达株系之间差异表达基因中与转录因子相关的基因数Table 5 Number of differently expressed genes related to transcription factors between Nipponbare and OsWD40 overexpression line
2.7 转录组测序数据的qRT-PCR验证
为了验证转录组测序结果的真实性,从盐胁迫相关基因和ABA响应相关基因中挑选了6个差异表达基因[LOC_Os11g03300(OsNAC10)、LOC_Os05g39770(OsAMTR1)、LOC_Os07g47100(OsNHX1)、LOC_Os06g10880(OsbZIP46)、LOC_Os03g44380(OsNCED3)、LOC_Os05g46480(OsLED3)],在日本晴和OsWD40过表达株系4个盐处理时间点的根系组织中对它们的转录水平进行了qRT-PCR验证分析。尽管转录组测序数据(表6)与qRT-PCR验证(图5)获得的基因差异倍数在数值上不完全一致,但各差异表达基因的变化趋势是一致的(R2=0.7791),这表明转录组测序数据较为可靠。
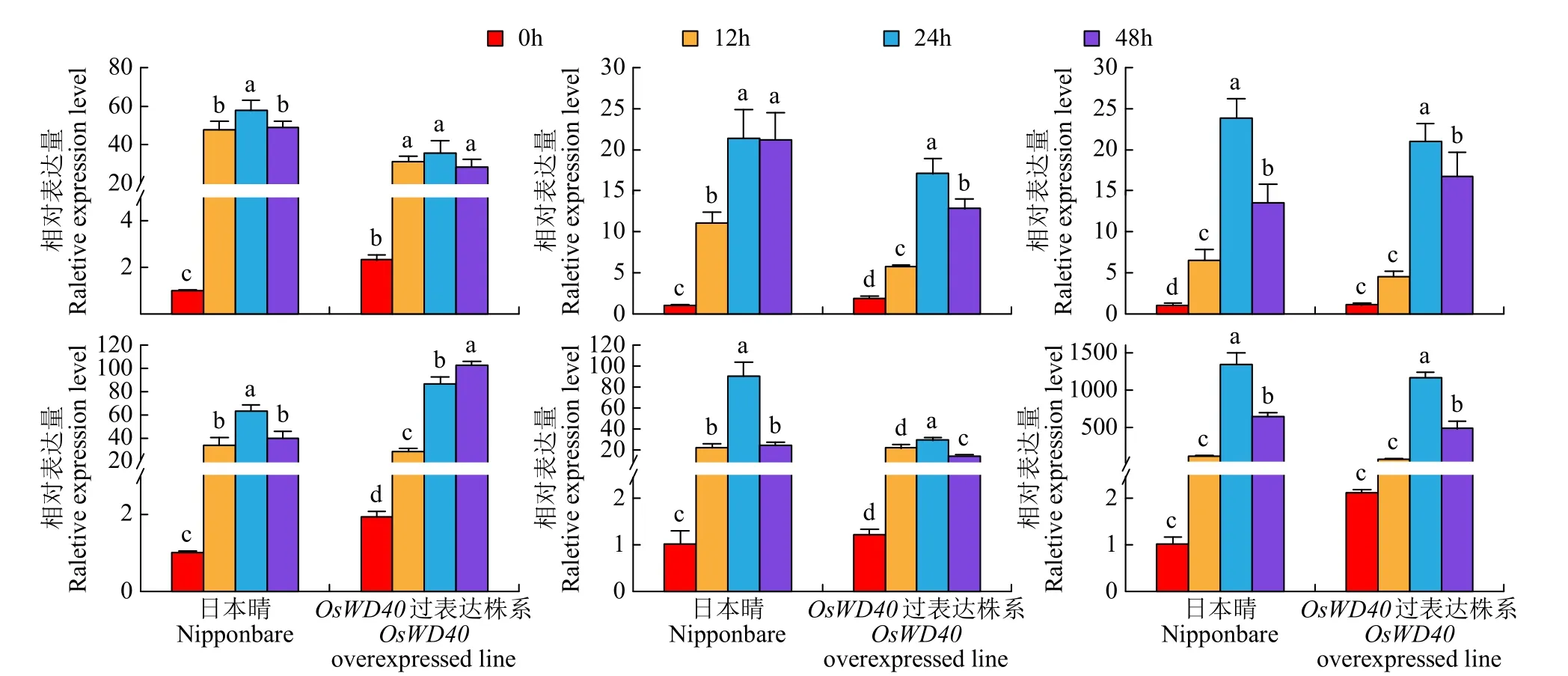
图5 盐胁迫不同时间差异表达基因的qRT-PCR分析Fig.5 qRT-PCR analysis of differently expressed genes at different hours after salt treatment

表6 各差异表达基因转录组测序数据Table 6 Transcriptome sequencing data of each differentially expressed genes
3 讨论
本研究选择水稻根系作为试验取材部位,采用遗传背景差异仅在OsWD40是否过表达的日本晴和OsWD40过表达株系进行转录组分析,更利于解析在盐胁迫下OsWD40引起的基因表达差异,了解OsWD40基因在水稻根系耐盐中的分子机制。
植物激素,尤其是ABA,在植物非生物胁迫响应中起着至关重要的作用[18],还能介导植物对一些逆境胁迫的生理反应,如盐胁迫导致的气孔关闭,以增加植物的抗逆性等,并通过胁迫信号转导以控制基因表达[19]。OsPYL/RCAR5是水稻中有功能的ABA受体,调控依赖ABA的相关基因的表达,在种子萌发和幼苗生长过程中正向调节ABA信号传导,也是非生物胁迫应激基因表达的正向调控因子[20]。编码bZIP转录因子的基因OsABI5在水稻幼苗中可被ABA和高盐诱导表达,在水稻中过量表达OsABI5后对盐胁迫高度敏感,抑制OsABI5的表达而提高了水稻的抗逆性[21]。本研究通过对日本晴和OsWD40过表达株系在盐胁迫相同时间的根系差异表达基因的GO富集分析发现,4个比较组在对盐胁迫的响应(GO:0009651)和对ABA的响应(GO:0009737)的GO条目中富集到的差异表达基因数目均较多。对ABA的响应分别富集到了19、20、33和20个差异表达基因,对盐胁迫的响应分别富集到了22、6、41和14个差异表达基因。另外,4个比较组富集到植物激素信号转导(ko04075)和植物MAPK信号传导途径(ko04016),这2条KEGG代谢通路的差异基因也很多,这些差异基因包括OsPYL2和OsABI5。OsABI5在日本晴和OsWD40过表达株系中均上调表达,但是在OsWD40过表达株系中的上调幅度显著小于日本晴。结合OsWD40启动子中包含多个响应ABA胁迫的作用元件,我们可以推测,在水稻受到盐胁迫时,OsWD40会介导根系中多个响应ABA的基因差异表达,进一步影响下游盐胁迫相关基因表达,从而提高水稻的耐盐性。
次生代谢产物是植物为了适应逆境所产生的特异物质,是植物长期与环境共存并不断适应的结果,在植物适应生态环境的过程中充当着重要的角色,促进植物适应环境胁迫[22]。苯丙烷生物合成是植物次生代谢十分重要的途径之一,也是产生黄酮类化合物、香豆素和木质素等许多其他重要化合物的起点。黄酮类化合物在稳定细胞结构以及维持细胞膜的流动性中起到了重要作用[23]。本研究通过对日本晴和OsWD40过表达株系在盐胁迫相同时间的根系差异表达基因进行KEGG代谢通路分析,发现苯丙烷生物合成(ko00940)通路在4个比较组中都显著富集,分别有63、39、67和30个差异表达基因。另外,有19、18、31和14个差异表达基因参与类黄酮生物合成(ko00941)。4-香豆酸:辅酶A连接酶(Os4CL1)是单木质醇类和黄酮类生物合成中苯丙素代谢途径中的一个关键酶[24],在盐胁迫0和48h时都检测到该基因在日本晴和OsWD40过表达株系之间差异表达。过氧化物酶基因OsPOX1参与苯丙烷生物合成,与日本晴相比,该基因在OsWD40过表达株系中显著上调表达,其余差异表达基因有很大一部分被推定编码过氧化物酶前体。过氧化物酶前体可以形成过氧化物酶体,过氧化物酶体是高度动态、代谢活跃的细胞器,主要参与脂肪酸等脂质的代谢及产生和清除不同的活性氧,从而提高植物对非生物环境的适应性[25]。这些结果说明苯丙烷生物合成和类黄酮生物合成等植物次生代谢途径参与了OsWD40基因介导的水稻根系耐盐性。
众所周知,转录因子在胁迫信号转导等方面起着至关重要的作用。目前已经鉴定的与耐盐有关的转录因子家族有WRKY、MYB、NAC、bHLH和AP2/ERF等[26]。WRKY家族转录因子不仅在调节植物对非生物和生物胁迫的反应中有着密切的联系,还能调节根系发育[27]。在拟南芥中过表达OsWRKY42的植株具有更高水平的花青素含量,并显示出对盐胁迫的强耐受性[28]。Zhao等[29]发现了一条新的信号途径,MYB转录因子可直接与ABA受体PYL8直接相互作用,干扰ABA与生长素信号之间的网络,从而促进侧根的生长恢复。过表达OsMYB3R的拟南芥转基因植物增加的了对冷、干旱和盐胁迫的耐受性,同时在种子萌发时,转基因植株比野生型对ABA或NaCl具有更高的耐受性[30]。SNAC1基因是从水稻中鉴定的转录因子NAC超家族,在250mmol/L NaCl条件下,过表达SNAC1的棉株比野生型植株生长更旺盛,尤其是在根系发育方面,证明SNAC1通过增强根系发育来提高棉花对盐的耐受性[31]。bHLH家族转录因子在激素处理下可以适当的速率维持根系细胞的伸长[32]。OsbHLH120(qRT9)通过改善田间条件下的根部厚度和根长来增强水稻对非生物胁迫的防御能力[33]。Cao等[34]发现,OsBIERF1、OsBIERF3 和 OsBIERF4受盐、冷和干旱胁迫而上调,OsBIERF蛋白可能参与对不同非生物胁迫响应的信号传导途径。在本研究中,有大量转录因子在各比较组中差异表达,并且与日本晴相比,大部分转录因子在OsWD40过表达株系中是上调表达的,盐胁迫0、12、24和48h时分别有27、18、55和8个转录因子家族基因上调表达。盐胁迫24h时有55个转录因子上调表达,仅13个下调表达,上调的转录因子包括6个WRKY转录因子(OsWRKY29等)、13个MYB转录因子(OsMYB106等)、13个bHLH转录因子(OsbHLH120等)和6个AP2/ERF转录因子(OsBIERF1等)。这些结果表明,OsWD40可能引起大量转录因子的差异表达,并在根系响应盐胁迫过程中发挥重要作用。
4 结论
本研究对日本晴和OsWD40过表达水稻在盐胁迫下的差异表达基因进行分析,在转录组水平上解析了OsWD40可能引起的水稻根系耐盐的分子机制。OsWD40作为WD40重复蛋白家族的一员,在盐胁迫下引起苯丙烷生物合成及类黄酮生物合成等植物次生代谢途径的改变,同时介导响应ABA的基因转录调控,从而激活下游盐胁迫相关基因的表达。这为进一步挖掘耐盐关键基因和培育耐盐水稻新品种奠定了理论基础。
