不同营养液配方及栽培基质对兰屿肉桂幼苗生长的影响*
2022-02-02黄稚清胡思玲柯碧英
黄稚清 胡思玲 柯碧英 吴 刚
(广东生态工程职业学院,广东 广州 510520)
兰屿肉桂Cinnamomum kotoense属于樟科樟属常绿乔木,原产于我国台湾省。其叶片亮绿、树型美观、耐阴、适应能力强,是良好的的盆栽观叶树种和园景树种[1]。植株能散发淡淡幽香,具有净化空气的作用。此外兰屿肉桂还具有极佳的药用价值[2]。积极摸索兰屿肉桂优质苗的快繁技术对提升兰屿肉桂产业发展质量尤其是园林应用有重要作用。当前研究兰屿肉桂栽培主要集中在播种繁殖,也有应用组织培养技术繁殖兰屿肉桂的初步研究[3-4]。还未涉及兰屿肉桂水培方面的研究,因此本文旨在研究营养液不同浓度和不同栽培基质类型对肉桂水培生长的影响,以便筛选出较好的水培营养液配方,以期为兰屿肉桂优质苗快繁技术规程、优质栽培和提升兰屿肉桂品质提供技术参考。
1 材料与方法
1.1 实验材料及预处理
本实验所用的兰屿肉桂幼苗为1 a 生幼苗,2021 年9 月14 日购买于广州市陈村花卉世界,健康状况良好,叶片浓绿,无病虫害,主干通直,平均株高约为30 cm。
幼苗购置后统一栽种于广东生态工程职业学院森林培育实训大棚中使其充分适应栽培地的环境。2021 年10 月14 日先将实验用的兰屿肉桂幼苗从土培改为水培,10 月14 日至11 月28 日期间全部幼苗均用清水水培,待植株充分适应水培条件。自2021 年11 月29 日开始,根据分组添加营养液和设置栽培基质。预处理到实验期间温度7.9~28.7 ℃,相对湿度48.8%~92.3%。
1.2 实验方法
通过查阅前人文献,以霍格兰和阿农通用营养液[5]为基本配方并不断进行调整,于2019—2020 年陆续开展一系列预实验,运用了不同配方成分组合的营养液进行处理并观察植株的生长状况。最后根据植株表现筛选出了2 个效果较好的配方,具体成分信息参照表1,营养液分组名称、浓度、水培基质类型参照表2。根据配方提前配置好母液,每次更换营养液时按比例稀释并添加除藻剂,使用剂量为每10 L 水添加1 mL 除藻剂。
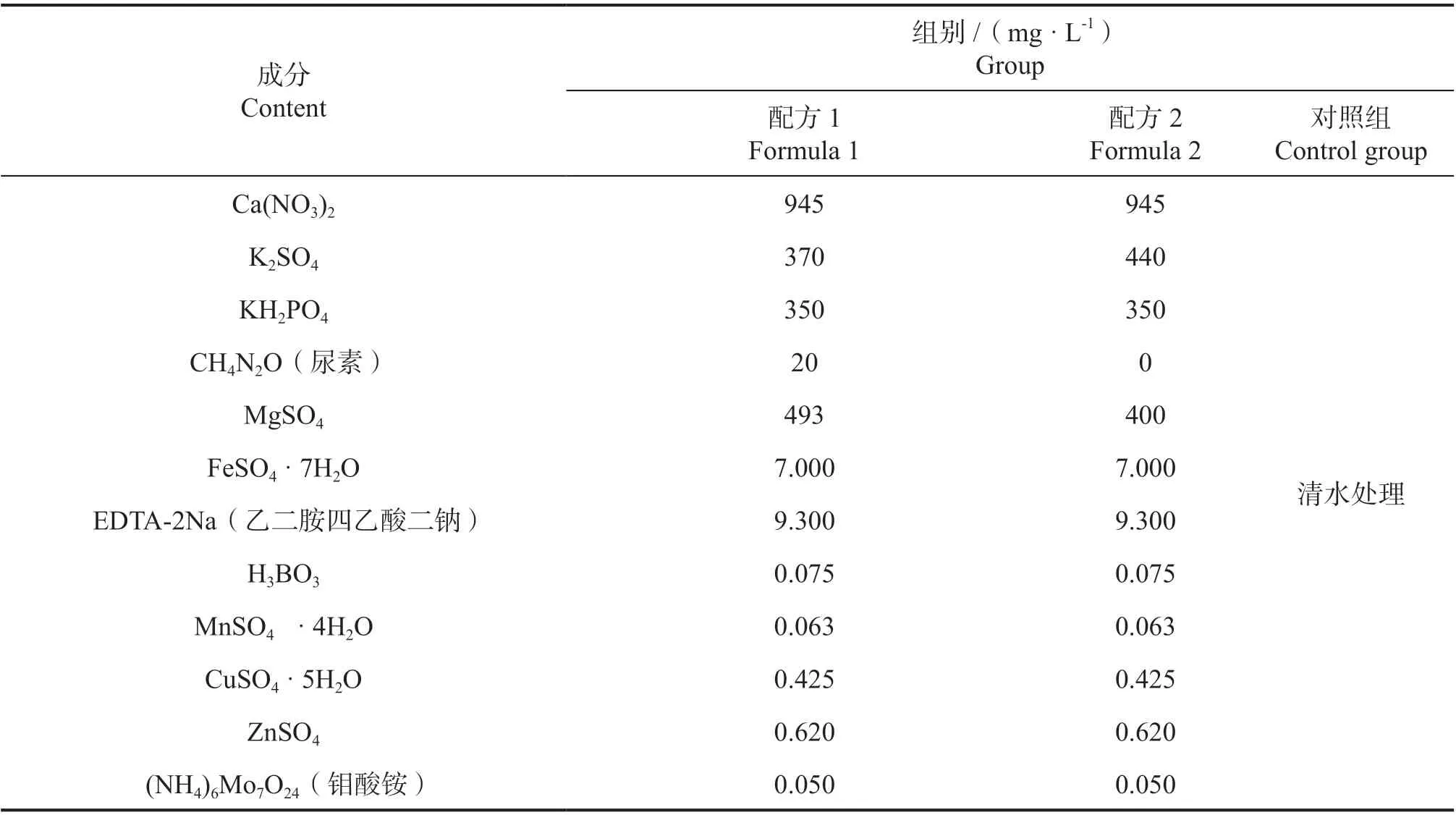
表1 不同营养液配方的元素成分配方Table 1 Elemental formulation of different nutrient solutions
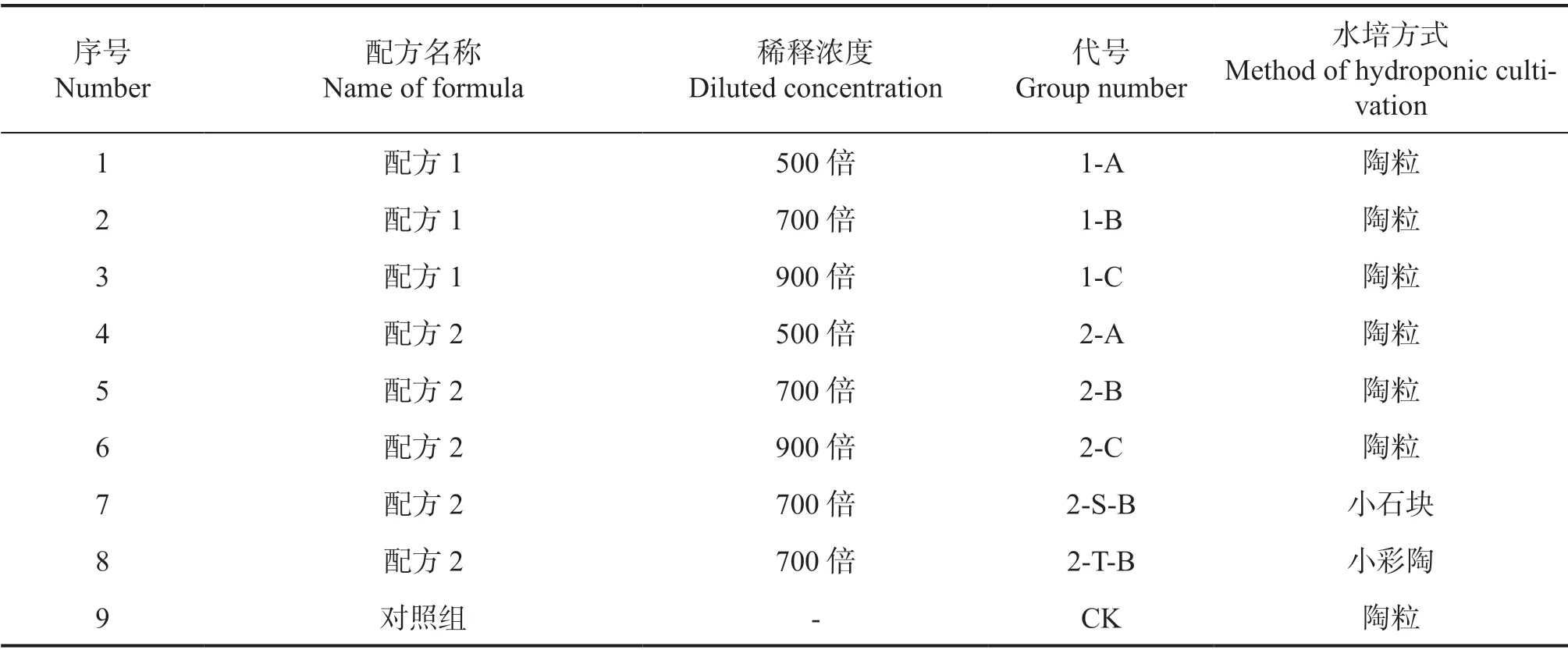
表2 不同营养液配方的浓度与分组Table 2 Concentrations of different nutrient solution formulations and groups
营养液水培实验从2021 年11 月29 日开始。共设置8 组实验组,1 组对照组则用等量的清水进行水培。每组设置了9 株幼苗作为重复。依照确定好的配方分别装入各组的水培容器中,对照组添加清水水培。参考陈永华等人[6]的水培处理方式,本实验采用定植篮进行水培栽种,并在定植篮中加入栽培基质固定植株。定植篮放置在盛有营养液的玻璃杯中,营养液的装入量为淹没定植篮中兰屿肉桂原有根部的1/2 处,其余部分暴露于空气中(图1)。将兰屿肉桂幼苗移植入自然光照条件下的温室大棚内栽植。至2022 年1 月15 日,取出所有水培植株并记录各组的鲜质量和干质量、根系和叶片生长等数据。

图1 水培定植示意Fig.1 Diagram of water planting
1.2.1 根系和叶片生长测定方法 水培0 d 时,定植前先记录每株幼苗当前的根系生长情况和叶片生长情况,用小钢尺测量植株高度。水培48 d 后从定植篮中取出幼苗,擦干幼苗表面水分,放置在空白纸上,清点幼苗新生根系条数、成熟叶片数目、新芽数,并用游标卡尺测量最长的根系长度,用小钢尺测量植株高度。
1.2.2 生长量测定方法 于水培48 d 采集兰屿肉桂幼苗植株后,分别称取地上部分、地下部分的鲜质量。再将植株放入烘箱中,先105 ℃杀青30 min,再在80 ℃烘干至恒重,分别称取地上部分、地下部分的干质量。
1.2.3 水培营养液的pH 和电导率测定方法 自2021 年11 月29 日开始每隔4 d 测定营养液pH、电导率,后更换营养液。更换后调整营养液pH和电导率与原始值一致。营养液pH 使用Ohaus Starter 3100 仪器进行测定,电导率使用DDS-12D仪器进行测定。
1.3 数据处理
获得的数据使用Microsoft Excel 2010 进行整理分析,绘图使用Origin 2018 绘制。
2 结果与分析
2.1 不同配方营养液及营养液浓度对水培兰屿肉桂生长的影响
2.1.1 根系生长 2 个配方稀释700 倍时进行水培对促进根系萌发的能力较差,900 倍浓度更有利于兰屿肉桂根系生长。如表3 所示,经过营养液水培48 d 后,除了1-B 和2-B 处理组,其余各处理组的新根萌发数都超过了对照组。其中新根数最多的是2-A,新根条数均值为17.000±18.056。CK 的最长根系长度均值为3.967±2.388 cm,1-C、1-A、2- C 处理组的最长根系长度超过了CK。1-B 和2-B 处理组的最长根长度都较CK 的小。
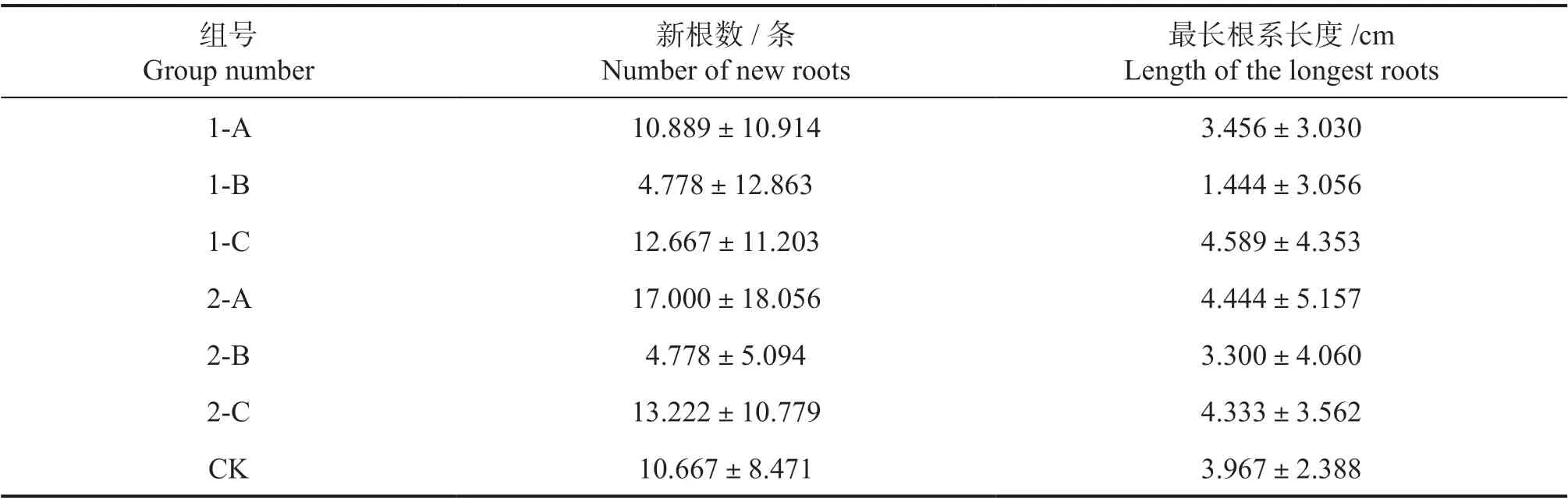
表3 水培48 d 后不同配方营养液及营养液浓度对水培兰屿肉桂根系生长的影响Table 3 Root growth of C. kotoense seedlings with different nutrient solutions and different concentrations of formulations after water planting 48 days
2.1.2 茎干叶生长 如表4 所示,对比开始营养液水培0 d 和水培48 d 后的植株高度,各处理组的株高都有不同程度的增高,其中株高增幅最快的2-B,增幅最慢的是2-A,说明配方2 稀释700倍时对植株增高较好。总体而言各处理组的成熟叶片数相较于水培0 d 时都有不同程度的减少,对照组在水培0 d 和水培48 d 成熟叶片数目几乎没有变化。配方2 稀释700 倍时最有利于植株,总体而言配方2 的成分相较于配方1 更有利于兰屿肉桂幼苗的新芽萌发。配方2 的不同浓度处理组的新芽数均多于CK 组,而配方1 不同浓度处理组的新芽数均低于CK 组,1-B 没有新芽萌发。说明可能配方2 相较于配方1 更有利于促进兰屿肉桂幼苗萌发新芽。
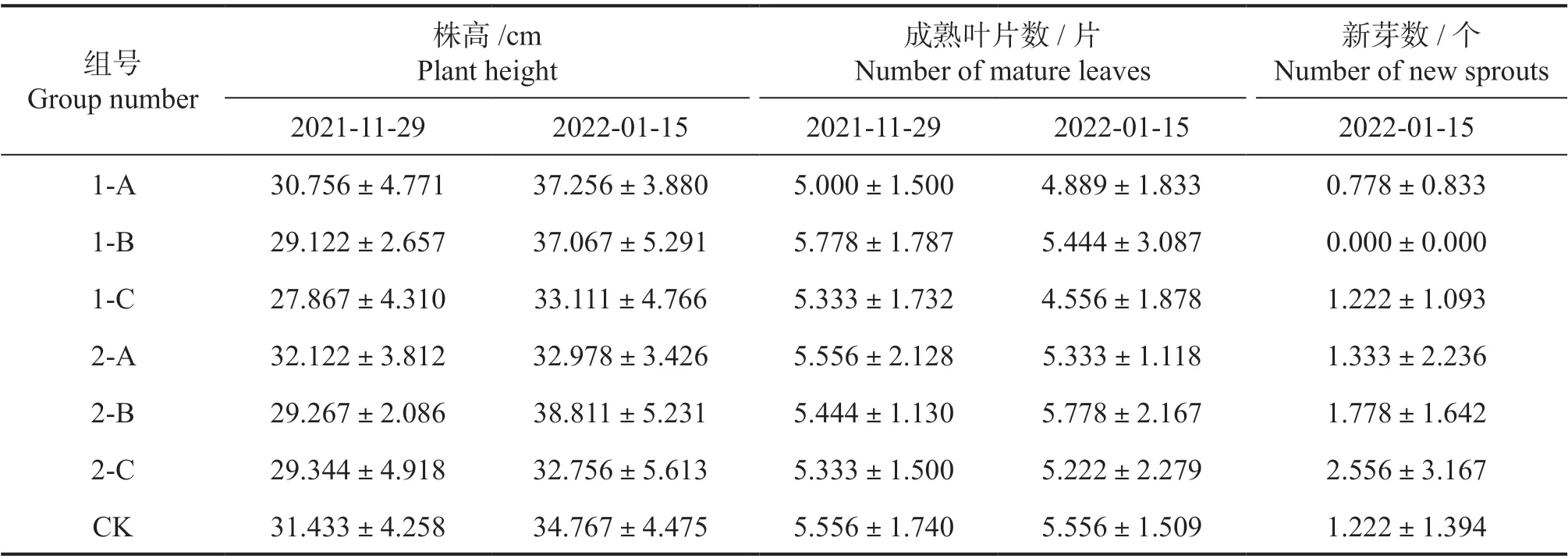
表4 水培0 d 和48 d 后不同配方营养液及营养液浓度对水培兰屿肉桂茎干叶生长的影响Table 4 Stem and leaves growth of C. kotoense seedlings with different nutrient solutions and different concentrations of formulations at the beginning and after 48 days of water planting
2.1.3 生长量 总体来看,2 个配方稀释700 倍条件下更有利于兰屿肉桂地上部分有机物质积累。如表5 所示,鲜质量中,仅有2-B 的地上部分的鲜质量高于对照组的质量,地下部分中1-B、1-C、2-C 的鲜质量低于对照组。总鲜质量中也仅有2-B的质量高于对照组质量。在干质量中,地上部分中仅有1-B 和2-B 的质量高于对照组。干质量地下部分中,配方1 的3 个浓度和配方2 的2-C 质量均没有超过对照组。总干质量,除了1-B 和2-B外,其余均为超过对照组。
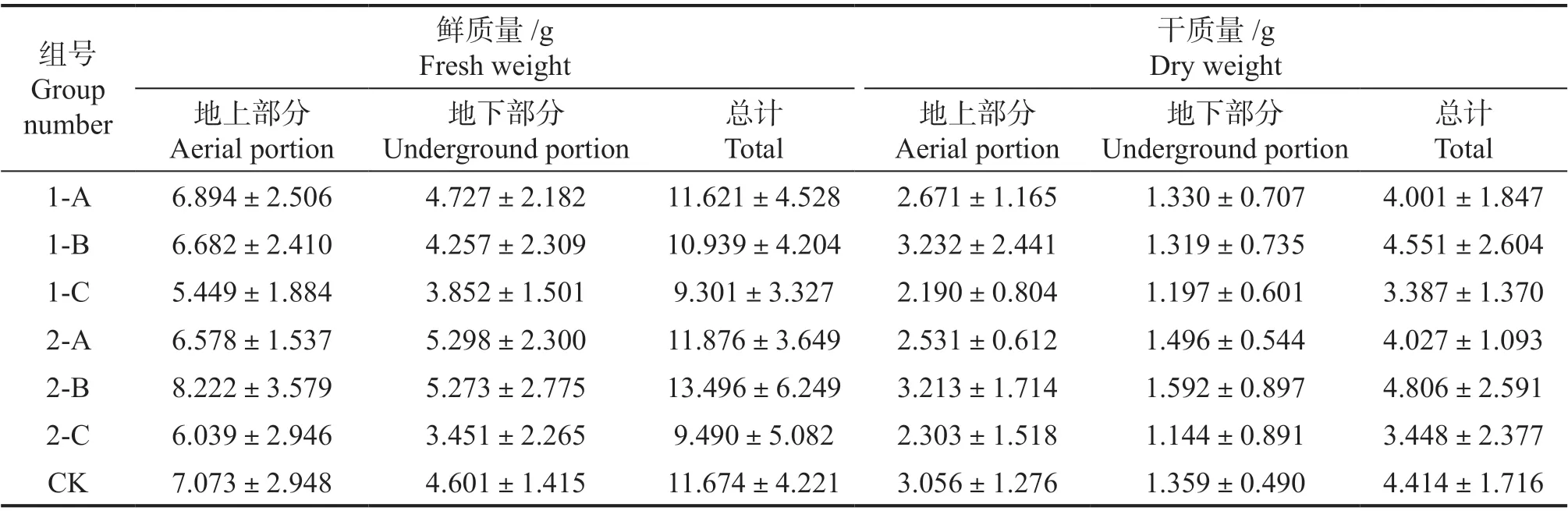
表5 水培48 d 后不同配方营养液及营养液浓度对水培兰屿肉桂生长量的影响Table 5 Biomass of C. kotoense seedlings with different nutrient solutions and different concentrations of formulations after 48 days of water planting
2.1.4 营养液pH 和电导率 各组的营养液pH 在水培48 d 期间无明显的规律性,但每次测定时营养液pH 都比调整pH 有所增大,呈碱性;各处理组的营养液电导率变化总体趋势大致都呈现先下降后上升的趋势,且每次测定营养液电导率时可见电导率比调整时有所下降。
如图2 所示,水培过程中,1-A 的营养液pH波动较大的时间段在0~24 d,后趋于变化较为平稳的状态,在16 d 时达到峰值。1-B 和1-C 均在12 d 时达到峰值,1-B 也在40~48 d 时变化趋于稳定。2-A 先呈波动状上升后又下降,2-B 总体变化趋势为先增,在24 d 达到峰值又呈下降的趋势。2-C 的总体变化趋势为先增后降再增最后下降。
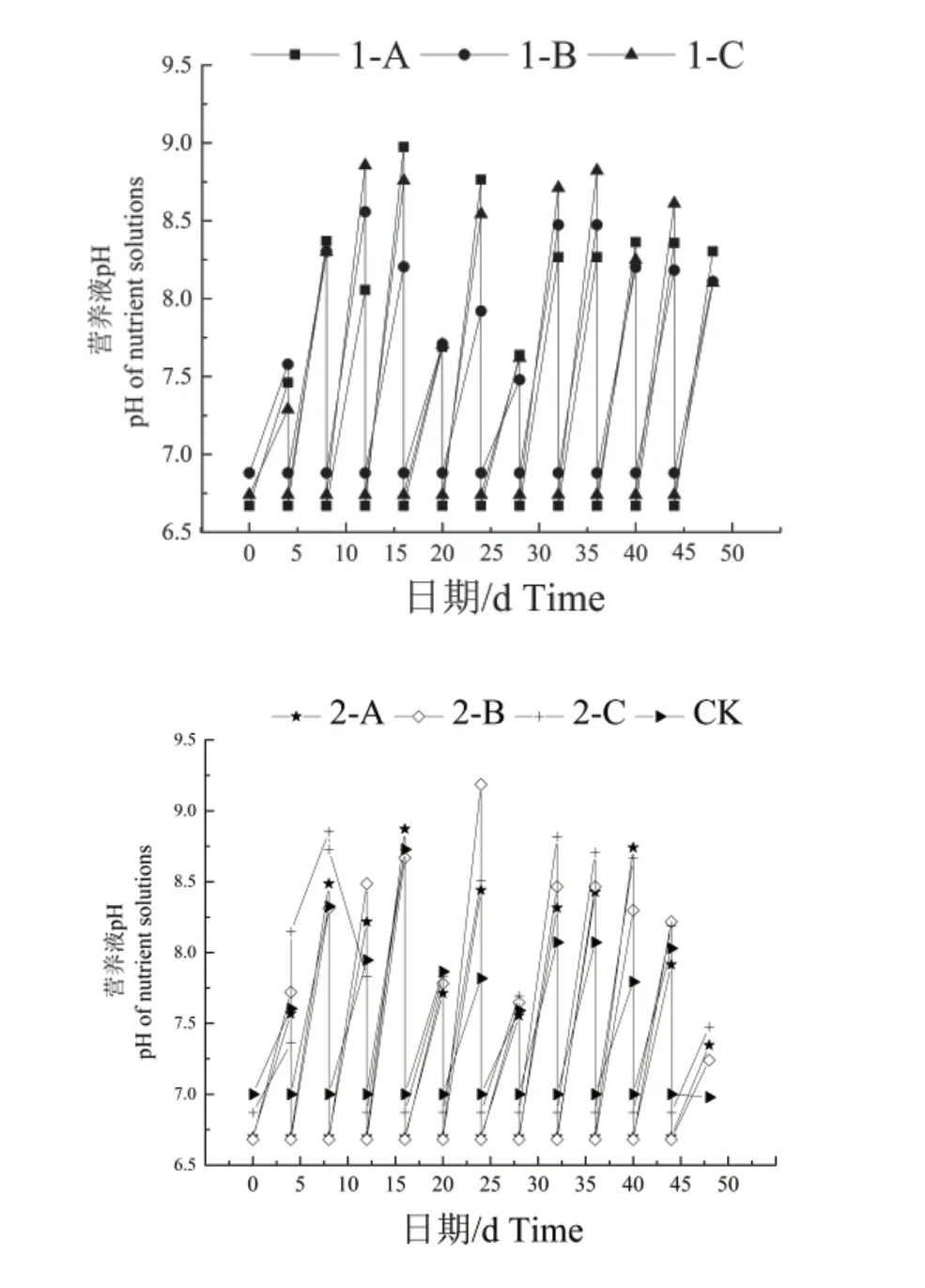
图2 水培48 d 后不同配方营养液及营养液浓度处理下营养液pH 的变化Fig.2 pH of nutrient solutions with different nutrient solutions and different concentrations of formulations after 48 days of water planting
如图3 所示,水培0 d 时刚添加营养液时2-B浓度在几个处理组里最高,为0.53 mS/cm。配方1中,1-B 和1-C 的电导率变化波动较1-A 的大;配方2 中的3 个处理组在0~16 d 变化趋势保持一致,测定的数值均值也较为接近。在48 d,各处理组的营养液电导率都有了较为明显的增高。除1-C外,各处理组均在32~36 d 时电导率达到最小值。
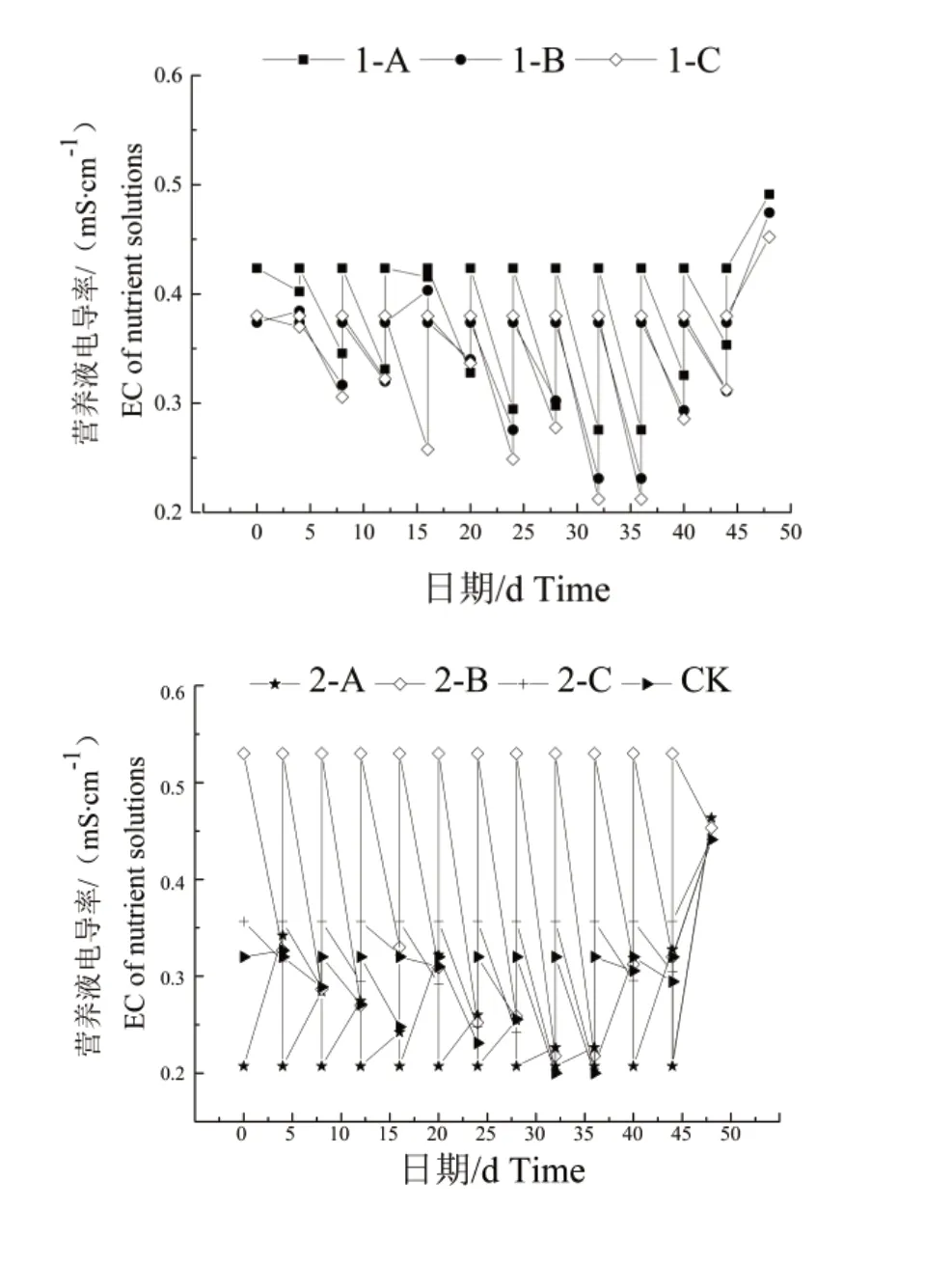
图3 水培48 d 后不同配方营养液及营养液浓度处理下营养液电导率的变化Fig.3 EC of nutrient solutions with different nutrient solutions and different concentrations of formulations after 48 days of water planting
2.2 不同栽培基质对水培兰屿肉桂生长的影响
2.2.1 根系生长 使用陶粒作为栽培基质对兰屿肉桂幼苗根系生长效果最好。如表6 所示,处理组均使用配方2 的700 倍浓度处理并使用不同的栽培基质,可以看到2-S-B 和2-T-B 处理组新根数目和最长根系长度不如2-B 的数目多,且明显低于对照组CK(P<0.01)。2-T-B 的新根数目要多于2-S-B,2-S-B 的最长根系长度要长于2-T-B。这表明使用石块和彩陶作为栽培基质时,水培根系的生长效果不如使用陶粒。
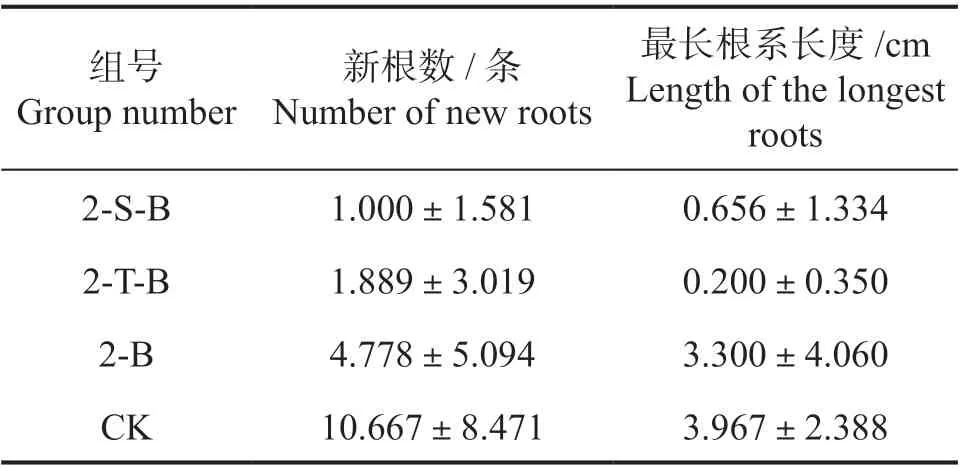
表6 水培48 d 后不同栽培基质对水培兰屿肉桂根系生长的影响Table 6 Root growth of C. kotoense seedlings with cultivating matrices after water planting 48 days
2.2.2 茎干和叶 总体而言,使用陶粒作为栽培基质比石块和彩陶更有利于水培兰屿肉桂幼苗茎干叶生长。如表7 所示,处理组均使用配方2 的700 倍浓度处理并使用不同的栽培基质,可以看到相比于0 d,48 d 时2-S-B 和2-T-B 处理组株高增幅都要大于CK,但低于2-B 的增幅。相比于石块和彩陶,使用陶粒作为栽培基质更有利于水培兰屿肉桂株高伸长。使用彩陶作为栽培基质的2-T-B成熟叶片在水培48 d 时略少于其他2 个处理组。2-S-B 和2-T-B 处理组新芽数都要低于CK 和2-B。
表7 水培48 d 后不同栽培基质对水培兰屿肉桂茎干叶生长的变化Table 7 Stem and leaves growth of C. kotoense seedlings with cultivating matrices at the beginning and after 48 days of water planting
2.2.3 生物量 使用陶粒作为栽培基质对水培兰屿肉桂幼苗积累干物质更有利,利于幼苗生长,效果要优于使用石块和彩陶。如表8 所示,鲜质量和干质量中2-T-B 和2-S-B 的质量均不如2-B,但2-S-B 地上部分质量和总质量要比2-T-B 的大,2-T-B 地下部分质量则比2-S-B 的要大。在石块和彩陶两种基质中,使用石块作为栽培基质对提高鲜质量和干质量的地上部分质量和总质量效果更好,使用彩陶作为栽培基质对提高鲜质量和干质量的地下部分质量效果更好。
表8 水培48 d 后不同栽培基质对水培兰屿肉桂生物量的影响Table 8 Biomass of C. kotoense seedlings with cultivating matrices after 48 days of water planting
2.2.4 营养液pH 和电导率 不同栽培基质处理下营养液pH 随着时间推移处于不断波动的状态,没有明显规律性。如图4 所示,2-S-B 在16 d 时pH达到峰值,2-T-B 的峰值在36 d 时,2-B 峰值在24 d 时且总体变化波动较剧烈。
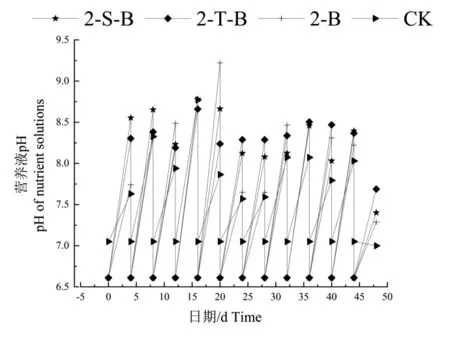
图4 水培48 d 后不同栽培基质处理下营养液pH 的变化Fig.4 pH of nutrient solutions with cultivating matrices after 48 days of water planting
不同栽培基质的处理组均在32~36 d 时电导率有比较明显下降,其余时间段变化没有明显规律性。如图5 所示,2-S-B 在0-16d 总体变化趋较为平稳,后期有缓慢下降后再有所上升,而2-T-B 则先下降后小幅度上升最后再缓慢下降。
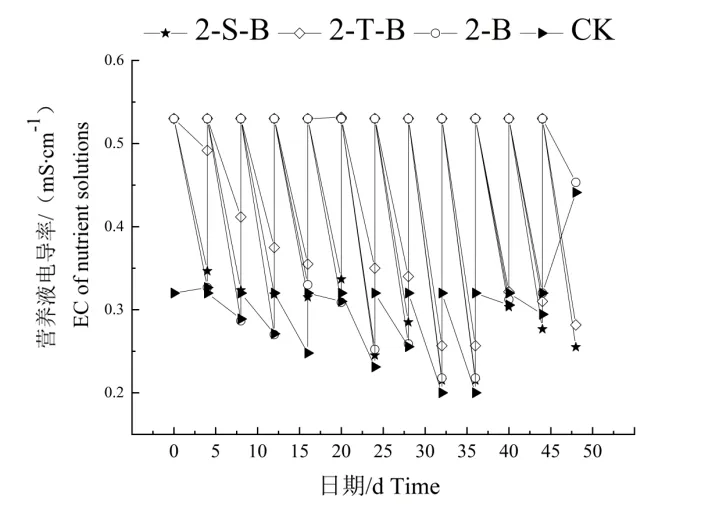
图5 水培48 d 后不同栽培基质处理下营养液电导率的变化Fig.5 EC of nutrient solutions with cultivating matrices after 48 days of water planting
3 结论与讨论
水培法在促进树种繁殖和栽培方面已有一定研究和应用[7-9],本文应用不同的营养液配方及营养液浓度,不同的栽培基质探究上述因素对兰屿肉桂幼苗水培生长的影响。其中,配方2 稀释500倍处理下水培兰屿肉桂幼苗根系生长效果最好,配方2 稀释700 倍处理下茎干叶生长效果总体最佳、生长量最佳,配方2 稀释900 倍处理下新芽萌发数目最多。总体而言使用配方2 进行水培表现更好。各组营养液pH 和电导率规律性不明显。使用陶粒对促进水培兰屿肉桂生长明显优于石块和彩陶。
综合实验结果来看,相对于对照组,2 个配方稀释倍数500 倍和900 倍均能有效促进根系生长。配方1 营养液稀释900 倍时水培肉桂幼苗根系生长最佳,配方2 营养液稀释500 倍时根系生长效果最好。水培应用配方1 对促进植株增高更有效。各组的成熟叶片数在48 d 后相较于0 d 均有减少,这可能是水培过程中兰屿肉桂幼苗为适应水培环境需要从外界获取能量,但根系生长跟不上获取能量的速度,因而消耗老叶能量维持生长。配方2 处理更有利于兰屿肉桂幼苗生长量的积累。营养液pH 和电导率在实验过程中波动较大,各处理组表现均有所不同,营养液pH 在实验后期变化趋于平缓。营养液电导率反应植株通过根系吸收养分和水分时与营养液发生离子交换程度,一定程度上代表营养液的营养水平。张二震等[10]的研究表明营养液电导率过低严重影响了苦苣Sonchussp.植株生长从而影响其产量,部分较高浓度的处理组植株生长仍比较健壮。另有研究表明,大量植物生长所需的元素离子在偏酸性条件更容易被吸收,如含羞草Mimosa pudica在弱酸性的条件下生长状况最好[11]。本实验中水培兰屿肉桂各处理组电导率随时间变化差异不大,大多在实验32~36 d 时达到电导率的最小值。可能由于营养液pH 在此时间段减小,促进植物吸收营养液中部分离子,导致电导率减小。另外植物在新陈代谢中可能也会产生有机酸,对营养液pH 值和电导率产生影响,需要进一步探讨。
比较不同栽培基质时,使用陶粒对促进水培兰屿肉桂生长明显优于石块和彩陶,可能因为陶粒表面有一些孔隙,堆叠后也有很多缝隙,加上质量相较于石块和彩陶轻,有利于水培肉桂根系生长和吸收营养液中的营养物质。相比之下,石块和彩陶质量较大,放置在定植篮堆叠后较为致密,没有足够的空间供兰屿肉桂幼苗生根和根系延伸。不同栽培基质栽培下的肉桂幼苗营养液pH波动较大且没有明显的规律性,而电导率的变化则总体呈现先下降后上升的趋势。
另外,本实验过程中也发现了水培基质和容器中容易滋生大量杂藻,即使定期添加杀藻剂和清洗水培容器仍会有杂藻生长。杂藻的存在可能会使植物代谢废物增多,堆积在营养液中并具有生理毒性,并可能诱发病菌大量繁衍,影响水培兰屿肉桂的生长。而且这些有害物质也可能会影响pH 和电导率测定时的准确性。因此日后若投入实际生产,应要不断改进配方和水培工艺,减少杂藻产生和有害物质积累对水培兰屿肉桂的生长影响。
