CAR-T细胞治疗实体瘤的挑战与应对策略
2022-02-02党可纯王金伟
党可纯,王金伟
江苏省药品监督管理局审核查验中心,南京210019
嵌合抗原受体T 细胞(chimeric antigen receptor T-cell,CAR-T)作为肿瘤免疫治疗的新疗法,能克服宿主免疫耐受状态,以主要组织相容性复合物(main histocompatibility complex,MHC)限制性方式识别并靶向杀伤肿瘤细胞,具有靶向性强、杀瘤范围广以及效果持久等优点,已成功应用于多种血液肿瘤的临床治疗[1,2]。截止2022 年8月,美国食品药品管理局(Food and Drug Administration,FDA)已经批准了6款CAR-T 产品上市,国家药品监督管理局(National Medical Products Administration,NMPA)也于2021年先后批准了两款CAR-T 产品上市,预示CAR-T治疗时代的到来。虽然CAR-T 细胞治疗针对血液肿瘤疗效明显,然而其在实体肿瘤上的应用仍面临着诸多挑战。2019 年一项纳入42 项血液瘤及18 项实体瘤临床试验的META 综合分析(913 位受试者)结果表明,54.4%的血液瘤患者接受CD19 CAR-T 治疗后症状完全缓解,而实体瘤患者的完全缓解率仅为4.1%[3]。鉴于实体瘤治疗需求亟待满足,现对CAR-T 治疗实体瘤面临的挑战及其可行的解决策略进行总结与探讨,以期为后续CAR-T 细胞治疗实体肿瘤研究提供思路。
1 CAR-T 治疗实体瘤面临多重挑战
1.1 缺乏肿瘤特异性靶抗原
CAR-T 细胞上的嵌合抗原受体(CAR)由识别肿瘤相关抗原(tumor associated antigen,TAA)的胞外抗原结合区、跨膜区、铰链区和胞内信号转导区组成。而CAR-T 细胞疗法的有效性主要依赖于对TAA 的识别。不同于血液肿瘤常见的CD19、CD22、BCMA 等靶点,在实体瘤中很难发现特异性的TAA,大多数TAA 不仅在癌细胞表面高度表达,也在正常细胞上表达,因而大部分CAR-T 细胞治疗均面临攻击正常细胞的“脱靶效应”(on-target,offtumor)困境[4]。例如,HER2 靶点在乳腺癌细胞表面过表达,但在正常心肺组织中也有少量表达,曾有一名结肠癌患者接受较高剂量的HER2 CAR-T 细胞治疗,仅在输注后15 分钟内该患者便出现了急性呼吸窘迫,并于治疗后5 天死亡[5]。
1.2 T 细胞的转运及肿瘤浸润障碍
消除实体瘤的关键是将CAR-T 细胞转运至肿瘤细胞表面,以便与靶抗原结合并发挥杀伤作用。CAR-T 细胞虽然易与血液及淋巴系统中分散循环的血液肿瘤细胞接触,然而其转运至实体瘤病灶仍然具有重重障碍。一方面,以肿瘤相关成纤维细胞(cancer associated fibroblasts,CAFs)为主要组成部分的细胞外基质(extracellular matrix,ECM)和结构不规则的肿瘤血管,对CAR-T 细胞形成一层天然的物理屏障,使其难以有效归巢和浸润到肿瘤[6]。另一方面,实体瘤的基质细胞、肿瘤细胞和肿瘤相关免疫细胞会分泌一种特殊的细胞因子——趋化因子,可与其对应的趋化因子受体结合,将免疫细胞招募到肿瘤微环境(tumor microenvironment,TME)中,从而促进或抑制肿瘤生长。CAR-T 细胞表面缺乏与实体瘤分泌的趋化因子相匹配的趋化因子受体,造成CAR-T 对肿瘤部位的归巢能力差[7]。上述两方面因素共同作用使得CAR-T 细胞很难精准到达实体瘤部位发挥免疫效应。
1.3 肿瘤微环境的免疫抑制
然而即使有一部分CAR-T 细胞可成功浸润到实体瘤内部,其功效也会因TME 的免疫抑制作用而大幅降低。首先,TME 中存在着前列腺素E2(prostaglandin E2,PGE2)、转化生长因子β(transforming growth factor-β,TGF-β)、白细胞介素6(IL-6)和IL-10 等可溶性抑制因子,其可抑制肿瘤细胞凋亡,并抑制进入肿瘤内部的CAR-T 细胞活性。同时,TME 中的抑制性免疫细胞、即髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)、调节性T 细胞(regulatory cells,Tregs)等,亦可通过生成精氨酸酶-1(arginase-1,Arg-1)、活性氧(reactive oxygen species,ROS)等分子,形成免疫抑制性微环境。此外,肿瘤细胞还能够通过上调表面抑制受体,如程序性死亡配体-1(programmed death-ligand 1,PD-L1)等,利用内在的负调控机制来降低CAR-T细胞活性,导致TME 中的免疫耐受。最后,肿瘤细胞糖酵解使肿瘤微环境呈现缺氧、酸性和营养缺乏的状态,使得CAR-T 细胞更加难以存活[8,9]。
2 CAR-T 攻克实体瘤的可行策略
2.1 提高肿瘤细胞特异性
2.1.1 靶抗原选择 靶抗原的选择是CAR-T 治疗肿瘤成功的基础,此类抗原需在肿瘤细胞中高表达,而在正常细胞表面不表达或极低表达。目前临床在研CAR-T 项目较理想的实体瘤靶抗原主要集中在Claudin18.2、间皮素(mesothelin,MSLN)、磷脂酰肌醇蛋白聚糖3(glypican 3,GPC3)等热门靶点。
(1)Claudin18.2(CLDN18.2)
CLDN18.2 是膜上皮紧密连接蛋白Claudin18(CLDN18)的剪接变体,正常情况下仅低表达于胃黏膜分化上皮细胞,而在胃肠道、胰腺癌、卵巢癌等多种肿瘤细胞表面表达显著上调,故此可作为CAR-T 治疗的理想靶点。2022 年5月,我国首个针对CLDN18.2 的CAR-T 细胞产品(科济生物的CT041)的临床研究结果发表[10],研究纳入了37 例CLDN18.2 阳性的晚期消化道肿瘤患者,在消化道肿瘤患者中的客观缓解率(objective response rate,ORR)达48.6%,疾病控制率(disease control rate,DCR)达73%;在胃癌患者中的ORR 达57.1%,DCR达75.0%;在既往接受二线以上治疗失败的胃癌患者中,ORR 达61.1%,DCR 达83.3%。CT041 整体耐受性良好且安全性风险可控,未发生≥3 级细胞因子释放综合征(cytokine release syndrome,CRS),未发生免疫效应细胞相关神经毒性综合征(immune effector cell -associated neurotoxicity syndrome,ICANS),无治疗相关死亡事件。
(2)间皮素(MSLN)
MSLN 是由MSLN 基因编码的一种细胞表面糖蛋白,在恶性间皮瘤、胰腺癌、卵巢癌和肺癌等肿瘤中广泛表达,而在正常的胸膜、腹膜以及心包膜表面低表达,因此MSLN 也被认为是CAR-T 细胞治疗实体瘤的一个潜力靶点。2021 年11月,来自纪念斯隆-凯特琳癌症中心(Memorial Sloan Kettering Cancer Center,MSKCC)公布了一项靶向MSLN 的CAR-T 治疗恶性胸膜间皮瘤的临床疗效数据[11],临床效果同样显著,在23 例接受CAR-T治疗的患者中位生存期达17.7 个月,一年存活率为74%。未观察到2 级以上CRS 或ICANS,未出现“脱靶效应事件”。
(3)磷脂酰肌醇蛋白聚糖3(GPC3)
GPC3 在绝大多数肝癌细胞表面异常表达,与肝癌的发生、发展密切相关,而在正常肝组织内几乎不表达,是肝癌CAR-T 治疗的理想靶点。此外,GPC3还在卵巢透明细胞癌、卵黄囊癌等生殖系统肿瘤中广泛表达。2021 年在美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)年会上,我国研究者首次公布了GPC3 CAR-T 细胞药物(Ori-CAR-001)治疗复发/难治性肝细胞癌的最新临床研究数据,在9 例可评估的受试者中,ORR 达44%,DCR 达78%。同时在已回输的11 例患者中,Ori-CAR-001显示出良好的安全性和耐受性,9 例患者观察到了CRS,其中仅有2 例出现4 级CRS,给予类固醇激素和托珠单抗治疗后恢复正常;未观察到ICANS。
此外,以人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、前列腺特异性膜抗原(prostate-specific membrane antigen,PSMA)、双唾液酸神经节苷脂(disialoganglioside 2,GD2)、CD133、癌胚抗原(carcinoembryonic antigen,CEA)等为靶点的CAR-T 治疗实体瘤的临床试验也在火热进行中,期待满足更大的实体瘤临床治疗需求,见表1。

表1 CAR-T治疗实体瘤临床试验概况
2.1.2 针对实体瘤的特异性CAR 分子改造 除了继续寻找和开发针对特异性靶抗原的CAR-T 细胞疗法,还可以通过改造CAR-T 细胞,提高对肿瘤抗原的特异性识别能力,减少对正常组织的杀伤。有研究者开发出一种串联CAR 分子,其胞外结合区由两个靶向不同TAA 的单链抗体片段(single chain antibody fragment,scFv)组成,并与CD3ζ 链和CD28或4-1BB 共刺激信号域连接。改造后的串联CART 细胞仅在同时识别两种不同TAA 时才能被激活,增加了CAR-T 的特异性和安全性。类似的CAR 设计也能达到相同目的,一个CAR 结构包含两个scFv,一个与胞内CD3ζ 链连接,提供第一信号,另一个与共刺激信号域连接,提供第二信号。只有两种抗原同时在靶细胞上表达且被识别,才能激活两个信号,从而活化CAR-T 细胞,并诱导抗肿瘤效应(见图1)[8]。
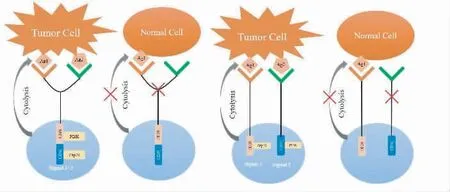
图1 串联CAR-T 细胞设计[8]
此外,美国加州大学团队还将之前开发的“prime-and-kill”回路中的synNotch 受体(一种在识别同源抗原时可激活转录输出的工程化受体)应用到CAR-T 细胞中[23],SynNotch-CAR T 细胞需要同时识别启动抗原(synNotch 抗原)和杀伤性抗原(CAR 抗原),而且只有先被synNotch 配体启动时才能执行CAR 诱导杀伤,因此健康细胞不会受到这些CAR-T 细胞的攻击,从而减少了“脱靶效应”的发生。
最近也有研究者发现,通过改造CAR 的scFv结构域,调节scFv 对抗原的敏感性,可使CAR-T 能有效区分肿瘤及正常组织,从而减少脱靶风险,获得更好的治疗效果[24]。除此之外,埃秀马生物科技有限公司另辟蹊径,利用BIOATLA 公司的条件性激活生物制剂(conditionally active biologic,CAB)抗体筛选平台[25],基于scFv 对靶抗原亲和力会根据环境pH 发生可逆改变的原理,筛选仅在酸性肿瘤微环境(pH 6.7)中与靶抗原有高亲和力,而在正常组织(pH 7.4)中不与靶抗原结合的抗体序列,从而在保证肿瘤杀伤效果的同时,避免脱靶效应的风险。该公司针对肾细胞癌开发的前沿CAR-T 产品在治疗剂量1×107细胞/kg 也显示了良好的安全性。
2.2 解除免疫抑制
2.2.1 阻断免疫检查点通路 肿瘤细胞上过度表达的PD-L1 可特异性识别并结合T 细胞上的程序性死亡蛋白-1(programmed death-1,PD-1),导致T细胞失去杀伤能力,如同启动“刹车”系统,严重影响CAR-T 细胞的疗效[26]。因此,在CAR-T 细胞治疗实体瘤时,同时给予免疫检查点通路抑制剂,阻断“刹车”系统的启动,可增强CAR-T 细胞的抗肿瘤活性。贝勒医学院研究团队在神经母细胞瘤的临床试验中发现,相比于单独使用CAR-T 细胞药物或仅与化药联用,靶向GD2 的CAR-T 细胞药物与化疗药物及抗PD-1 药物三者联用表现出更好的T 细胞持久性及抗肿瘤功效[27]。一项靶向MSLN 的CAR-T 细胞疗法联合PD-1 拮抗剂帕博利珠单抗治疗恶性胸膜间皮瘤的临床研究也证实,接受联合治疗的患者相较于单独CAR-T 细胞治疗的患者中位生存期延长了6.2 个月,一年存活期也由74%提高至83%[11]。除了与免疫检查点PD-1 阻断剂联用,亦可将PD-1 抗体的基因引入CAR-T 细胞,不仅能够阻止PD-1 与PD-L1 结合,亦能助力PD-1 抗体在局部形成高浓度环境解除免疫抑制,改善TME,从而更好地调动免疫细胞。近期,钱其军团队首次采用自分泌PD-1抗体靶向MSLN 的CAR-T 细胞联合阿帕替尼治疗一名晚期难治性卵巢癌患者,效果显著,该患者接受联合治疗后病灶缩小,且无进展生存期和总生存期分别达到了5 个月和17 个月[28]。除此之外,通过CRISPR 等基因编辑手段敲除CAR-T 细胞的PD-1基因[29]或在CAR-T 细胞表面表达PD-1 显性负性受体(dominant negative receptor,DNR),以克服PDL1 对肿瘤细胞的抑制作用(PD-1 DNR 可与肿瘤细胞上的PD-L1 结合,并不会激活PD-1/PD-L1 通路),同样可以有效抑制PD-1/PD-L1 通路,提高CAR-T 细胞的细胞毒性和肿瘤清除率[30]。
2.2.2 共表达细胞因子 大量研究表明,IL-12 可有效动员免疫系统,具有明显的抗肿瘤活性。Agliardi G 等[31]通过CAR-T 细胞联合局部注射IL-12 治疗多形性胶质母细胞瘤(glioblastoma multiforme,GBM)的临床前研究表明,联合治疗比单独CAR-T 细胞治疗能产生更持久的抗肿瘤反应,IL-12 不仅增强了CAR-T 细胞的细胞毒性,而且重塑了TME,促进了促炎性CD4+T 细胞的浸润,并减少了Tregs 的数量。然而,全身性使用IL-12 会引起严重的副作用,这大大限制了其临床应用。面对这一挑战,研究人员尝试通过改造CAR-T 细胞,使其过表达IL-12,从而调节局部微环境。Liu Y 等[32]研究发现,相较于常规靶向GPC3 CAR-T 细胞,过表达IL-12 的CAR-T 细胞对GPC3 阳性肿瘤细胞具有更加显著的裂解效果,且分泌更多的细胞因子,在荷瘤小鼠中显示出更强的抗肿瘤作用,证实IL-12 增加了T 细胞的浸润和持久性。Chmielewski M 等[33]研究同样表明,CAR-T 细胞中IL-18 的表达亦可显著增强其体内外抗肿瘤活性。进一步分析发现,分泌IL-18的CAR-T 细胞抗肿瘤过程伴随着肿瘤免疫微环境的整体变化:M1 型巨噬细胞和自然杀伤(natural killers,NKs)细胞的数量增加,而Tregs、抑制性树突状细胞(dendritic cells,DCs)和M2 型巨噬细胞的数量减少。此外,CAR-T 细胞表达IL-7、IL-15、IL-21或IL-23 等细胞因子,同样也能有效改善TME 的免疫抑制,增强CAR-T 及其他免疫细胞的抗肿瘤活性,同时也可增加CAR-T 细胞在体内的持久性[34]。
2.2.3 CAR-T 联合溶瘤病毒疗法 研究表明,溶瘤病毒可通过多种途径助力CAR-T 细胞克服免疫抑制障碍,提高治疗效果[35]。除了直接的溶瘤作用外,溶瘤病毒裂解肿瘤细胞还释放TAAs、新抗原(neoantigens,TANs)以及损伤相关分子模式(damage-associated molecular patterns,DAMPs),进而招募更多的免疫细胞到达肿瘤组织,有效激活抗肿瘤免疫应答。近日,日本研究团队首次揭露CAR-T 细胞与溶瘤病毒联用可以有效阻止GBM 的生长并显著提升荷瘤小鼠的存活率[36],相比于单独CAR-T 治疗或单独溶瘤病毒治疗组,联合组小鼠的肿瘤体积缩小了50%,且存活时间延长至60 天以上。
2.3 提高对实体瘤的转运及浸润
2.3.1 共表达趋化因子 趋化因子是影响T 细胞转运和浸润的重要分子,近年来针对趋化因子的研究给CAR-T 攻克实体瘤带来了新希望。日本研究团队通过使CAR-T 细胞共表达IL-7 及趋化因子CCL19,制备出对实体瘤具有显著杀伤效果的“超级CAR-T 细胞”[37]。在小鼠肥大细胞癌模型中,相较于常规CAR-T 细胞疗法只能略微改善荷瘤小鼠的生存时间,该“超级CAR-T 细胞”可以使小鼠的肿瘤完全消除,生存率达到100%。同时对于那些常规CAR-T 细胞疗法几乎无效的肺腺癌和胰腺癌,小鼠模型实验也证实“超级CAR-T 细胞”同样实现了肿瘤组织的完全消除。肿瘤组织切片荧光染色结果表明,经过“超级CAR-T 细胞”治疗后,肿瘤组织中的T 细胞及DCs 明显增多,证实该新型改造设计能够帮助CAR-T 细胞有效浸润到肿瘤组织内部,进而对肿瘤细胞进行杀伤。我国研究团队也在近期将该CAR-T 改造设计应用于实体瘤的治疗[38],在针对GPC3 和MSLN 靶点的CAR-T 细胞上共表达IL-7和CCL19,用于GPC3 或MSLN 阳性的晚期肝细胞癌、胰腺癌和卵巢癌的治疗,其中1 例晚期肝癌接受了瘤内注射CAR-T 治疗后,肝脏病灶基本消失。近日,广州百暨基因首次将趋化因子受体CXCR5 加装到靶向EGFR 的CAR-T 细胞表面,用于治疗非小细胞肺癌。体内CAR-T 细胞示踪实验结果显示,共表达CXCR5 使得CAR-T 细胞可以定向转运和浸润至肿瘤病灶处,对于肿瘤具有显著的清除效果[39]。此外,上海复旦大学研究团队也揭露在CAR-T 细胞上表达CCR2b、CCR4 等趋化因子受体基因,亦可增强CAR-T 细胞向实体肿瘤组织转移和浸润[40]。
2.3.2 靶向肿瘤细胞外基质 CAF 是ECM 的主要组成部分,在掩蔽肿瘤细胞免受免疫攻击和将T 细胞排除于肿瘤微环境中具有重要作用。一些研究团队通过靶向CAF 上高度表达的成纤维细胞活化蛋白(fibroblast activation protein,FAP),以此重塑ECM 来调节TME,从而增强CAR-T 细胞对实体瘤的浸润效果[41]。乙酰肝素酶亦可降解ECM 成分硫酸乙酰肝素蛋白多糖。Caruana I 等[42]报道,表达乙酰肝素酶的工程化CAR-T 细胞获得了更好的降解ECM的能力,从而促进了肿瘤T 细胞浸润和抗肿瘤活性。
2.4 提高CAR-T 细胞在体内的持久性
即使对于疗效显著的血液瘤,肿瘤的高复发率仍是限制CAR-T 细胞治疗发展的主要障碍,提高CAR-T 细胞在体内的持久性是其治疗实体瘤的另一关键策略。BioNTech 公司开发设计了一款BNT211 产品,由靶向CLDN6 抗原的自体CAR-T 细胞和一种编码CLDN6 抗原的mRNA 疫苗(CARVac)组成。CARVac 经静脉注射后会被DCs 吸收并翻译成抗原肽,继而呈递在DCs 表面以持续激活CAR-T细胞,大大提高CAR-T 细胞在体内的存活和扩增效率。小鼠体内实验证实,CARVac 策略确实展现出更好的肿瘤杀伤效果并显著延长体内存活时间,通过CARVac 的反复刺激可以在低剂量输注CAR-T 的情况下优化治疗窗口,使得小鼠肿瘤从延缓生长改善为完全消退[43]。今年美国癌症研究协会(American Association for Cancer Research,AACR)年会披露了BNT211 的Ⅰ/Ⅱ期临床试验(NCT04503278)的最新进展,初步研究结果表明,靶向CLDN6 CAR-T细胞和CARVac 的联合使用可以显著增加肿瘤病人的ORR 以及DCR,5 例可评估患者中有4 例部分缓解,且这种新型治疗仍具有良好的耐受性和安全性。此外,CAR-T 细胞在患者体内缺乏持久性与输注T 细胞的耗竭直接相关,研究发现,scFv 的框架区之间易发生相互聚集,而引起CAR 分子胞内CD3ζ 区域的磷酸化,产生基础状态下的低水平、组成性信号活化(tonic signaling)现象,最终导致T 细胞耗竭[44]。一方面,单域抗体仅为单个抗原结合结构域,可以有效避免上述因scFv 聚集引起的T 细胞耗竭问题,可能是解决CAR-T 治疗复发难题的可行思路[45]。另一方面,共刺激信号域亦是CAR-T 细胞的重要组成部分,大量临床研究实例证实,整合CD28 共刺激分子的CAR-T 细胞能够快速杀伤肿瘤,但持续性较差,而包含4-1BB 共刺激分子的CAR-T 细胞具有更强的持续性[46]。最新一项研究表明,采用两个信号结构域(CD28 和CD3ζ)和4-1BB配体的设计,可兼具两种共刺激分子的优势,呈现平衡的肿瘤杀伤能力和增强的T 细胞持久性[47],无疑为CAR-T 细胞攻克实体瘤提供了更多思路。
3 总结与展望
CAR-T 细胞疗法在治疗实体瘤的临床应用中机遇与挑战并存。随着临床需求的持续增长,既需要借鉴CAR-T 细胞疗法在血液瘤中的成功经验,又要从实体瘤的独特性出发,通过多学科合作创新,持续推动临床研究发展,推动CAR-T 细胞疗法突破目前在实体瘤治疗领域存在的阻碍,为实体瘤治疗带来变革性的影响,使更多实体瘤患者收益。