6-磷酸-海藻糖对普通菜豆籽粒产量和镰孢菌枯萎病抗性的影响
2022-02-02薛仁风黄宇宁葛维德
薛仁风,黄宇宁,姜 珊,赵 阳,陈 剑,葛维德
(1. 辽宁省农业科学院 作物研究所,辽宁 沈阳 110161;2. 中共辽宁省委党校(辽宁行政学院/辽宁省社会主义学院),辽宁 沈阳 110004)
普通菜豆(Phaseolus vulgarisL.)是世界上种植面积最大的食用豆类,产量约占全球食用豆类总产量的50%,特别是在非洲和美洲的部分地区更是作为一种重要的食物来源被广泛种植[1-3]。产量和抗病性是普通菜豆育种中最受育种家关注的2 个要素,其中籽粒产量性状是影响普通菜豆生产潜力的重要因素。尖镰孢菌菜豆专化型(Fusarium oxysporumf. sp.phaseoli,Fop)引起的普通菜豆镰孢菌枯萎病(Fusariumwilt)也是造成普通菜豆严重减产的重要原因[4]。因此,探索协同调控普通菜豆产量和枯萎病抗性方法与机制对于菜豆高产高抗品种的选育与种质创新具有重要的研究价值。
糖分子是调控植物生长发育、产量、籽粒性状和抗性的重要信号分子之一。6-磷酸-海藻糖(T6P)作为维持糖稳态的核心激素,参与调控植物的生长发育与逆境响应等生理过程[5]。近年来,研究发现,植物T6P具有类似动物胰岛素的功能,可通过促进源-库转运等形式反馈调节糖水平[6]。在玉米中异源表达水稻6-磷酸-海藻糖磷酸酶基因OsTPP1可直接提升9%~49%的产量[7]。直接喷施可吸收的T6P 前体亦可使小麦增产20%[8]。2022年,张健研究员团队与胡培松院士团队合作首次揭示了T6P 调控水稻碳源分配与籽粒产量的机制,研究结果表明,T6P具有极大地改良作物产量的潜力,为作物高产遗传改良提供了新思路[9]。在糖分子调控植物抗病性研究方面,前人研究结果表明,喷施外源海藻糖(Tre)能够引起植物T6P 含量积累[10],植物体内积累的Tre 很大程度是由T6P 水解产生,而Tre 作为一种内源性保护剂,参与植物对生物或非生物胁迫的响应。植物病原体在侵染寄主的过程中诱导植物细胞内积累大量的Tre。芸苔疟原虫(Plasmodiophora brassicae)侵染拟南芥引起Tre 在根和下胚轴中迅速积累,芸苔疟原虫的感染导致拟南芥体内海藻糖酶基因表达显著增强,并且根和下胚轴中海藻糖酶活性也明显升高[11]。直接喷施Tre 即可诱导小麦几丁质酶、病程相关蛋白、草酸氧化酶活性的增加,经过Tre 预处理的小麦白粉病的发病比例明显低于对照,这证明施用外源Tre 可以诱导小麦对白粉病原菌(Blumeria graminis)的抗性[12]。此外,Tre 预处理能增强烟草对普通花叶病的抗性,诱导烟草叶片中过氧化氢和脯氨酸含量、防御酶活性与抗病基因表达水平显著提升[13]。虽然目前已有大量研究证明,Tre 及其衍生物参与植物对生物逆境的响应,但有关T6P 是否能够协同影响作物生长和抗病性的研究还较为缺乏。
Tre 及其衍生物广泛参与植物生长发育与逆境响应等生理过程。T6P既是调控植物籽粒产量的糖代谢信号分子,同时也是合成调控植物产量和抗病性的重要信号分子Tre 的重要前体。目前,普通菜豆产量和枯萎病抗性协同调控的机制研究在世界范围内尚属空白,同时也是普通菜豆研究领域中亟待解决的重要科学难题。鉴于此,通过外源施用T6P 的方法,探索海藻糖代谢途径对普通菜豆籽粒产量特性、可溶性糖含量、光合生理指标及镰孢菌枯萎病抗性的影响,为阐明如何利用海藻糖代谢途径关键因子改良作物的产量和抗病性等核心科学问题提供理论基础。
1 材料和方法
1.1 试验材料
普通菜豆品种龙饭豆1 号(编号:F0003346)和红芸豆(编号:F0002514)由中国农业科学院作物科学研究所提供,均属感病基因型。将2 个基因型的菜豆种子播种于辽宁省农业科学院试验田,每个小区10 m2作为一个重复,每个处理各3 个重复,用于调查菜豆籽粒产量相关性状;将红芸豆种子播种于灭菌的营养土中,23~28 ℃条件下,每日补充12 h光照,用于枯萎病抗性研究。供试病原菌株为尖镰孢菌菜豆专化型FOP-DM01 菌株,保存于辽宁省农业科学院作物研究所。
1.2 激素处理与病原菌接种
激素处理参照GRIFFITHS 等[14]的方法。普通菜豆幼苗采用喷雾法处理,以蒸馏水作为溶剂,配制1 mmol/L 6-磷酸-海藻糖溶液(T6P),喷施蒸馏水作为对照。在菜豆开花后每隔5 d 喷洒整株植物1次,至植株进入成熟期为止;准备7 日龄的菜豆幼苗,每日喷1 次1 mmol/L T6P,连续处理7 d,用于接种病原菌,接种方法参照XUE 等[15]的方法。发病级别调查参考普通菜豆枯萎病1~9 级的病情分级标准[16]。
1.3 糖含量测定
在普通菜豆成熟期采集植株叶片,每个处理取3 次生物学重复;将采集样品置于-20 ℃条件下保存,用于糖类物质含量的检测。海藻糖含量测定参考LI 等[9]的方法;葡萄糖、果糖、蔗糖和淀粉含量的测定参考XUE等[17]的方法。
1.4 光合生理指标测定
在普通菜豆植株进入成熟期后,检测植株叶片叶绿素总含量、净光合速率、气孔导度、胞间CO2浓度和蒸腾速率,每个处理取3次生物学重复,测定不同重复小区不同植株同一位置的10 张叶片。叶绿素总含量检测方法参考薛仁风等[18]的方法;净光合速率、气孔导度、胞间CO2浓度和蒸腾速率采用GB-1102便携式光合蒸腾仪进行测定。
1.5 植物防御反应关键因子与防御基因表达量的测定
分别在接种0、24、48 h 后的菜豆植株根部取样,每个处理取3 次生物学重复;将采集样品置于-80 ℃条件下保存,用于过氧化物酶(POD)活性、超氧化物歧化酶(SOD)活性、丙氨酸解氨酶(PAL)活性和过氧化氢(H2O2)含量等防御反应因子的检测,参考XUE等[17]的方法。
采 用SuperRealPreMix(SYBR Green,TianGen,中国)荧光定量PCR 试剂盒和qTOWER 2.2 实时定量PCR 仪(Analytikjena,德国),以各个取样时间点的cDNA 为模板分析PR1、PR2、PR5等防御基因表达情况,以普通菜豆的Actin基因作为内参,反应体系与程序参照试剂说明,检测引物序列设计如表1。每个取样时间点设3 个生物学重复,采用2-ΔΔCT法确定基因的相对表达量。
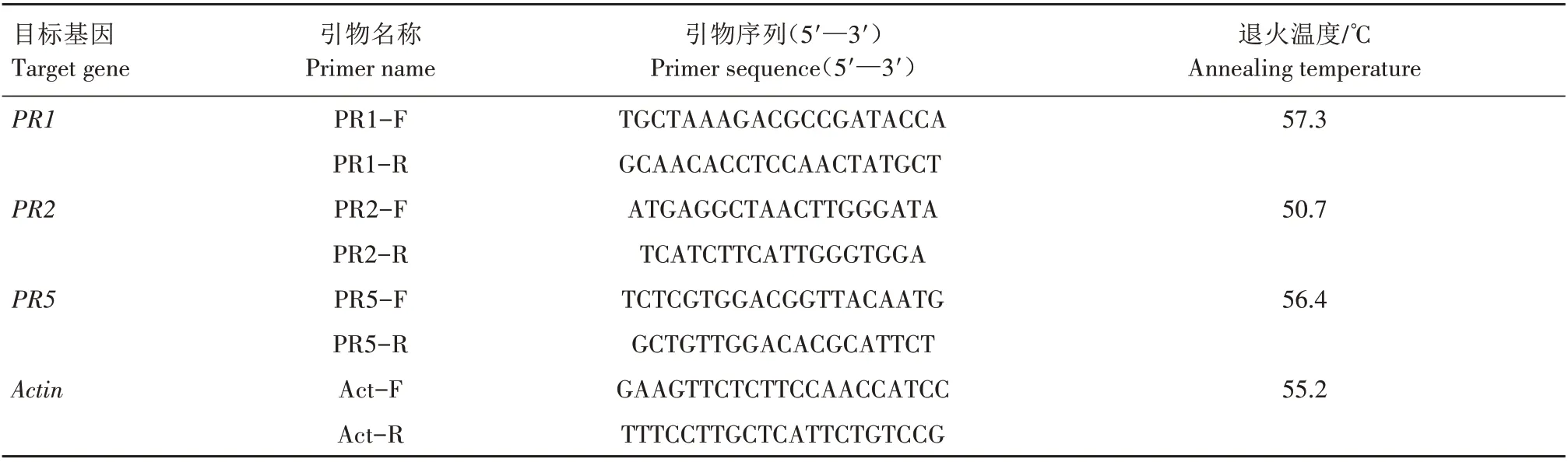
表1 引物序列设计Tab.1 Primer sequence designment
1.6 数据分析
采用SAS 统计分析软件进行方差分析,采用Excel 软件绘制图表。
2 结果与分析
2.1 外源6-磷酸-海藻糖对普通菜豆籽粒产量的影响
从表2 可以看出,在T6P 诱导条件下,龙饭豆1号的单株荚数略有升高,但相比对照不显著,而单荚粒数、百粒质量和产量均显著增加,分别达到4.5粒、42.7 g 和2 250.5 kg/hm2;而红芸豆的单株荚数、单荚粒数、百粒质量和产量均明显提高,分别达到25.1个、5.3粒、43.2 g和2 549.6 kg/hm2。表明T6P激发了普通菜豆籽粒产量潜力,提升了籽粒产量相关性状(图1)。
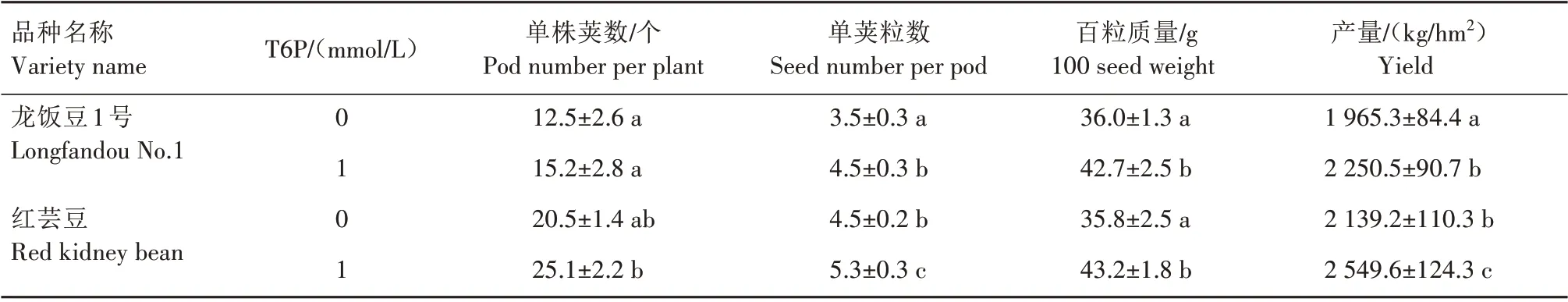
表2 外源6-磷酸-海藻糖对普通菜豆籽粒性状的影响Tab.2 The effect of 6-phosphate-trehalose on the seed characteristics of common beans
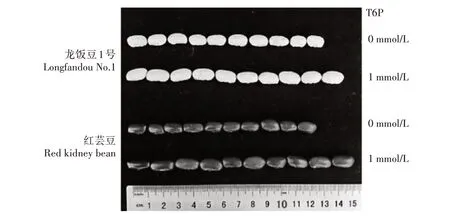
图1 外源6-磷酸-海藻糖对普通菜豆籽粒表型的影响Fig.1 The effect of exogenous 6-phosphate-trehalose on the seed phenotype of common beans
2.2 外源6-磷酸-海藻糖对普通菜豆可溶性糖含量的影响
由表3 可以看出,在T6P 诱导条件下,龙饭豆1号和红芸豆叶片中海藻糖、葡萄糖、果糖、蔗糖和淀粉含量均显著高于对照,其中,红芸豆海藻糖、葡萄糖、蔗糖和淀粉水平最高,分别达37.4 nmol/g、4.3µmol/g、5.5µmol/g、3.6µmol/g。龙饭豆1号果糖含量最高,达到8.4µmol/g。表明T6P激活了普通菜豆叶片可溶性糖分子的合成,提升了植株糖类化合物的储备。
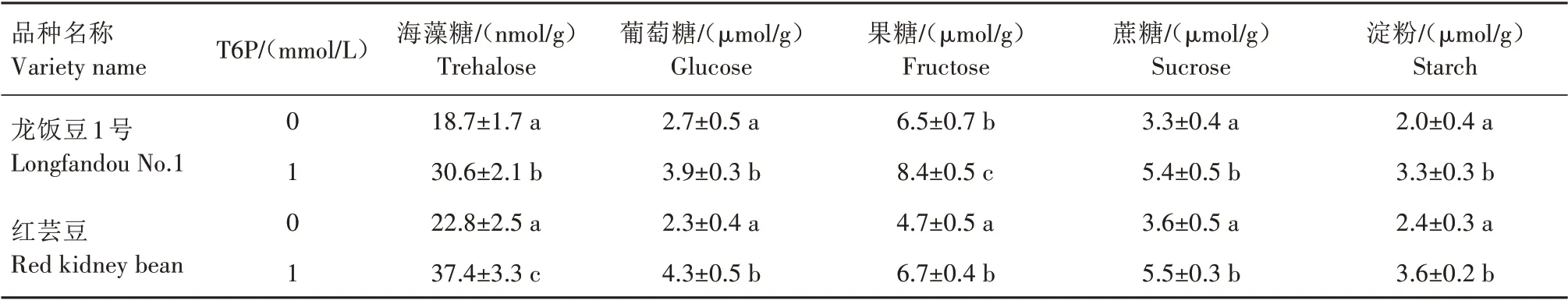
表3 外源6-磷酸-海藻糖对普通菜豆可溶性糖含量的影响Tab.3 The effect of 6-phosphate-trehalose on the soluble sugar content of common beans
2.3 外源6-磷酸-海藻糖对普通菜豆光合生理指标的影响
由表4 可以看出,在T6P 诱导条件下,龙饭豆1号和红芸豆叶片中叶绿素总含量略有升高,但变化并不明显。净光合速率、气孔导度、胞间CO2浓度和蒸腾速率均明显提升,其中龙饭豆1 号净光合速率、胞间CO2浓度和蒸腾速率最高,分别达到18.6、249.6、6.5 µmol/(m2·s)。红芸豆气孔导度最大,达0.57 µmol/(m2·s)。表明T6P 促进普通菜豆叶片光合作用,为碳水化合物合成与积累奠定基础。
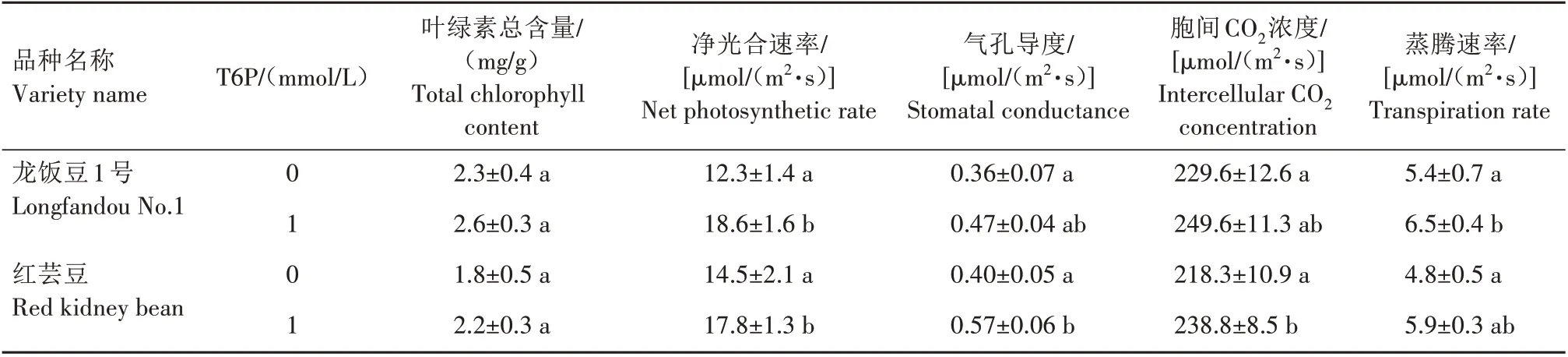
表4 外源6-磷酸-海藻糖对普通菜豆光合生理指标的影响Tab.4 The effect of 6-phosphate-trehalose on the photosynthetic physiological indicators of common beans
2.4 外源6-磷酸-海藻糖对普通菜豆抗病性的影响
接种病原菌14 d 后,1 mmol/L T6P 处理的普通菜豆红芸豆(感病材料)植株对枯萎病原菌抗性明显增强;接种病原菌28 d 后,对照植株完全枯萎、死亡,而经过T6P 溶液处理的植株发病级别显著低于对照植株,发病级别仅为4.2(图2)。
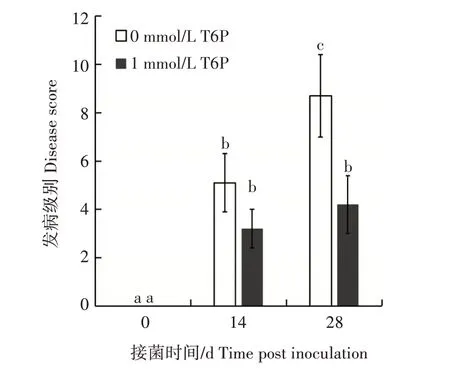
图2 外源6-磷酸-海藻糖对普通菜豆枯萎病抗性的影响Fig.2 The effect of exogenous 6-phosphate-trehalose on the resistance of common beans to Fusarium wilt
2.5 外源6-磷酸-海藻糖对植物防御反应因子的影响
接种病原菌24 h 后,T6P 诱导的红芸豆根中重要防御因子POD 活性、SOD 活性、PAL 活性和H2O2含量均显著提升(图3);接菌48 h后,菜豆根中防御因子活性或含量达到最高,POD 活性、SOD 活性和PAL 活性分别达到78.3、32.9、0.054 nk at/mg,H2O2含量达到0.33 ng/mg。植物防御因子的激活显著提升了寄主对枯萎病原菌的抗性。
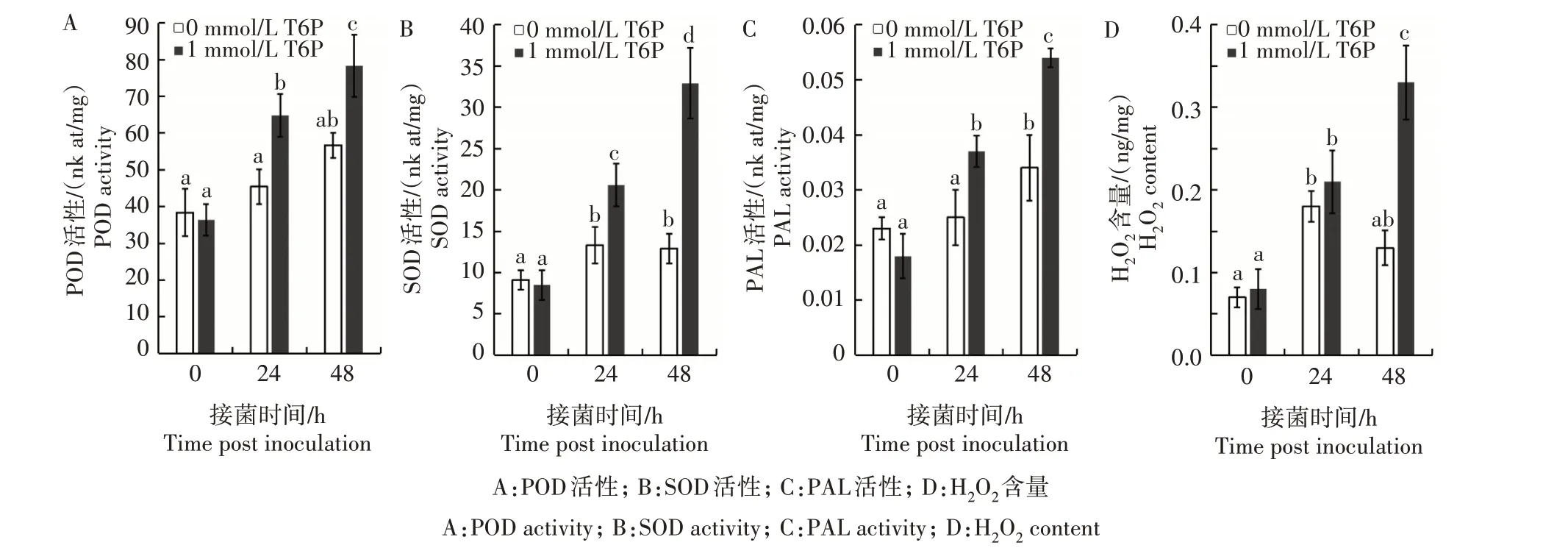
图3 外源6-磷酸-海藻糖对普通菜豆防御因子的影响Fig.3 Effects of exogenous 6-phosphate-trehalose on the defense factors of common beans
2.6 外源6-磷酸-海藻糖对植物防御基因表达量的影响
防御基因表达量检测结果表明,接种病原菌后,外源喷施T6P菜豆根中PR1、PR2、PR5基因相对表达量显著提升,接种48 h后,3个防御基因的相对表达量达到最高,分别为接种0 h 基因表达量的8.3、13.2、9.4 倍(图4)。植物防御基因表达量的升高,激活了寄主抗病性相关反应,提升了菜豆对枯萎病原菌侵染的抗性。
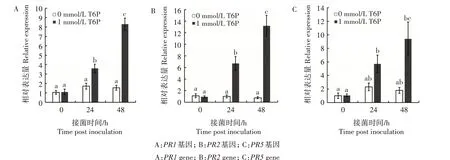
图4 外源6-磷酸-海藻糖对普通菜豆防御基因表达的影响Fig.4 The effect of exogenous 6-phosphate-trehalose on the defense gene expression of common beans
3 结论与讨论
作物病害严重影响作物生长,造成产量损失,并威胁粮食安全。抗病性强的作物品种可以有效地控制病害,然而高抗性经常以“牺牲”产量为代价[19-20]。因此,研发协同调控产量和抗病性的作物化控调节剂对于保障粮食作物安全生产具有重要意义。籽粒产量与镰孢菌枯萎病抗性协同调控的研究一直是普通菜豆研究领域的热点和难点,研究一种既能提升菜豆产量,又能增加其枯萎病抗性的方法对普通菜豆生产的提质增效具有重要作用。
前人研究表明,T6P 在植物生长发育过程中充当一种关键的调控信号,可作为碳代谢的调控器以及光合能力的增强剂[21-22]。本研究结果表明,T6P诱导普通菜豆叶片中叶绿素总含量、净光合速率、气孔导度、胞间CO2浓度和蒸腾速率提升,这说明T6P能够促进普通菜豆叶片光合作用,促进碳水化合物合成与积累,研究结果与前人研究十分相似。外源喷施T6P 前体后小麦籽粒产量明显增加,增产幅度可达20%[8]。在日本晴、南粳46 和育种材料中水01三个水稻材料中过表达糖诱导表达转录因子OsNAC23,显著提高了植株T6P 含量,相较于野生型,转 基 因 植 株 产 量 提 升 8.7%~16.1%[9]。SCHLUEPMANN 等[10,23]的研究表明,T6P 作为信号分子能与其他信号途径根据环境状况协同调节植物的生长发育。本研究结果表明,在T6P 诱导条件下,普通菜豆的单株荚数、单荚粒数、百粒质量和产量均明显提高,这些性状是影响菜豆籽粒产量的重要因素,是决定普通菜豆产量的关键指标,这说明T6P 提升了籽粒产量相关性状,激发了普通菜豆籽粒产量潜力,研究结果与前人一致。此外,菜豆叶片中糖类物质含量在T6P 诱导下也显著高于对照,这表明T6P激活了普通菜豆叶片可溶性糖分子的合成,提升了植株糖类化合物的储备,这可能也是促进菜豆籽粒产量提升的重要途径之一。
T6P 除参与调控植物生长发育过程外,还是植物响应胁迫的重要信号分子,在植物调控自身生长发育和抗性反应过程中均发挥重要作用[5]。TAYEH等[12]研究表明,外源Tre 能够诱导小麦PAL 和POD活性提高,增强小麦叶片表皮细胞中的乳突沉积,显著提升小麦对白粉病原菌的抗性。本研究表明,T6P 诱导菜豆抗病性显著增强,接菌28 d 后发病级别仅为4.2,寄主根中POD、SOD、PAL 活性和H2O2含量显著提升,防御基因PR1、PR2、PR5相对表达量也迅速升高,这表明T6P 激活了寄主对镰孢菌枯萎病的防御相关反应,提升了普通菜豆的抗病性,研究结果与前人很相似。
综上,喷施外源T6P 溶液能够显著提升普通菜豆籽粒产量的相关性状,诱导普通菜豆叶片可溶性糖类物质的合成,增加植株碳水化合物的储备,提高植株光合效率,促进合成营养物质并转运至籽粒,同时T6P 激活普通菜豆镰孢菌枯萎病抗性相关反应,提升寄主抗病性。本研究为普通菜豆籽粒产量和镰孢菌枯萎病抗性的协同调控理论研究奠定了坚实的基础,对提升我国普通菜豆产量和抗性水平有重要意义,但目前对于T6P 参与调控的相关机制还不清楚,有待进一步深入研究。
