昼夜变温下高温与干旱胁迫对Bt棉毒蛋白含量的影响及其生理机制
2022-02-02尹彦雨邢雨桐吴天凡王李妍赵子胥胡天然陈源陈媛陈德华张祥
尹彦雨,邢雨桐,吴天凡,王李妍,赵子胥,胡天然,陈源,陈媛,陈德华,张祥
昼夜变温下高温与干旱胁迫对棉毒蛋白含量的影响及其生理机制
尹彦雨,邢雨桐,吴天凡,王李妍,赵子胥,胡天然,陈源,陈媛,陈德华,张祥
扬州大学/江苏省作物遗传生理国家重点实验室培育点,江苏扬州 225009
【目的】明确棉叶片Cry1Ac毒蛋白含量对昼夜变温下高温干旱胁迫响应及其生理机制,为生产中棉抗虫性的安全稳定利用提供参考。【方法】2019—2020年在扬州大学农学院,以常规种泗抗1号(SK-1)和杂交种泗抗3号(SK-3)为材料,以温度和土壤水分含量为因子,温度分别设为34℃(白天,7:00—19:00)/28℃(夜间,19:00—7:00)(A1)、38℃/28℃(A2);土壤水分含量分别为田间土壤最大持水量的50%(B1)和60%(B2),并以32℃/28℃、田间土壤最大持水量的75%为对照(CK)。各处理分别持续4、7、10 d(DAS)。【结果】不同处理导致叶片中Cry1Ac毒蛋白含量降低,且随着胁迫时间的延长,下降幅度增加。处理间相比,A1B2处理下降幅度最少,7 DAS后开始显著低于CK;A1B1处理下降幅度其次,4 DAS后显著低于CK;A2B1、A2B2处理在4 DAS显著下降。可溶性蛋白(SP)含量、硝酸还原酶(NR)、谷氨酸丙酮酸转氨酶(GPT)、谷氨酸草酰乙酸转氨酶(GOT)、谷氨酰胺合成酶(GS)、游离氨基酸(aa)和谷氨酸合成酶(GOGAT)等活性变化趋势与毒蛋白一致,且呈极显著正相关,而基因表达量、单宁含量、蛋白酶、肽酶活性则呈上升趋势。逐步回归和通径分析筛选出NR、GPT、GS等3个关键指标可反映棉Cry1Ac毒蛋白含量高低,且三者对Cry1Ac毒蛋白含量有较大的正效应。【结论】昼夜变温下高温和干旱互作导致棉Cry1Ac毒蛋白含量降低,且随持续期延长下降幅度逐渐增大。其中34℃/28℃和田间土壤最大持水量60%胁迫7—10 d内与对照无显著差异。但与昼夜持续高温相比,昼夜变温的高温胁迫下Cry1Ac毒蛋白含量下降幅度减小和时期明显推迟。NR、GPT、GS是决定Cry1Ac毒蛋白含量高低的关键指标。
棉;Cry1Ac毒蛋白;高温;干旱;生理机制
0 引言
【研究意义】自1997年转()基因抗虫棉(棉)在中国商品化种植以来,其种植面积逐渐扩大,目前已占总植棉面积的80%以上。因其自身合成一种对棉铃虫等鳞翅目类害虫具有显著活性的Cry1Ac毒蛋白,可减少农药的使用,产生了巨大的经济和生态效益。但生产中常出现棉Cry1Ac毒蛋白含量和抗虫性下降,甚至不抗虫现象。这严重影响了它的应用效果。【前人研究进展】前人已明确逆境对棉Cry1Ac毒蛋白含量有明显影响。如夏兰芹等[1]、Chen等[2]研究表明高温可致棉Cry1Ac毒蛋白含量急剧降低。Benedict等[3]则发现6、7月份降水量较少时土壤含水量较低,土壤水分压力会降低植株中总可溶性蛋白和Cry1Ac毒蛋白的含量。Martins等[4]也发现长时间的中度水分亏缺会导致Cry1Ac毒蛋白含量下降。互作影响方面,张祥等[5]发现温度和土壤水分通过调控蛋白质分解和合成,共同影响棉Cry1Ac毒蛋白表达。逆境影响转基因作物毒蛋白含量的机制有以下几种推断,一种推断认为在逆境下,基因35S启动子甲基化失活,使得基因表达关闭,从而使得植株最终杀虫蛋白含量降低[6]。Allah等[7]则通过使用新的启动子实现杀虫蛋白在棉花整个生育期的持续表达,进一步验证了这一观点;第二种推断认为不良环境下植株体内产生某些次生代谢物质(如单宁),与毒蛋白结合导致其活性丧失[8];第三种推断认为在逆境下,蛋白质合成相关酶(硝酸还原酶、丙酮酸转氨酶、谷氨酰胺合成酶、谷氨酸合成酶)活性下降、蛋白质分解相关酶(蛋白酶、肽酶)活性增加,导致Cry1Ac毒蛋白含量下降[9]。【本研究切入点】前人研究设置的高温处理主要是昼夜恒定高温,而实际生产中,一天中温度是呈昼夜周期性(昼高夜低)变化的。【拟解决的关键问题】本研究通过人工模拟生产上可能出现的昼夜变温下高温与干旱互作逆境,探讨棉Cry1Ac毒蛋白含量对该逆境的响应及其生理机制,从而为棉抗虫性安全应用提供理论基础。
1 材料与方法
1.1 供试材料与试验设计
试验于2019—2020年在扬州大学农学院试验温室(32°24′42″ N,119° 41′29″ E)进行。2019年以生产中大面积推广应用的转基因棉常规品种泗抗1号(SK-1),2020年以SK-1和杂交品种泗抗3号(SK-3)为材料。品种由江苏省农业科学院宿迁农科所提供,具有相似遗传背景,且SK-1耐高温能力较弱,SK-3耐高温能力强[10]。采用盆栽试验,所用盆钵直径40 cm,高50 cm,每盆装20 kg过筛砂壤土(含有机质18.8 g·kg-1、水解氮134.7 mg·kg-1、速效磷22.5 mg·kg-1和速效钾81.3 mg·kg-1)。采用育苗移栽方式,两年均于4月6日播种,出苗41 d后,选择长势一致的壮苗移栽至盆钵中,每盆1株。其他生长管理措施按大田高产栽培要求进行。依据前期研究结果[10],温度设2个处理,白天(7:00—19:00)分别为34℃(A1)、38℃(A2),夜间(19:00—7:00)均为28℃;土壤水分含量设2个处理,分别为田间土壤最大持水量的50%(B1)和60%(B2),并以温度32℃(白天)/28℃(夜间)、田间土壤最大持水量的75%为对照(CK)。每个处理种植10盆,3次重复。于7月20日开始控制浇水,7月30日当土壤含水量达到预设值时开始处理,应用人工气候室控制温度(精度:±0.5℃),光照30 000 lux(采用飞利浦T5灯和美国GE农用钠灯控制光源);于每日6:00、14:00、22:00使用WET土壤三参数速测仪监测土壤水分,当发现土壤水分低于设计值时采用称重法控制土壤水分定量补水。胁迫4、7、10 d后(days after stress,DAS),取棉株相同部位果枝叶,液氮冷冻后进行相关指标测定。
1.2 测定项目
1.2.1 Cry1Ac毒蛋白含量 采用酶联免疫分析法(enzyme linked immunosorbent assay, ELISA)测定[11],药盒由中国农业大学提供。
1.2.2基因表达量(gene expression level,ELBG) 采用ZHANG等[12]方法测定,试剂盒为OmniPlant RNA Kit,由康为世纪公司提供。
1.2.3 可溶性蛋白(SP)含量 应用G-250考马斯亮蓝比色法测定[13]。
1.2.4 游离氨基酸(aa)含量 应用抗坏血酸茚三酮染色法测定[14]。
1.2.5 谷氨酸丙酮酸转氨酶(GPT)和谷氨酸草酰乙酸转氨酶(GOT)活性 鲜样经Tris-HCL缓冲液研磨离心后,用提取液测定谷氨酸丙酮酸转氨酶(GPT)、谷氨酸草酰乙酸转氨酶(GOT)活性[13]。
1.2.6 谷氨酰胺合成酶(GS)和谷氨酸合成酶(GOGAT)活性 鲜样加Tris-HCl缓冲液后,研磨离心。测定提取液中GS和GOGAT活性,方法见参考文献[15-16]。
1.2.7 硝酸还原酶(NR)活性 用李文才等[17]方法测定。
1.2.8 蛋白酶活性、肽酶活性的测定 分别运用考马斯亮蓝法、茚三酮和抗坏血酸比色法测定可溶性蛋白质含量、游离氨基酸含量,进而计算蛋白酶和肽酶活性[18]。
1.2.9 单宁含量 用杨宇晖等[19]方法测定。
1.3 数据处理与统计
运用Excel 2010、SPSS16.0等软件进行数据整理和统计分析,采用两因素随机区组和Duncan法进行方差分析和多重比较(<0.05)。利用R语言制图。
2 结果
2.1 高温与干旱胁迫对Bt棉叶片Cry1Ac毒蛋白含量影响
表1表明,昼夜变温下高温干旱胁迫导致棉叶片Cry1Ac毒蛋白含量下降。处理间相比,A1B2处理下降幅度最低,7DAS(2020年)才显著低于CK;A1B1下降幅度其次,在4DAS(2020年)才开始显著低于CK;A2B1、A2B2处理则在4DAS便显著下降。品种间相比,常规种SK-1叶片中蛋白含量下降幅度比杂交种SK-3更大。
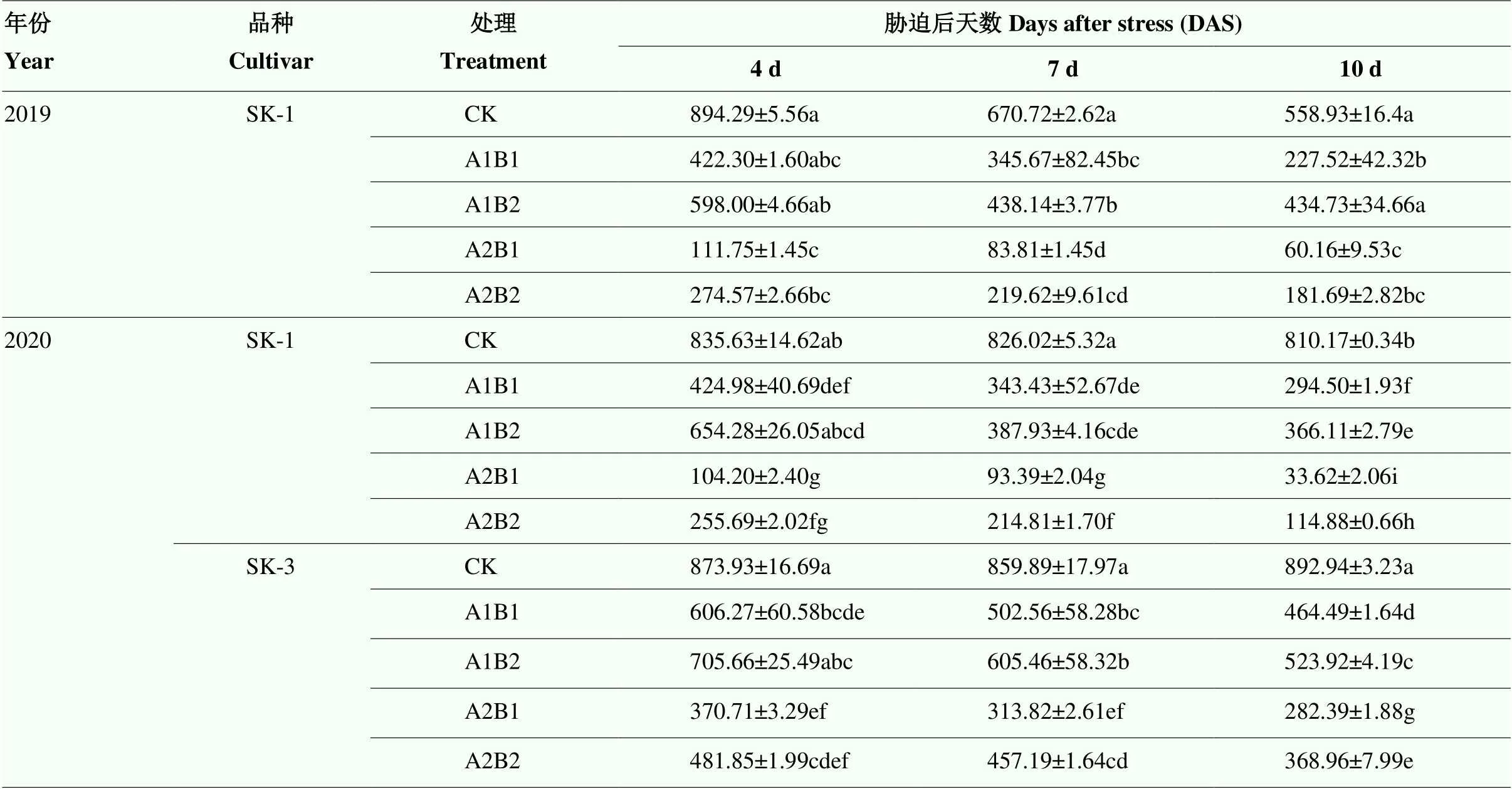
表1 昼夜变温下高温与干旱互作对叶片中Cry1Ac毒蛋白含量的影响
同列不同小写字母代表相同年份内不同处理间在<0.05水平差异显著。下同
Different letters in the same column represent significant difference at<0.05 in the same year. The same as below
2.2 昼夜变温下高温干旱影响Bt棉叶片Cry1Ac毒蛋白含量的生理机制
2.2.1基因表达量(ELBG) 随着持续胁迫期延长,ELBG呈逐渐下降趋势(图1)。处理间相比,各时期均以A1B2处理表达量最高,A1B1处理次之,A2B1、A2B2处理再次,CK最低。说明高温与干旱互作胁迫引起叶片中基因表达的上调。品种间相比(2020年)表明,胁迫后SK-3叶片中ELBG上升幅度比SK-1更大。
2.2.2 单宁含量 不同处理间单宁含量差异显著(表2)。与CK相比,昼夜变温下高温干旱处理各时期叶片中单宁含量高于CK,如胁迫10 d后,SK1和SK3的A1B1、A1B2、A2B1、A2B2处理分别比各自CK上升33.2%、22.8%、98.3%、66.6%和236.5%、53.9%、300.9%、143.5%。且随胁迫时间延长,单宁含量上升幅度逐渐增大。品种间相比,杂交种SK-3叶片中单宁含量上升幅度比常规种SK-1更大。

图中不同字母代表不同处理间在<0.05水平差异显著 Different letters in the figures represent significant difference at<0.05
图1 昼夜变温下高温与干旱互作对棉铃叶片中基因表达量的影响
Fig. 1 Effects of high temperature and drought ongene expressions in branch leaves

表2 昼夜变温下高温与干旱互作对叶片单宁含量的影响
2.2.3 氮代谢生理
2.2.3.1 可溶性蛋白(SP)和游离氨基酸(aa)含量 SP和aa含量在昼夜变温下高温与干旱胁迫下变化基本相似(表3)。随胁迫天数推移,两者含量均呈逐渐下降趋势。与CK相比,A1B2处理下降幅度最小,A1B1处理其次,A2B2、A2B1处理下降幅度最大。且随着胁迫时间的延长,SP含量和aa含量下降的幅度总体呈逐渐上升趋势。如2020年胁迫4 d、7 d、10 d后,SK-1的A1B2处理的SP含量分别比CK下降6.2%、14.9%和30.4%。品种间相比,杂交种SK-3叶片中SP含量下降幅度总体比常规种SK-1大,但aa含量下降幅度比SK-1小。
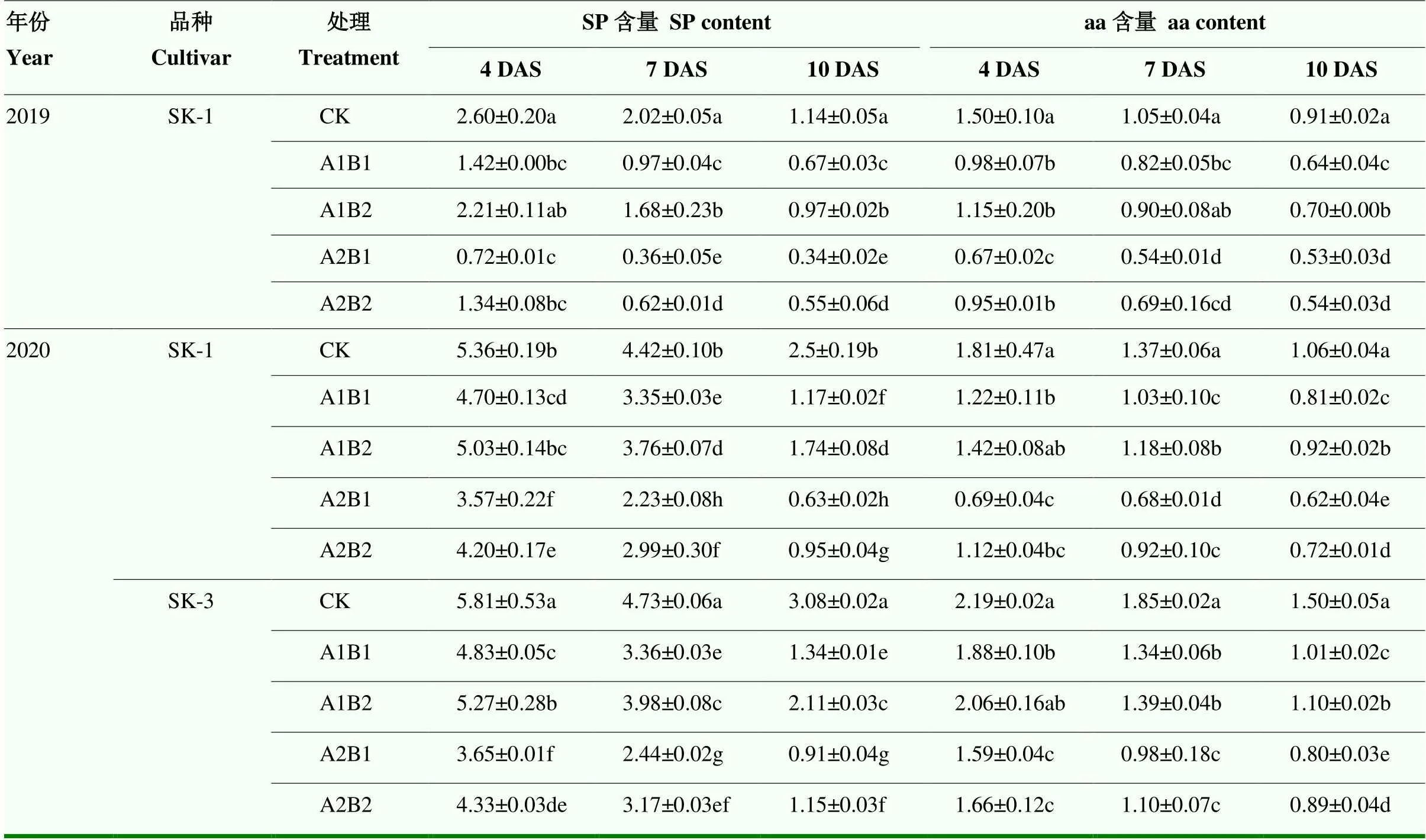
表3 昼夜变温下高温与干旱互作对叶片中SP和aa含量的影响
2.2.3.2 谷氨酸丙酮酸转氨酶(GPT)和谷氨酸草酰乙酸转氨酶(GOT)活性 昼夜变温下高温干旱胁迫对GPT和GOT活性影响基本一致(表4)。其中A1B2处理在胁迫4 d内GPT和GOT活性与CK基本无显著差异;而其他处理则在胁迫4 d后出现显著下降。但在胁迫7 d后均显著低于CK,且随着胁迫天数推移呈逐渐下降趋势。品种间相比,常规种SK-1总体下降幅度比杂交种SK-3更大。

表4 昼夜变温下高温与干旱互作对叶片中GPT和GOT活性的影响
2.2.3.3 谷氨酰胺合成酶(GS)和谷氨酸合成酶(GOGAT)活性 各处理棉铃叶片中GS活性和GOGAT活性均随着胁迫天数的推移呈逐渐下降趋势(表5)。两年间所有处理各时期棉铃叶片中GS和GOGAT活性均低于CK,但A1B2处理在胁迫4d时与CK基本无显著差异;而A2B1、A2B2处理则在胁迫4 d后出现显著下降。品种间相比,常规种SK-1叶片中GOGAT活性下降幅度比杂交种SK-3更大。
2.2.3.4 硝酸还原酶(NR)活性 表6表明,两年所有处理各时期棉铃叶片中NR活性均显著低于CK。品种间相比,常规种SK-1叶片中NR活性下降幅度总体比杂交种SK-3更大。
2.2.3.5 蛋白酶和肽酶活性 蛋白酶破坏了蛋白质的空间结构,将蛋白质水解成多肽,并不破坏肽键,而肽酶是一类肽链内切酶,负责切开肽链内部的键,将蛋白质的肽链彻底水解为氨基酸。表7表明,昼夜变温下高温与干旱导致棉叶片中蛋白酶和肽酶活性均增加。但A2B1处理增加幅度最大,A2B2处理次之,A1B1处理再次,A1B1处理最小。品种间相比,常规种SK-1叶片中蛋白酶活性上升幅度比杂交种SK-3更大。
2.3 各生理指标与叶片中Cry1Ac毒蛋白含量的关系
相关性分析表明,ELBG与Cry1Ac毒蛋白含量无显著相关性。SP、aa含量、GOT、GPT、GS、GOGAT、NR活性等与Cry1Ac毒蛋白含量呈显著或极显著正相关,而单宁含量、蛋白酶和肽酶活性则与其呈极显著负相关(图2)。以Cry1Ac毒蛋白含量()为因变量,SP(1)、aa(2)、GOT(3)、GPT(4)、GS(5)、GOGAT(6)、NR(7)和单宁含量(8)、蛋白酶(9)和肽酶活性(10)、ELBG(11)为自变量进行逐步回归分析,回归方程决定系数为2= 0.913(表8)。说明筛选出来的指标是能够反映棉Cry1Ac毒蛋白含量高低的主要因素,为进一步明确逐步回归确定的指标对Cry1Ac毒蛋白含量的效应,对筛选出的指标对Cry1Ac毒蛋白含量()进行通径分析,结果表明,筛选出NR(7)、GPT(4)、GS(5)等3个关键指标,且三者对Cry1Ac毒蛋白含量有较大的正效应,其中NR的直接正效应最大,达0.911(表9)。
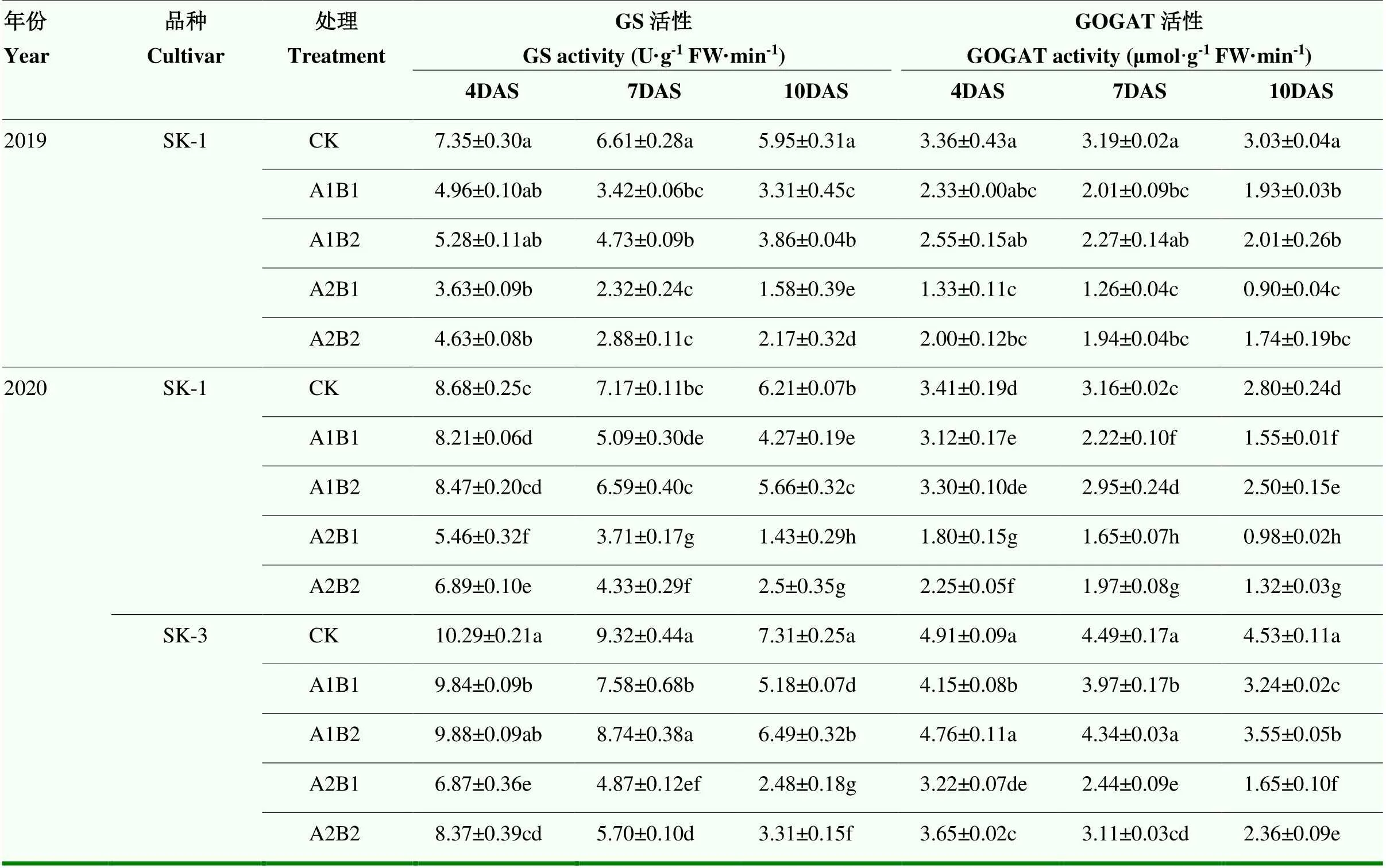
表5 昼夜变温下高温与干旱互作对叶片GS和GOGAT活性的影响

表6 昼夜变温下高温与干旱互作对叶片NR活性的影响

表7 昼夜变温下高温与干旱互作对叶片蛋白酶和肽酶活性的影响

Bt protein、ELBG、SP、aa、GPT、GOT、GS、GOGAT和NR分别代表毒蛋白、Bt基因表达量、可溶性蛋白、游离氨基酸、谷氨酸丙酮酸转氨酶、谷氨酸草酰乙酸转氨酶、谷氨酰胺合成酶、谷氨酸合成酶和硝酸还原酶

表8 逐步回归分析结果
:Cry1Ac毒蛋白含量Cry1Ac protein content;X:NR活性NR activity;X:GPT活性GPT activity;X:GS活性GS activity
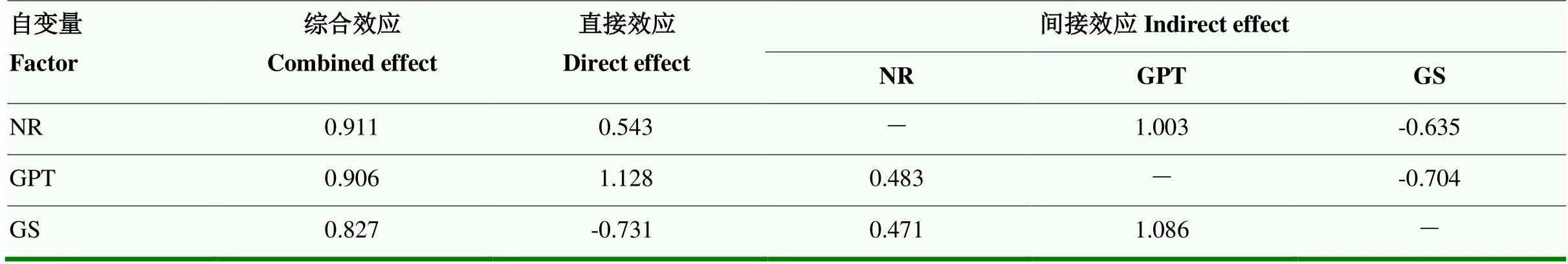
表9 关键生理指标的通径分析
3 讨论
3.1 昼夜变温下高温与干旱胁迫降低Bt棉Cry1Ac毒蛋白含量
笔者前期研究表明,昼夜恒温下高温和干旱互作逆境对棉Cry1Ac毒蛋白含量有明显的影响[5],但昼夜恒温往往不能反映实际生产中的情况。本文在此基础上,进一步研究昼夜变温下高温与干旱胁迫对棉抗虫性影响。结果发现,昼夜变温下高温与干旱胁迫可降低泗抗1号和泗抗3号叶片中Cry1Ac毒蛋白含量,且随着胁迫时间延长,下降幅度逐渐增大。这与笔者前期研究一致,但是显著下降的时间上出现差异。前人研究发现,昼夜持续38℃胁迫棉株24 h后,泗抗1号和泗抗3号铃壳中Cry1Ac毒蛋白含量显著低于对照(32℃)[20]。但本研究中,在38℃(白天)/28℃(夜间)和土壤水分含量为田间土壤最大持水量50%(A2B1)、60%(A2B2)条件下,泗抗1号和泗抗3号叶片中Cry1Ac毒蛋白含量在受胁迫4 d时出现显著下降。34℃/28℃和田间土壤最大持水量50%条件(A1B1)下,胁迫4 d后开始显著低于对照。34℃/28℃和田间土壤最大持水量60%条件(A1B2)胁迫7—10 d内与对照无显著差异。可见与昼夜持续高温相比,棉在昼夜变温的高温与干旱胁迫下叶片中Cry1Ac毒蛋白含量下降速度显著降低,这可能是由于夜间温度变为正常温度(28℃)时,棉株受到胁迫得以缓解,体内生理代谢水平趋于正常,生长有一定程度恢复[21-22],叶片中Cry1Ac毒蛋白含量也随之升高。正如刘震宇等[21]研究发现,38℃胁迫72 h终止后,棉经48 h杀虫蛋白表达量可以恢复至对照水平。在本研究中,虽然白天12 h 34—38℃高温胁迫易导致棉Cry1Ac毒蛋白含量不同程度下降,但在夜间由于胁迫终止,经过12 h后Cry1Ac毒蛋白含量可能有所恢复。如此循环,最终导致Bt棉在昼夜变温的高温与干旱胁迫下叶片中Cry1Ac毒蛋白含量下降速度显著降低且下降时间有所推迟。但上述推论还有待进一步验证。
品种间相比,杂交种SK-3对高温与干旱互作胁迫有更强的抗逆性。这与前人研究[23]一致,因此生产实践中可以更多选择杂交种种植。
综上所述,昼夜变温研究更反映实际大田情况,可以更好地指导生产。如遇白天34℃的高温天气,应结合田间土壤水分含量制定棉铃虫防治策略;但当白天温度达到或超过38℃,且胁迫超过4 d时,必须提前进行打药,加强人工对棉铃虫等害虫的防治。此外,生产中如遇到高温干旱年份,可优先考虑选用杂交种来提高棉花自身抗逆性以减少后期农药使用,节约成本。
3.2 NR、GPT、GS活性是决定Bt棉Cry1Ac毒蛋白含量高低的关键指标
前人研究认为,逆境易导致棉基因表达量下降,从而引起Cry1Ac毒蛋白含量降低[24]。但本文中,昼夜变温下高温与干旱互作并未使得叶片中基因表达量下降,反而呈上升趋势,说明此逆境条件下mRNA转录水平提高,即在转录水平上并未导致基因表达量下降,与ZHANG等[12]研究结果一致,即基因的转录和翻译是2 个相对独立的过程,而且相关性较低。从mRNA到蛋白质合成是一个复杂的调控过程,尽管高温干旱条件下mRNA 水平转录水平提高,但有可能翻译效率有所下降,导致最终Cry1Ac毒蛋白含量降低。但随胁迫时间延长,所有处理基因表达量也在逐渐下降,说明棉花生长后期抗虫性下降可能与基因表达量降低有关,这与生产中出现的棉生长后期抗虫性降低相符合,但这并不是高温干旱胁迫引起Cry1Ac毒蛋白含量下降的原因。
单宁广泛存在于植物中,易与蛋白质、维生素及矿物质形成沉淀复合物。已有研究表明,棉花中缩合单宁和Cry1Ac毒蛋白之间可能有一定拮抗作用,Cry1Ac毒蛋白表达会影响棉花中缩合单宁的合成[25]。本研究发现,高温与干旱胁迫后叶片中单宁含量显著提高,且与Cry1Ac毒蛋白含量呈极显著负相关关系,说明单宁含量增加可能也是高温与干旱互作胁迫导致棉Cry1Ac毒蛋白含量下降的原因之一,但其影响机理还有待进一步研究。
Martins等[4]发现土壤含水量降低会降低植株中总可溶性蛋白和Cry1Ac毒蛋白的含量。陈德华等[26]、Yang等[27]研究发现土壤水分亏缺导致转基因作物氮代谢关键合成酶活性降低,分解酶活性升高。而Wang等[10]、Zhang等[20]、Olsen等[28]研究发现高温胁迫使蕾铃中氨基酸含量显著增加,SP含量和GPT活性显著下降,蛋白酶活性则明显提高。本研究与前人研究结果一致,昼夜变温下高温与干旱互作胁迫对棉棉铃叶片中SP、aa含量、NR、GPT、GOT、GS和GOGAT等蛋白质合成关键酶活性的影响与Cry1Ac毒蛋白一致;而蛋白酶、肽酶等蛋白质分解关键酶活性与蛋白含量的变化趋势相反。
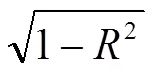
综上所述,NR、GPT、GS活性是间接反映昼夜变温的高温与干旱逆境下棉Cry1Ac毒蛋白含量高低的关键指标,并以NR活性直接作用最大。生产中,棉花花铃期应该主要通过提高NR、GPT、GS活性,以提高叶片Cry1Ac毒蛋白含量,该指标还可为高抗虫能力和高抗逆境品种的选育提供理论指导。
4 结论
与昼夜持续高温相比,棉在昼夜变温的高温与干旱胁迫下叶片中Cry1Ac毒蛋白含量下降速度显著降低。38℃(白天,7:00—19:00)/28℃(夜间,19:00—7:00)和土壤含水量为田间土壤最大持水量50%、60%胁迫4 d时,棉叶片中Cry1Ac毒蛋白含量显著下降,而34℃/28℃和田间土壤最大持水量50%胁迫4 d后开始显著低于对照,但34℃/ 28℃和田间土壤最大持水量60%胁迫7—10 d内与对照无显著差异。NR、GPT、GS活性是决定棉叶片中Cry1Ac毒蛋白含量高低的关键指标。生产中可通过调节上述3个酶的活性,来提高高温干旱逆境下Cry1Ac毒蛋白含量。
[1] 夏兰芹, 郭三堆. 高温对转基因抗虫棉中Bt杀虫基因表达的影响.中国农业科学, 2004, 37(11): 1733-1737.
Xia L Q, Guo S D. The expression of Bt toxin gene under different thermal treatments. Scientia Agricultura Sinica, 2004, 37(11): 1733-1737. (in Chinese)
[2] Chen D H, Ye G Y, Yang C Q, Chen Y. The effect of high temperature on the insecticidal properties of Bt cotton. Environmental and Experimental Botany, 2005, 53(3): 333-342.
[3] Benedict J H, Sachs E S, Altman D W, Deaton W R, Kohel R J, Ring D R, Berberich S A. Field performance of cottons expressing transgenic Cry1A insecticidal proteins for resistance toand(Lepidoptera: Noctuidae). Journal of Economic Entomology, 1996, 89(1): 230-238.
[4] Martins C M, Beyene G, Hofs J L, Kruger K, Vyver C V D, Schluter U, Kunert K J. Effect of water-deficit stress on cotton plants expressing thetoxin. Annals of Applied Biology, 2008, 152(2): 255-262.
[5] 张祥, 王剑, 彭盛, 芮秋治, 李丽楠, 陈媛, 陈源, 陈德华. 温度和土壤水分与Bt棉铃壳中杀虫蛋白表达关系及其氮代谢生理机制. 中国农业科学, 2018, 51(7): 1261-1271.
Zhang X, Wang J, Peng S, Rui Q Z, Li L N, Chen Y, Chen Y, Chen D H. Relationship between temperature, soil moisture, and insecticidal protein content in Bt cotton boll shell and the mechanism of nitrogen metabolism. Scientia Agricultura Sinica, 2018, 51(7): 1261-1271. (in Chinese)
[6] Stam M, Mol J N M, Kooter J M. The silence of genes in transgenic plants. Annals of Botany, 1997, 79(1): 3-12
[7] Allah B, Saima S, Tayyab H. A molecular approach to combat spatio-temporal variation in insecticidal gene (Cry1Ac) expression in cotton. Euphytica, 2012, 183(1): 65-74
[8] Shinji I, Takeshi S, Madoka N, Yasuhisa K. Influence of tannic acid on the insecticidal activity of aserovarformulation againstfabricius (Lepidoptera: Noctuidae). Biological Control, 2021, 157(1): 104558
[9] Chen Y, Liu Z Y, Tambel L, Zhang X, Chen Y, Chen D H. Reduced squareinsecticidal protein content of transgenic cotton under N deficit. Journal of Integrative Agriculture, 2021, 20(1):100-108.
[10] Wang J, Chen Y, Yao M H, Li Y, Wen Y J, Chen Y, Zhang X, Chen D H. The effects of high temperature level on square Bt protein concentration of Bt cotton. Journal of Integrative Agriculture, 2015, 14(10): 1971-1979.
[11] 陈松, 吴敬音, 何小兰, 黄骏麒, 周宝良, 张荣铣. 转基因抗虫棉组织中Bt毒蛋白表达量的ELISA测定. 江苏农业学报, 1997(3): 27-29.
Chen S, Wu J Y, He X L, Huang J Q, Zhou B L, Zhang R X. Quantification using ELISA ofinsecticidal protein expressed in the tissue of transgenic insect-resistant cotton. Jiangsu Journal of Agriculture Science, 1997(3): 27-29. (in Chinese)
[12] Zhang X, Wang J, Peng S, Li Y, Zhang L Y, Chen Y, Chen D H. Effects of soil water deficit on insecticidal protein expression in boll shells of transgenic Bt cotton and the mechanism. Frontiers in Plant Science, 2017, 8: 1-11.
[13] 邹琦. 植物生理学实验指导. 北京: 中国农业出版社, 2000: 127-130.
Zou Q. Experimental instruct of plant physiology. Beijing: China Agriculture Press, 2000: 127-130. (in Chinese)
[14] 邵金良, 黎其万, 董宝生, 刘宏程, 束继红. 茚三酮比色法测定茶叶中游离氨基酸总量. 中国食品添加剂, 2008(2):162-165.
Shao J L, Li Q W, Dong B S, Liu H C, Shu J H. Determination of total free-amino acid in tea by Nihydrin colorimetry. China Food Additives, 2008(2): 162-165. (in Chinese)
[15] Howard T. Regulation of alanine aminotransferase in leaves ofduring senescence. Zeitschrift fü Pflanzenphysiologie, 1975, 74(3): 208-218.
[16] 赵鹏, 何建国, 熊淑萍, 马新明. 氮素形态对专用小麦旗叶酶活性及籽粒蛋白质和产量的影响. 中国农业大学学报, 2010, 15(3): 29-34.
Zhao P, He J G, Xiong S P, Ma X M. Studies on the effects of different nitrogen forms on enzyme activity in flag leaves in wheat and protein and yield of grain for specialized end-uses. Journal of China Agricultural University, 2010, 15(3): 29-34. (in Chinese)
[17] 李文才, 林振武, 汤玉玮. 硝酸还原酶的研究——Ⅶ.棉花不同品种的硝酸还原酶活力. 作物学报, 1986, 12(2): 95-100.
Li W C, Lin Z W, Tang Y W. Studies on nitrate reductase VII. Nitrate reductase activities in different cotton cultivars. Acta Agronomica Sinica, 1986, 12(2): 95-100. (in Chinese)
[18] Hu W, Zhao W Q, Yang J S, Oosterhuis D M, Loka D A, Zhou Z G. Relationship between potassium fertilization and nitrogen metabolism in the leaf subtending the cotton (L.) boll during the boll development stage. Plant Physiology and Biochemistry, 2016, 101: 113-123.
[19] 杨宇晖, 张青文, 刘小侠. 棉花营养物质和单宁含量与其对绿盲蝽抗性的关系. 中国农业科学, 2013, 46(22): 4688-4697.
Yang Y H, Zhang Q W, Liu X X. The relationship between the contents of nutrients and tannins in different cotton varieties and their resistance to. Scientia Agricultura Sinica, 2013, 46(22): 4688-4697. (in Chinese)
[20] Zhang X, Rui Q Z, Liang P P, Wei C H, Deng G Q, Chen Y, Dong Z D, Chen D H. Dynamics of Bt cotton Cry1Ac protein content under an alternating high temperature regime and effects on nitrogen metabolism. Journal of Integrative Agriculture, 2018, 17(9): 1991-1998.
[21] 刘震宇, 王桂霞, 李丽楠, 蔡泽洲, 梁潘潘, 吴莘玲, 张祥, 陈德华.高温胁迫终止后Bt棉蕾杀虫蛋白的恢复特征及相关生理机制. 作物学报, 2020, 46(3): 440-447.
Liu Z Y, Wang G X, Li L N, Cai Z Z, Liang P P, Wu X L, Zhang X, Chen D H. Recovery characteristics of Bt insecticidal protein and relative physiology mechanisms after high temperature stress termination in square of Bt cotton. Acta Agronomica Sinica, 2020, 46(3): 440-447. (in Chinese)
[22] Chen S l, Li P, Tan S l, Pu X j, Zhou Y, Hu K m, Huang W, Liu L. Combined proteomic and physiological analysis of chloroplasts reveals drought and recovery response mechanisms in. Plants-Basel, 2021, 10(6): 1127.
[23] Liu Z Y, Eltayib H M A A, Wu H, Zhou M Y,Zhang X, Chen Y, Chen D H. Bt insecticidal efficacy variation and agronomic regulation in Bt cotton. Journal of Cotton Research, 2019, 2(1): 1-6.
[24] Maike S, Joseph N M M, Jan M K. The silence of genes in transgenic plants.Annals of Botany,1997,79(1): 3-12.
[25] 陆宴辉, 杨益众, 余月书. 棉花单宁的研究简介. 中国棉花, 2004(5): 21-22.
Lu Y H, Yang Y Z, Yu Y S. Review of the cotton tannin. China Cotton, 2004(5): 21-22.(in Chinese)
[26] 陈德华, 杨长琴, 陈源, 聂安全, 吴云康. 高温胁迫对Bt棉叶片杀虫蛋白表达量和氮代谢影响的研究. 棉花学报, 2003, 15(5): 288-292.
Chen D H, Yang C Q, Chen Y, Nie A Q, Wu Y K. The effects of the high temperature stress on the leaf Bt protein content and nitrogen metabolism of Bt cotton. Cotton Science, 2003, 15(5): 288-292. (in Chinese)
[27] Yang J, Lin L, Zhang L L, Wang K, Li X X, Cai M L, Zhan M, Li C F, Wang J P, Cao C G. Comparison of transgenic Bt rice and their non-Bt counterpart in yield and physiological response to drought stress. Field Crops Research, 2018, 217: 45-52.
[28] Olsen K M, Daly J C, Finnegan E J, Mahon R J. Changes in Cry1Ac Bt transgenic cotton in response to two environmental factors: temperature and insect damage. Journal of Economic Entomology, 2005, 98(4): 1382-1390.
[29] Stulen I, Koch B T, Koster A. An endogenous inhibitor of nitrate reductase in radish cotyledons. Acta Botanica Neerlandica, 1971, 20(4): 389-396.
[30] Saif A, Abdul H, Ma X L, Tung S A, Chattha M S, Shah A N, Luo D, Ahmad S, Liu J H, Yang G Z. Equal potassium- nitrogen ratio regulated the nitrogen metabolism and yield of high-density late-planted cotton (L.) in Yangtze River valley of China. Industrial Crops and Products, 2019, 129: 231-241.
[31] Eltayib H M A, Yuan L, Hen L, Chen Y, Leila I M, Hu D P, Zhang X, Chen D H. Amino acid composition and level affect Bt protein concentration in Bt cotton. Plant Growth Regulation, 2017, 82(3): 439-446.
Cry1Ac Protein Content Responses to Alternating High Temperature Regime and Drought and Its Physiological Mechanism inCotton
YIN YanYu, XING YuTong, WU TianFan, WANG LiYan, ZHAO ZiXu, HU TianRan, CHEN Yuan, CHEN Yuan, CHEN DeHua, ZHANG Xiang
Yangzhou University/Key Laboratory of Crop Genetics and Physiology of Jiangsu Province, Yangzhou 225009, Jiangsu
【Objective】This study was conducted to investigate the effects of alternating high temperature and drought on the content of Cry1Ac protein incotton and the underlying physiological mechanism, so as to provide a reference for the safe and stable utilization of insect resistance ofcotton in production.【Method】The conventional cultivar Sikang 1 (SK-1) and hybrid cultivar Sikang 3 (SK-3) were used in 2019 and 2020 in experimentally controlled greenhouse, Yangzhou University. From 7:00 am to 7:00 pm, two high-temperature treatments [34℃ (A1) and 38℃ (A2)] were imposed on cotton plants, followed by an optimum temperature 28℃ during the remaining night hours. There were two treatments for soil moisture content, which were 50% (B1) and 60% (B2) field capacity. The treatment with 32℃/28℃ and 75% field capacity was set as the control (CK). The leaf Cry1Ac protein content and its physiological mechanism were detected on 4, 7, and 10 days after stress (DAS), respectively.【Result】Compared with CK, the Cry1Ac protein content all decreased under the stresses of high temperature and drought, and with the extension of the stress time, greater decrease was observed. The extent of decline for A1B2 was the smallest, followed by A1B1, while A2B1 and A2B1 were the largest. The Cry1Ac protein content under A1B2 was significantly lower than CK after 7 DAS, while the significant differences between A1B1, A2B2, A2B2 and CK were detected after 4 DAS. Thegene expression level, soluble protein (SP), free amino acid (aa) contents, nitrate reductase (NR), the glutamic pyruvic transaminase (GPT), glutamic oxaloacetate transaminase (GOT), glutamine synthetase (GS) and glutamate synthase (GOGAT) activities showed a downward trend. While the tannin content, the activities of protease and peptidase showed an upward trend. The correlation analysis and path analysis showed SP, aa, NR, GPT, GOT, GS, and GOGAT were positively correlated with Cry1Ac protein content. The tannin content, activities of protease, and peptidase were negatively correlated with Cry1Ac protein content. NR, GPT and GS could be key indices for the Cry1Ac protein content.【Conclusion】The interaction of high temperature and drought resulted in the decrease ofCry1Ac protein content incotton, with greater decrease observed as the stress extended. There was no significant difference between the treatment with 34℃/28℃ and 60% field capacity and CK in 7-10 DAS. The reduction extent of Cry1Ac for alternating high temperature regime and drought decreased and the period was delayed. NR, GPT and GS could be key indices for the Cry1Ac protein content.
cotton; Cry1Ac protein; high temperature; drought; physiological mechanism

10.3864/j.issn.0578-1752.2022.23.004
2022-01-04;
2022-04-19
江苏省高等学校自然科学研究(22KJA210005)、国家自然科学基金(31901462)、扬州大学大学生科创基金(X20210630,X20210607)、江苏省高校优势学科建设工程、江苏高校品牌专业建设工程(PPZY2015A060)
尹彦雨,E-mail:2026231662@qq.com。通信作者陈德华,E-mail:cdh@yzu.edu.cn。通信作者张祥,E-mail:zhangxiang@yzu.edu.cn
(责任编辑 杨鑫浩)
