水分胁迫下水肥耦合对矮砧富士幼树生长及保护酶活性的影响
2022-01-28石美娟续海红窦彦鑫
石美娟,续海红,郭 华,杨 凯,窦彦鑫
(山西农业大学果树研究所,山西 太原 030031)
截至2019年,中国的苹果种植面积和产量均占世界50%以上[1],其中苹果产业布局主要为环渤海湾和西北黄土高原两大优势区,分别占我国苹果总面积的26.9%、57.2%,生产集中度占85%以上[2]。矮砧集约高效栽培技术模式是世界苹果发展的方向,也是今后一段时间我国苹果栽培的主推模式,目前我国矮砧栽培面积大约15万hm2。黄土高原区域苹果主栽区干旱半干旱丘陵山区居半数以上,干旱少雨、水资源严重不足,旱害胁迫成为该地区苹果产业长足发展的主要制约因素。氮磷钾作为植物生长的三大必需元素,对提高作物抵抗逆境能力有着重要作用,而水分是影响肥效发挥的关键因子。治理干旱区中低产田的关键要素就是要遵照“数量减半、少量多次、养分平衡”进行土肥水耦合[3]。近年来,在干旱胁迫条件下,以单一或两种养分元素耦合对作物抗旱性研究较多,有关水肥耦合对抗旱性影响多集中在玉米[4]、小麦[5]、水稻[6]等农作物,对矮砧富士果树的研究主要集中在产量和果实品质等方面,针对滴灌条件下水分胁迫时氮磷钾配比耦合对其幼树(挂果前)生理抗旱性的研究较少。本研究选取不同配比水肥耦合处理后富士幼树的形态和生理指标分析研究,旨在阐明不同配比氮磷钾营养元素与矮砧富士抗旱性的关系,科学制定在保证产量的前提下增强其抗旱性的最佳水肥制度,为促进矮砧集约抗旱栽培模式在黄土高原大力推广提供科学依据。
1 材料与方法
1.1 试验地概况及参试材料
试验于2019年4月—2020年10月连续2 a在山西省农科院果树研究所旱作节水团队试验园避雨棚(东经112°29′、北纬37°23′)内进行。试材为3~4 a海棠/SH6/‘晋富’,挑选长势基本一致、无病虫害的富士幼树,在富士苹果树生长发育期,参照“3414”[7]不完全施肥方案,按照N∶P2O5∶K2O总施用比例为1∶0.7∶1进行盆栽控水试验。取果园内0~80 cm土层混匀土壤加1/3 N肥和全部P、K肥作基肥,剩下2/3 N肥滴灌追施。设计3个水分水平:以田间持水量的20%θf(重度水分胁迫,θf为田间持水量)、40%θf(轻度水分胁迫)、60%θf(正常水分)为灌水下限进行耦合试验,各处理施肥水平详见表1。每个处理3盆,重复3次,完全随机排列。于每次施肥处理后一周左右,选取树体中部各个方向10片功能叶片采样,进行生理生化等指标测定[8-9]。试验所用分析数据为2 a所测数据平均值。
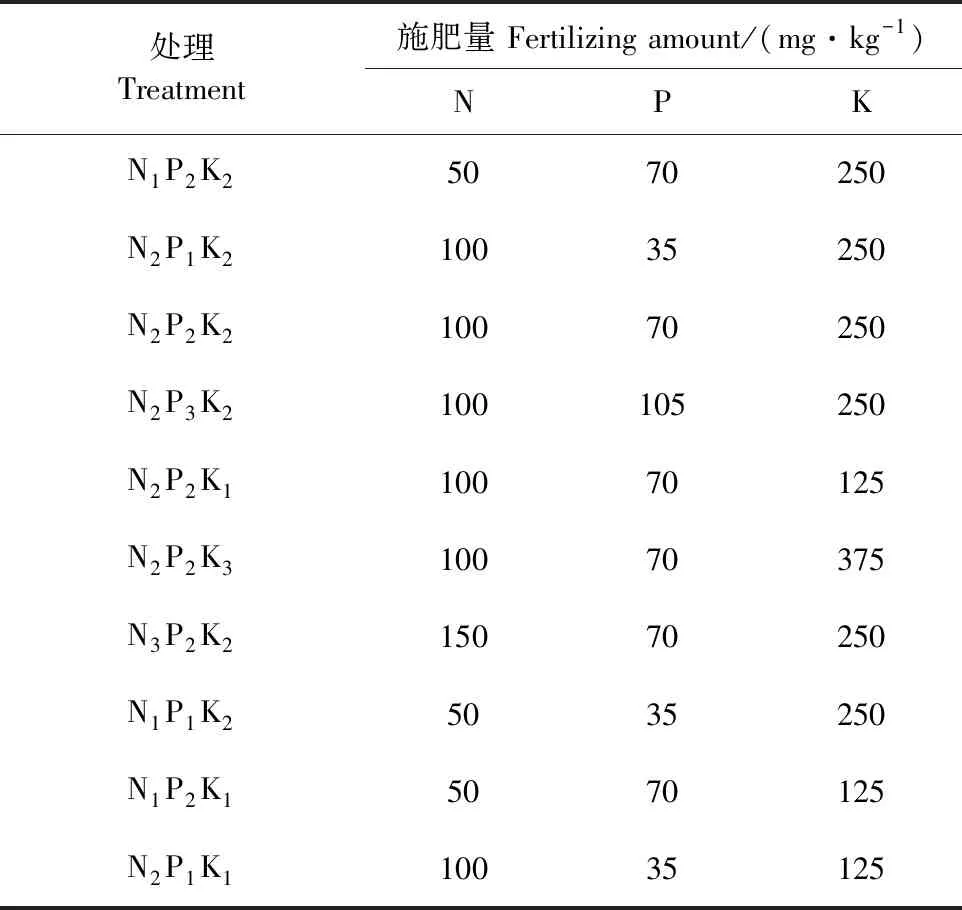
表1 “3414”不完全肥料施肥方案Table 1 “3414”incomplete fertilizer application scheme
1.2 测定项目及方法
新梢增长量测定:采用直接测量法;叶面积测定:采用AM300型叶面积仪测量;叶片水势差测定:采用力高泰叶片水势仪测量水分充足时的叶片水势减去干旱胁迫处理后的叶片水势,为该处理下的叶片水势差。等级范围:轻微干旱(0.1~0.5 MPa),中度干旱(0.5~1.0 MPa),重度干旱(1.0~1.5 MPa),严重干旱(1.5 MPa以上)[10]。
叶绿素含量测定采用乙醇丙酮浸提法;相对电导率测定采用电导法;丙二醛(MDA)含量测定采用硫代巴比妥酸(TAB)比色法[11];超氧化物歧化酶(SOD)活性测定采用氮蓝四唑光还原法[12];过氧化物酶(POD)活性测定采用愈创木酚法[13];脯氨酸含量采用李合生黄基水杨酸法[12];可溶性糖含量采用蒽酮比色法测定[14]。
1.3 数据分析
采用Excel 2007进行数据处理和作图,利用SAS13.0软件在α=0.05水平下对试验数据进行方差分析和Duncan多重比较。
2 结果与分析
2.1 水分胁迫下水肥耦合对矮砧富士幼树生长和叶片水势差的影响
由图1和表2中可以发现,在连续2 a的试验中,各个指标变化规律有所不同。处理N1P2K2、N2P2K2、N3P2K2在相同N水平时,轻度(40%θf)和重度(20%θf)水分胁迫下,N3水平的新梢增长量降幅最小,且各水平间变幅差异不显著(P>0.05)。随着施N量的增加,2种水分胁迫下叶绿素含量呈先升后降趋势,都是N2水平的降幅最小,且各水平间变幅差异不显著。随着施N量的增加,2种水分胁迫下叶面积呈下降趋势;在轻度(40%θf)水分胁迫下N3水平的叶面积降幅最小;重度(20%θf)水分胁迫下N2水平降幅最小,且各水平间变幅差异显著。叶片水势差随着施N量的增加,在轻度干旱(40%θf)、重度(20%θf)胁迫下均为N2水平增幅最小,轻度干旱(40%θf)时N3与各水平间差异显著;在重度干旱(20%θf)胁迫下,N2与N1、N3差异显著。
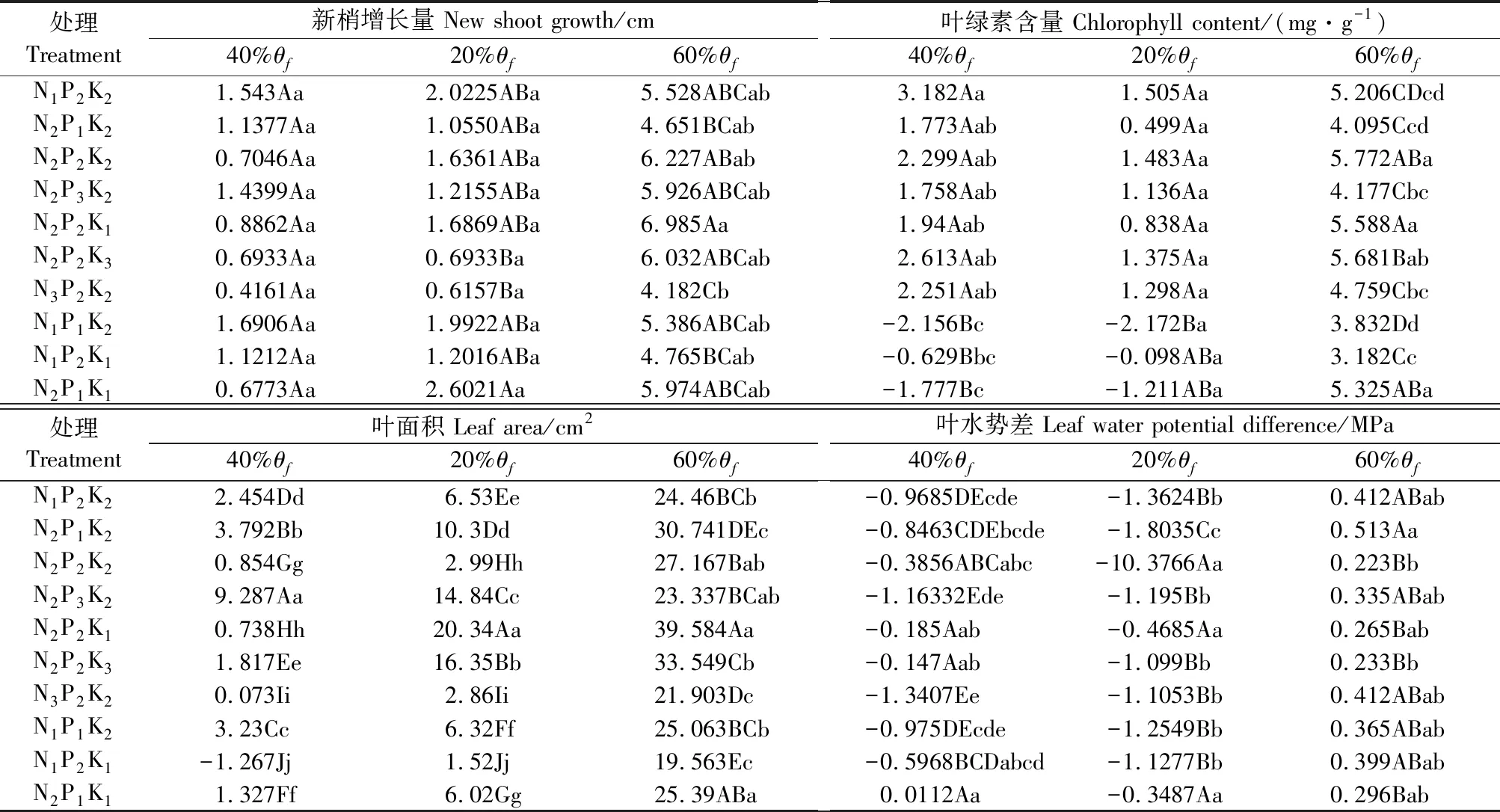
表2 水分胁迫下不同处理矮砧富士幼树生理生长及水势差变化幅度Table 2 Variation range of physiological growth and water potential difference of dwarf rootstock Fuji sapling under different water stress
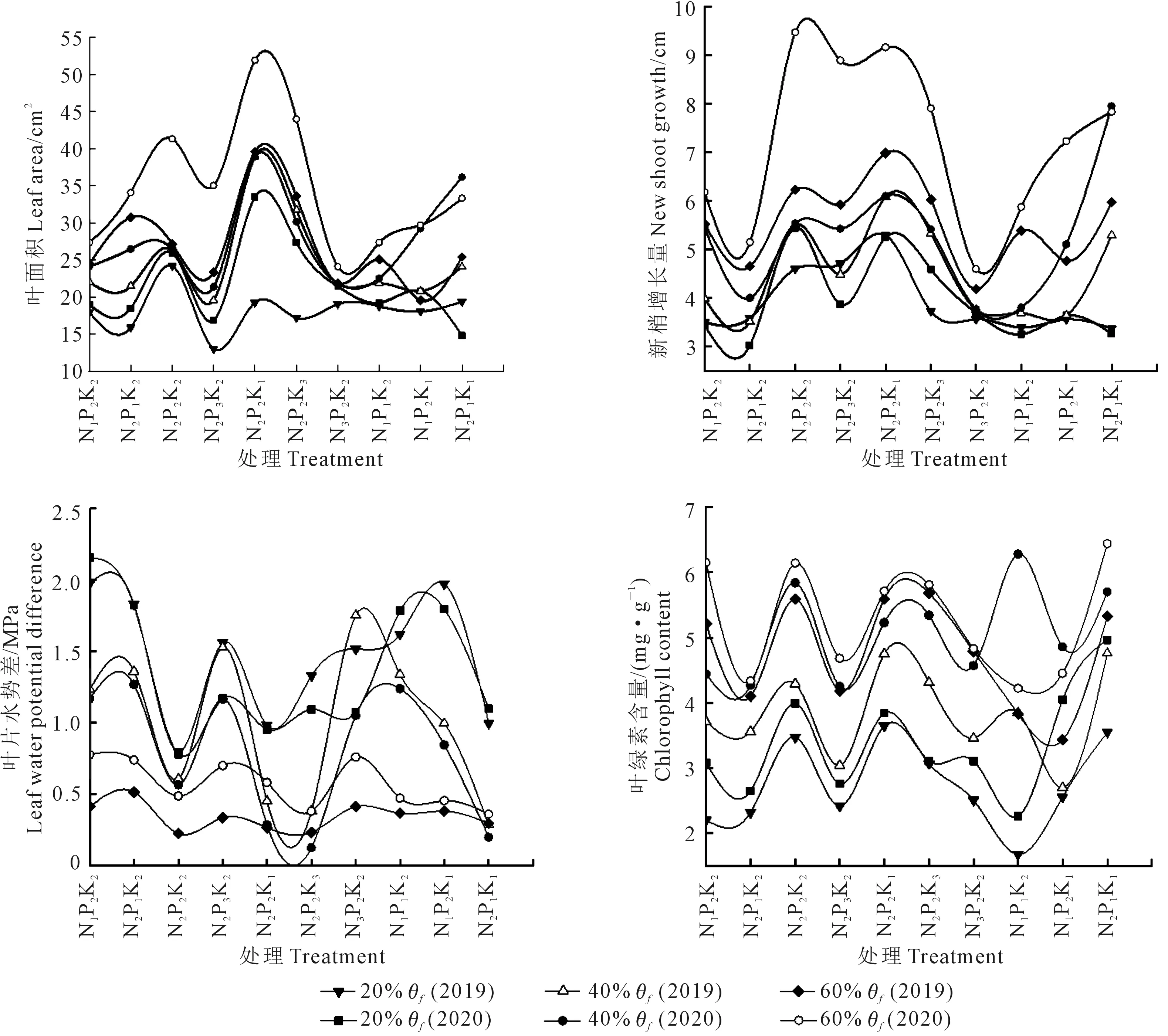
图1 水分胁迫下不同处理矮砧富士幼树叶面积、新梢增长量、叶片水势差、叶绿素含量的变化Fig.1 Variation of leaf area,shoot growth,leaf water potential difference and chlorophyll content of dwarf rootstock Fuji sapling under water stress
处理N2P1K2、N2P2K2、N2P3K2,同一P水平时,在2种水分胁迫下,新梢增长量轻度(40%θf)胁迫时呈先升后降,P2水平的新梢增长量降幅最小,重度(20%θf)水分胁迫下呈上升趋势,P3水平降幅最小,且各水平间差异不显著。相同P水平时叶绿素含量呈先升后降趋势,在轻度(40%θf)水分胁迫下P1水平降幅最小,而重度(20%θf)胁迫时P2水平的降幅最小,且各水平间差异不显著。随着施P量的增加,2种水分胁迫下叶面积呈先降后缓升趋势,而且都是P2水平下的叶面积降幅最小,各水平间差异显著;轻度水分(40%θf)胁迫下叶片水势差变化为P3水平增幅最大且与其他水平变幅差异显著;重度水分(20%θf)胁迫下叶片水势差变化为P1水平增幅最大且各增幅间差异极显著。
处理N2P2K1、N2P2K2、N2P2K3,相同K水平时,在2种水分胁迫下,新梢增长量呈下降趋势,在轻、重度胁迫时新梢增长量降幅最小的分别是K2、K1水平,且各水平间差异不显著。轻度(40%θf)水分胁迫下叶绿素含量呈下降趋势,重度(20%θf)水分胁迫下呈上升趋势,轻、重度胁迫下都是K1水平的变化幅度最小,且各水平间差异不显著。相同K水平时,轻度(40%θf)水分胁迫下叶面积呈缓升趋势,K3水平升幅最大;而重度(20%θf)水分胁迫下叶面积呈先降后升趋势,K2水平下的叶面积升幅最大,各水平间差异极显著。叶片水势差在轻度(40%θf)水分胁迫时,K2水平变幅最大,与其他水平变幅差异显著;重度水分(20%θf)胁迫下K3水平变幅最大,且与其他水平间差异显著。
NPK交互作用的结果为:新梢增长量受到轻度(40%θf)水分胁迫时N2P1K1处理的降幅最小,为11.3%,重度水分(20%θf)胁迫时N3P2K2处理降幅最小,为14.7%,且都与N2P2K2、N2P3K2和N2P2K1处理差异显著。叶面积受到轻度(40%θf)水分胁迫时N1P2K1处理的叶面积不降反增高了6.5%,N2P1K2与N3P2K2间降幅差异显著;重度水分(20%θf)胁迫时N1P2K1处理下叶面积的降幅最小(7.8%),且与N2P3K2间降幅差异显著,其他处理间差异不显著。叶绿素含量受到轻度(40%θf)水分胁迫时N1P1K2处理的相对叶绿素含量不降反升高了0.4%,其中N2P2K1、N2P1K1与N1P2K1差异显著;重度(20%θf)水分胁迫时N1P2K1处理的降幅最小(19.8%),N2P2K2、N2P2K3及N2P1K1处理间变幅差异不显著,与其他各处理差异显著。轻度(40%θf)水分胁迫时N2P1K1处理的水势差表现为0.285 MPa,变幅不增反降了3.7%;重度水分(20%θf)胁迫时N2P1K1处理的叶片水势差等级最低,仅0.798 MPa,其中N1P2K2、N2P1K2、N2P3K2、N3P2K2、N1P1K2处理的变幅与N2P2K2、N2P2K3、N3P2N2、N2P1K1处理的变幅差异性显著。
2.2 水分胁迫下水肥耦合对矮砧富士幼树渗透调节物质的影响
由图2和表3中可以发现,处理N1P2K2、N2P2K2、N3P2K2,相同N水平下,在轻度(40%θf)水分胁迫下脯氨酸含量呈先降后升趋势,其中N3水平的升幅最大;在重度(20%θf)水分胁迫下脯氨酸含量呈先升后降趋势,其中N2水平的升幅最大,且各水平间变幅差异极显著。随着施N量的增加,2种水分胁迫下可溶性糖含量呈先升后降趋势,都是N2水平的增幅最大,且各水平间变幅差异极显著。

表3 水分胁迫下不同处理矮砧富士幼树渗透调节物质含量变化幅度Table 3 Variation range of osmotic regulatory substances content of dwarf rootstock Fuji sapling under different water stress

图2 水分胁迫下不同处理矮砧富士幼树脯氨酸含量、可溶性糖含量的变化Fig.2 Changes of proline content and soluble sugar content of dwarf rootstock Fuji sapling under water stress
处理N2P1K2、N2P2K2、N2P3K2,相同P水平下,在2种水分胁迫下,脯氨酸含量都呈先升后降趋势,也都是P2水平的脯氨酸含量升幅最大,且各水平间差异极显著。相同P水平时可溶性糖含量呈先升后降趋势,也都是P2水平的脯氨酸含量升幅最大,且各水平间差异极显著。
处理N2P2K1、N2P2K2、N2P2K3,相同K水平下,在2种水分胁迫下,脯氨酸含量呈先升后降趋势,也都是K2水平的脯氨酸含量升幅最大,且各水平间差异极显著。轻度(40%θf)水分胁迫下可溶性糖含量呈先升后降趋势,K2水平的升幅最大;重度(20%θf)水分胁迫下呈下降趋势,K3水平的升幅最大。2种水分胁迫下各水平间差异极显著。
NPK交互作用的结果为:脯氨酸含量受到轻度(40%θf)、重度(20%θf)水分胁迫时,N2P2K2处理的增幅最大,分别为1.57倍和1.56倍,且各处理间变幅差异显著;可溶性糖含量受到轻度(40%θf)水分胁迫时,N1P2K2处理增加了22.4%,N1P2K2处理下增幅最大,为83%,重度水分(20%θf)胁迫时N2P2K3处理的增幅最大,为1.04倍。2种水分胁迫下各个处理间变幅差异极显著。
2.3 水分胁迫下水肥耦合对矮砧富士幼树MDA含量及相对电导率的影响
由图3和表4可以看出,处理N1P2K2、N2P2K2、N3P2K3相同N水平时,在轻度(40%θf)和重度(20%θf)水分胁迫下,MDA含量变化趋势为先降后升,都是N2水平的增幅最大,且各水平间变幅差异极显著。随着施N量的增加,轻度(40%θf)水分胁迫下相对电导率呈先降后升趋势,N2水平的增幅最大;重度(20%θf)水分胁迫下,N3水平的增幅最大,且各水平间变幅差异极显著。
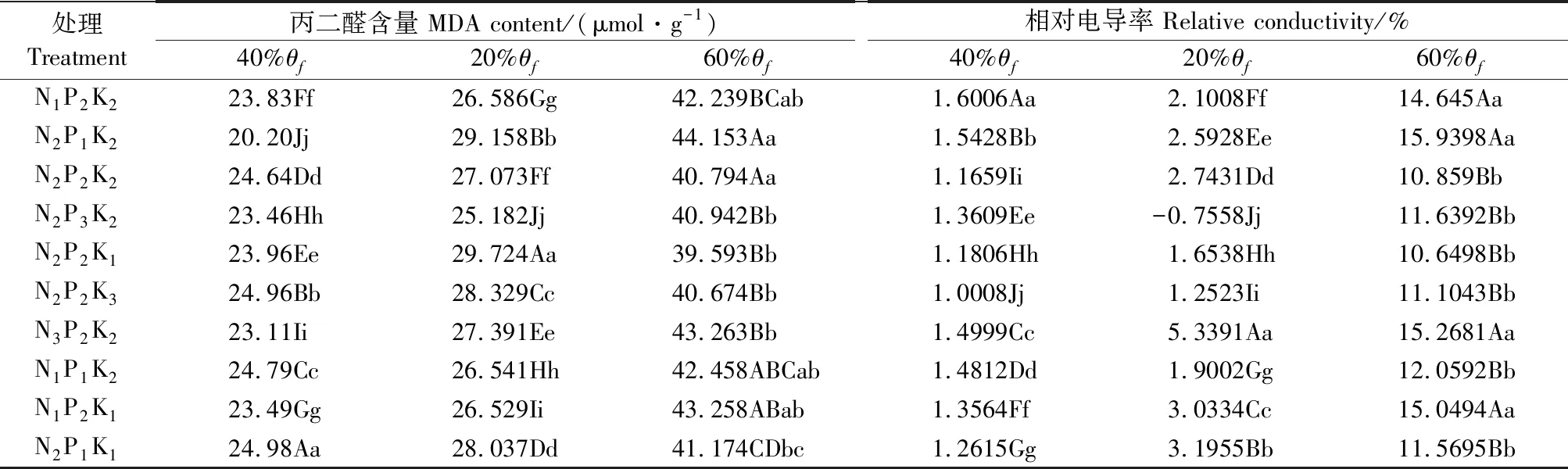
表4 水分胁迫下不同处理矮砧富士幼树丙二醛含量及相对电导率变化幅度Table 4 Variation range of MDA and relative conductivity of dwarf rootstock Fuji sapling under different water stress
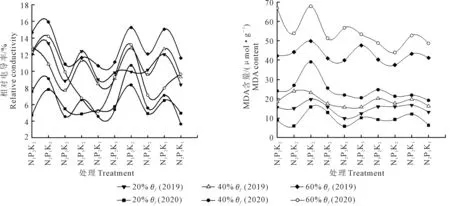
图3 水分胁迫下不同处理矮砧富士幼树相对电导率及MDA含量的变化Fig.3 Variation of relative conductivity and MDA content of dwarf rootstock Fuji sapling under water stress
处理N2P1K2、N2P2K2、N2P3K2,相同P水平时,MDA含量在轻度(40%θf)胁迫时呈下降趋势,重度(20%θf)水分胁迫下呈先降后升趋势,2种水分胁迫下,都是P2水平降幅最大,且各水平间变幅差异极显著。相同P水平时,相对电导率受水分胁迫时呈先降后升趋势,各水平间差异显著,在轻度(40%θf)水分胁迫下P3水平变幅最大,而重度(20%θf)胁迫时是P2水平的变幅最大。
处理N2P2K1、N2P2K2、N2P2K3,相同K水平时,轻度(40%θf)水分胁迫下MDA含量呈下降趋势,重度(20%θf)水分胁迫下呈先降后升趋势,K1水平降幅最大,且各个水平间变幅差异极显著。轻度(40%θf)水分胁迫下相对电导率呈渐升趋势,K1水平的升幅最大;重度(20%θf)水分胁迫下呈先降后升趋势,K2水平的升幅最大;各个水平间变幅差异极显著。
NPK交互作用的结果为:MDA含量受到轻度(40%θf)水分胁迫时N2P2K3处理的降幅最大,为61.4%,重度水分(20%θf)胁迫时N2P2K1处理降幅最大,为75.07%,且各处理间变幅差异极显著;受到轻度(40%θf)水分胁迫时N2P2K1处理的相对电导率降幅最大,重度(20%θf)水分胁迫时N2P2K2处理的降幅最大,2种水分胁迫时各处理间变幅差异极显著。
2.4 水分胁迫下水肥耦合对矮砧富士幼树保护酶活性的影响
由图4和表5可以看出,处理N1P2K2、N2P2K2、N3P2K2,相同N水平时,在轻度(40%θf)和重度(20%θf)水分胁迫下,POD酶活性呈先升后降趋势,在轻度(40%θf)水分胁迫下N3水平的升幅最大,重度(20%θf)水分胁迫下N3水平升幅最大,2种水分胁迫下各水平间变幅度差异极显著。随着施N量的增加,2种水分胁迫下SOD酶活性呈先升后降趋势,都是N1水平的升幅最大,且各水平间变幅度差异极显著。
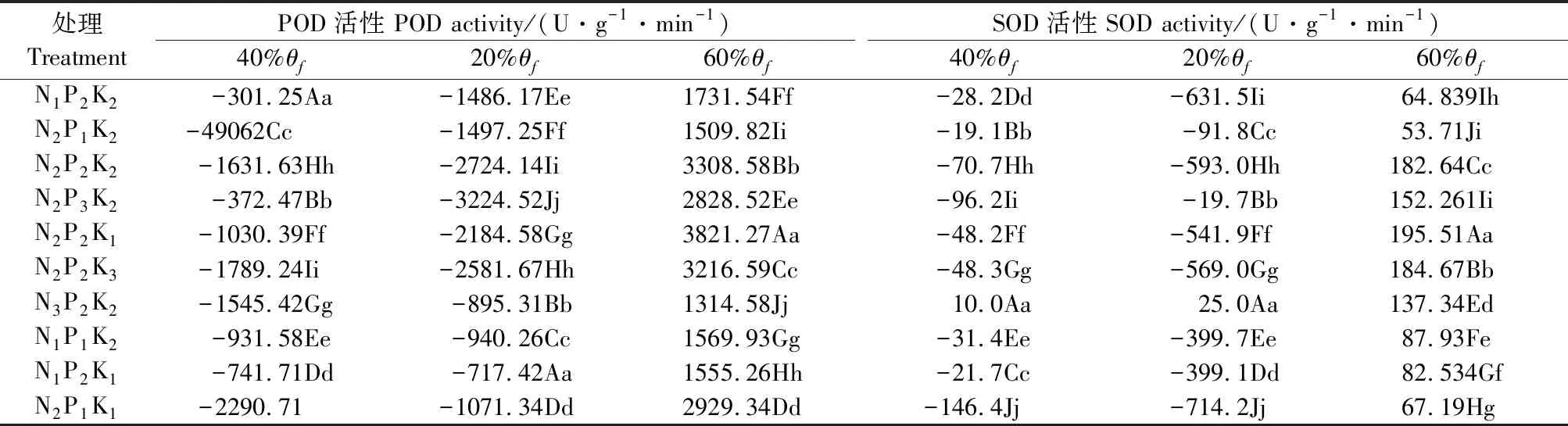
表5 水分胁迫下不同处理富士幼树保护酶活性变化幅度Table 5 Variation range of protective enzyme activity of young Fuji under different water stress
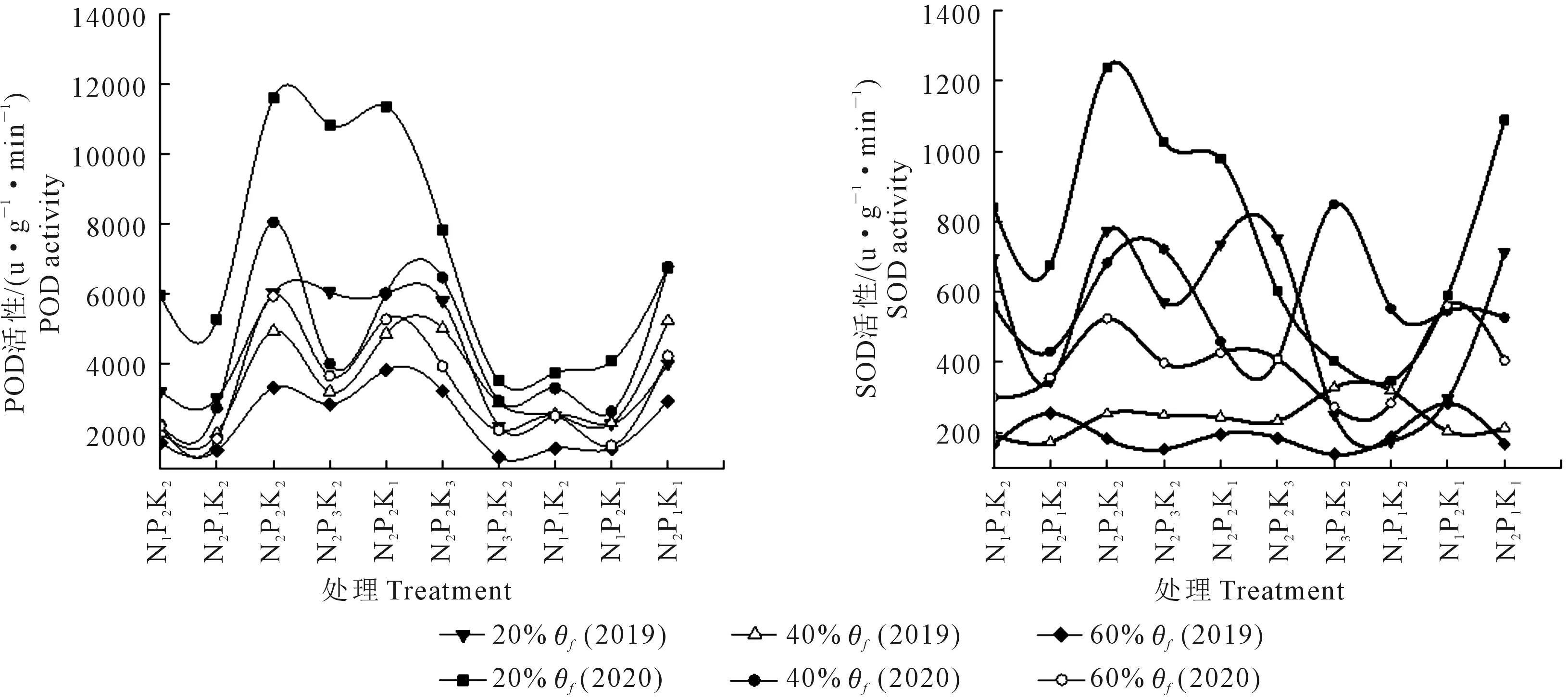
图4 水分胁迫下不同处理矮砧富士幼树POD、SOD酶活性的变化Fig.4 Changes of POD and SOD activities of dwarf rootstock Fuji sapling under water stress
处理N2P1K2、N2P2K2、N2P3K2,相同P水平时,POD酶活性在轻度(40%θf)胁迫时呈上升趋势,P2水平的升幅最大;重度(20%θf)水分胁迫下呈先升后降趋势,P3水平增幅最大,在2种水分胁迫下,各水平间变幅差异极显著。相同P水平时SOD酶活性呈先升后降趋势,在轻度(40%θf)水分胁迫下P3水平变幅最大,而重度(20%θf)胁迫时P2水平的变幅最大,且各水平间变幅差异极显著。
处理N2P2K1、N2P2K2、N2P2K3,相同K水平时,轻度(40%θf)水分胁迫下POD酶活性呈渐升趋势,变幅最大是K3水平;重度(20%θf)水分胁迫下POD酶活性呈先升后降趋势,K2水平变幅最大;在2种水分胁迫下各水平间变幅差异极显著。轻度(40%θf)水分胁迫下SOD酶活性呈上升趋势,变幅最大是K2水平;重度(20%θf)水分胁迫下呈先升后降趋势,其中K3水平的升幅最大;在2种水分胁迫下各水平间变幅差异极显著。
NPK交互作用的结果为:POD酶活性受到轻度(40%θf)水分胁迫时N3P2K2处理的增幅最大,重度水分(20%θf)胁迫时N2P1K1处理增幅最大,2种水分胁迫下各处理变幅差异显著。SOD酶活性受到轻度(40%θf)水分胁迫时N2P1K1处理的增幅最大,重度水分(20%θf)胁迫时N1P2K2处理的增幅最大,2种水分胁迫下各处理变幅差异显著。
3 讨论与结论
3.1 水分胁迫下水肥耦合对矮砧富士幼树生理生长及水势差的影响
新梢增长量、叶面积及叶绿素含量都是直接反映果树生长的形态指标。在不同水分供应条件下,各指标的升降幅度能直观反映果树受到胁迫时生长抑制程度。叶片水势是土壤—植物—大气之间水分平衡状态的综合反映,可以通过叶片水势差判断果树与充足水分供应相比受干旱胁迫的影响程度。叶绿素是作物吸收太阳能进行光合作用的重要物质。在本试验中,矮砧富士的新梢生长量、叶面积、相对叶绿素含量在轻、重度水分供应时随着N、P、K施用水平的增大都有不同程度地增高,其中当施P 70 mg·kg-1、K 125 mg·kg-1时,N 150 mg·kg-1水平下2种水分胁迫下降幅最小,有利于矮砧富士幼树生长。这一结果与里程辉等[15]研究得出的在水分胁迫时植株对干旱的补偿反应就是通过增加叶片的叶绿素含量从而保持较高产量的结果基本一致。叶片水势则在2种水分胁迫时N 100 mg·kg-1、P 70 mg·kg-1、K 250 mg·kg-1时抗旱指数最高,这一结果与周罕觅等[16]的高水势处理利于植株旺盛生长的研究结果基本一致 ;N、P、K、交互作用时,轻度(40%θf)水分胁迫下N3P2K2、N2P1K1利于矮砧富士幼树形态指标及叶片水势差保持正常水平,重度(20%θf)水分胁迫下N3P2K2、N2P2K2、N1P2K1处理形态指标和叶片水势差维持较好。说明在矮砧富士以生理生长为主的幼树期,N素作为限制植物生长和产量形成的重要因素[17],对其有不可或缺的影响,与罗双龙等[18]研究结果一致。
3.2 水分胁迫下水肥耦合对矮砧富士幼树渗透调节物质的影响
渗透调节是抗旱性的一种重要机制[19]。王元基等[20]的研究结果显示:可溶性糖和游离脯氨酸含量与抗旱性密切相关。在本试验中,轻、重度水分胁迫下N2、P3、K2、K3水平下和N2P3K2、N2P2K3交互作用下可溶性糖含量显著增加;在轻度和重度水分胁迫下的脯氨酸含量在N2、N3、P2、K2水平和N2P2K2交互作用下增加明显。此结论与刘忠霞等[21]得出干旱胁迫时高钾有利于苹果渗透调节物质含量增加的研究结果基本一致。
3.3 水分胁迫下水肥耦合对矮砧富士幼树丙二醛(MDA)含量及相对电导率的影响
质膜的透性、丙二醛的含量变化可以反映膜脂过氧化受破坏的程度。干旱胁迫下通过测定植株外渗电介质的电导率可推算质膜透性的变化[22]来对比抗旱性强弱,刘忠霞[23]等研究表明抗旱性强的品种其相对电导率或丙二醛的含量较低。在本试验中,轻、重度水分胁迫下N2、P2、K1水平下和N2P2K1交互作用下MDA含量显著增加;在轻度水分胁迫下相对电导率值在N2、P3和K1和N2P2K1交互作用时下降明显,在重度水分胁迫下相对电导率值在N3、P2、K2水平和N2P2K2交互作用下下降显著。这一结果与康晓育等[24]追施氮肥可增强其抗逆性的研究结果一致。
3.4 水分胁迫下水肥耦合对矮砧富士幼树保护酶活性的影响
当植物受到干旱胁迫时,SOD 作为植物抗氧化系统的第一道防线,其主要功能是清除细胞中多余的超氧阴离子,防止对细胞膜系统造成伤害[25]。过氧化物酶(POD)作为抗氧化剂作用的酶可以清除自由基,使得细胞膜所受伤害降低[26],减轻了膜脂氧化的程度。在外界胁迫下保护酶能保持较高水平说明其抗旱性较高,反之则较低。在本试验中,轻、重度水分胁迫下N1、N3、K2、K3、P3和P2水平及N2P3K2、N2P1K1交互作用下POD 酶活性显著增加;在2种水分胁迫下脯氨酸含量在N2、N3、P2、K2水平和N2P2K2交互作用下增加明显。此结果与形态指标所示结果一致。SOD酶活性在受到2种水分胁迫下N1、K2、K3、P3和P2水平及N2P2K2交互作用下显著增加,此结果与张海亭等[27]得出的N 150 mg·kg-1、P 130.98 mg·kg-1时,干旱胁迫下低K(249 mg·kg-1)、较高K(498 mg·kg-1)提高SOD酶活性的幅度大的结论基本一致。由此可见,在干旱胁迫下适量增施N、P、K营养素有利于提高保护酶活性。
本试验研究发现:在当前条件下,轻度(40%θf)水分胁迫时施用N(100、150 mg·kg-1)、P(70、105 mg·kg-1)、K(250、375 mg·kg-1),重度(20%θf)水分胁迫时施用 N(100、150 mg·kg-1)、P(70 mg·kg-1)、K(125、250 mg·kg-1)有利于矮砧富士果树生长,且在轻、重度干旱胁迫时NPK交互作用抗旱效果要优于单独施用N、P、K的抗旱效果。但超出N、P、K适宜用量范围则会造成果树生理干旱,不利于果树生长。干旱是影响苹果生长的重要限制因子,也是一种最为常见的非生物胁迫[28]。果树因其生长环境复杂,又因干旱的快慢程度、持续时间不尽相同,树体内相关激素或抗旱基因的防御、保护作用大小和先后顺序都由一整套分子机制来控制,因此未来的研究重点将是挖掘果树相关抗旱基因,探明其生理指标的阈值及抗旱分子机制。
