3株耐盐碱促生菌对绿豆根际微生态的影响
2022-01-28王艳宇王思文殷奎德张兴梅
王艳宇,刘 爽,李 鑫,王思文,刘 权,殷奎德,张兴梅
(1.黑龙江八一农垦大学农学院,黑龙江 大庆 163319;2.黑龙江八一农垦大学生命科学技术学院,黑龙江 大庆 163319)
据统计,全球盐碱土地面积约达10亿公顷[1],同时,灌溉方式不当、过度使用农药化肥和乱砍乱伐等人为因素导致土壤盐碱化程度更加严重。土壤中的大量无机盐不仅会降低土壤肥力,还会影响植物的正常生理活动,最终造成粮食减产[2]。因此,利用生态友好且高效的途径改良盐碱地,是当前推动农业发展和生态环境恢复的重要举措[3]。
微生物改良盐碱地是当前的研究热点,其基本原理是应用根际促生菌(Plant growth promoting rhizobacteria,PGPR)来改善植物根系微环境,进而缓解盐碱胁迫对植物生长的抑制作用,最终达到改良盐碱土壤的目的。根际土壤作为土壤-植物根系-微生物三者间进行物质循环和能量转化最活跃的区域,对保持生态系统养分动态平衡有着至关重要的作用[4]。PGPR是定殖于植物根系的有益菌[5],具有提高营养元素可得性、分泌植物激素[6]、产生抗菌物质和诱导植物系统抗性等功能[7]。当PGPR到达植物根系时,土壤微生物群落结构和养分含量会发生改变,这一过程是其发挥促生作用的前提[8]。目前,国内外研究较多报道了PGPR在盐碱胁迫下对植物生长的促生效果[9-11],关于施用PGPR对植物根际土壤微生态影响的研究却鲜有报道。因此,探究盐碱胁迫下PGPR对植物根际微生物代谢功能和群落结构的影响,对明确PGPR的促生机制来说是必要的。
本研究利用耐盐碱促生菌S29、KM1和NM8,通过盆栽试验探究单一菌株与复合菌系对绿豆生长和土壤酶活性的影响,同时采用Biolog-Eco板和高通量测序技术检测绿豆根际土壤细菌代谢功能和群落结构的变化,为提高绿豆耐盐碱能力和改良盐碱土壤提供依据。
1 材料与方法
1.1 材料
1.1.1 绿豆品种 试验用的绿豆品种为“小明绿”,由国家杂粮中心提供。
1.1.2 菌株来源 盆栽试验中接种的菌株S29、KM1和NM8由黑龙江八一农垦大学植物微生物互作实验室提供,筛选自大庆地区盐碱土,菌株S29为卓贝尔氏菌(Zobellella),具有固氮、产铁载体、产吲哚乙酸(IAA)和ACC脱氨酶功能;KM1和NM8分别为沙雷氏菌(Serratia)和芽孢杆菌(Bacillus),均具有固氮、解磷、产IAA和ACC脱氨酶功能,3株菌均能够在pH 9.5浓度为100 mmol·L-1NaHCO3的培养基上生长。
1.1.3 土壤样品采集 用于绿豆盆栽试验的土壤采集自大庆市植被生长较好的盐碱地草原,pH 8.34,可溶性盐含量1.5 g·kg-1,碱解氮、速效钾和有效磷含量分别为86.00、398.00、19.20 mg·kg-1,有机质含量为33.70 g·kg-1。
1.2 试验方法
1.2.1 菌液的制备 将菌株S29、KM1和NM8接种于LB培养基,28℃、175 rpm·min-1培养24 h,用无菌水调节细菌数至108CFU·mL-1,将调节后的KM1、NM8和S29菌悬液等体积混合即为复合菌系。
1.2.2 盆栽试验 共设4个处理组和1个对照组(CK),处理组分别为接种菌株S29、KM1、NM8和复合菌。将取回的盐碱土与沙子以2∶1的比例混合,装入31 cm×25 cm方槽中,每个方槽装7.5 kg混合土,绿豆种子经次氯酸钠消毒后播种,播种密度为每槽30株,重复3次,播种后按照1 g土107CFU接种量菌株稀释培养液,CK组加入等量培养基稀释液,置于人工气候室中培养。出苗15天后补接菌液1次,接种量为上一次的50%,同时浇灌Hoagland营养液500 mL,适时浇灌等量蒸馏水。
1.3 测定项目及方法
1.3.1 绿豆的生长指标 绿豆生长至30 d时统计植株的株高、地上及地下部分的干重和鲜重。
1.3.2 绿豆根际土壤酶活性的测定 利用“抖根法”[12]收集不同处理下生长30 d的绿豆根际土,采集的土壤置于室内自然风干后,参照关松荫[13]的方法进行碱性磷酸酶、蔗糖酶、过氧化氢酶和脲酶活性测定。
1.3.3 绿豆土壤细菌对不同碳源利用情况的测定 取5 g绿豆根际土加入到装有50 mL无菌水的三角瓶中,震荡混匀后静置片刻,吸取上清液用无菌水稀释1 000倍。取115 μL上述稀释液加入到Biolog-ECO微孔板中,30℃恒温避光培养10 d,每隔12 h采用酶标仪测590 nm和750 nm处吸光值。土壤细菌群落对碳源利用的能力用每孔颜色变化率表示(Average well color development,AWCD):
AWCD=∑(Ci-R)/31
式中,Ci为所测定的每孔吸光值,R为对照孔吸光值,31为Biolog-Eco平板上供试碳源数。
1.3.4 绿豆根际土壤细菌多样性测定 取不接种菌株处理下的绿豆根际土壤样品,使用土壤基因组试剂盒提取土壤总DNA,并采用1%琼脂糖凝胶电泳检测DNA质量;利用通用引物对515F(5’-GTGCCAGCMGCCGCGG-3)和907R(5’-CCGTCAATTCMTTRAGTTT-3’)对DNA进行扩增,扩增区间为V4-V5区,PCR反应条件、体系和PCR产物的纯化参照Hao等[14]的方法。将纯化后的样品采用Illumina HiSeq平台进行高通量测序(上海美吉生物医药科技有限公司)。
获得下机原始数据后,使用Trimmomatic软件质控,再采用FLASH软件进行拼接,得到优化数据后按照97%的相似性进行分类操作单元(Operational taxonomic units,OTU)聚类,用于微生物多样性分析。
1.4 数据处理与分析
数据的计算与处理采用Microsoft Excel 2007软件,采用SPSS 22.0软件对数据进行统计分析,柱形图的制作使用Origin 8.5软件。
2 结果与分析
2.1 盐碱胁迫下3株促生菌对绿豆生长的影响
由表1可以看出,单株菌S29处理下的绿豆根系鲜重较对照增加了19.27%,菌株KM1、NM8和复合菌处理下的绿豆根系鲜重分别增加了25.85%、22.93%和31.22%,根系干重分别增加了25.00%、22.73%和29.55%。可见,接种促生菌能够促进盐碱胁迫下绿豆根系的生长,复合菌促生效果比单株菌促生效果好。

表1 促生菌对绿豆植株生长的影响Table 1 Effects of PGPRs on the growth of mung bean plants
2.2 盐碱胁迫下3株促生菌对绿豆根际土壤酶活性的影响
由表2可知,所有接菌处理均能够显著提升土壤碱性磷酸酶活性和蔗糖酶活性,其活性排序分别为S29>S+N+K>NM8>KM1>CK和S+N+K>NM8>S29>KM1>CK;菌株S29及复合菌处理能够显著增加土壤脲酶活性,脲酶活性排序为S+N+K>S29>NM8>CK>KM1,其中S29处理的土壤碱性磷酸酶活性较CK增加了25.23%,复合菌处理后的土壤蔗糖酶和脲酶活性分别是CK的1.35倍和1.16倍,而所有接菌处理的过氧化氢酶活性均为下降的趋势。

表2 促生菌对绿豆根际土壤酶活性的影响Table 2 Effects of PGPRs on soil enzyme activities of mung bean rhizosphere
2.3 盐碱胁迫下3株促生菌对绿豆根际土壤细菌利用碳源的影响
2.3.1 绿豆根际土壤细菌代谢活性 对单株促生菌、复合促生菌和未接菌处理的绿豆根际土进行了Biolog-Eco测定(图1)。结果表明,随着培养时间的延长,不同处理下的土壤细菌对碳源的利用率逐渐增大。菌液处理下的土壤AWCD值均高于对照组,且KM1的AWCD值最高,最高值为1.39。培养土壤细菌前84 h,不同处理下的AWCD值增长较快,具有较高的斜率,碳源被大量利用;120 h后AWCD值增长速率降低,曲线接近于平缓,说明细菌的代谢能力有所下降。从整体来看,菌液KM1处理下的AWCD值增长最为明显,说明其土壤细菌代谢能力最强;在整个培养过程中,各处理下的AWCD值为:KM1>复合菌>S29>NM8>CK,说明菌液处理下的根际土壤细菌代谢能力较强。

图1 绿豆根际土壤细菌平均吸光值变化Fig.1 Variation of average well color development of bacteria in mung bean rhizosphere soil
2.3.2 绿豆根际土壤细菌碳源利用种类 选取培养时间为240 h的AWCD值分析不同菌液处理下的土壤微生物对6类碳源的利用情况。由图2可以看出,KM1、NM8和复合菌处理下的土壤细菌对6种碳源的利用率均高于对照组。在所有接菌处理中,施用菌液KM1后的土壤细菌对6种碳源的利用率最高,其大小顺序依次为胺类、氨基酸类、酚酸类、羧酸类、多聚物类和碳水化合物类,AWCD值分别达到了1.61、1.49、1.46、1.41、1.35和1.25;NM8和复合菌处理土壤细菌群落中的优势代谢碳源分别为酚酸类、胺类和氨基酸类,AWCD值分别1.20、1.17和1.15,1.31、1.37和1.23;S29处理对酚酸类利用率最差,但对于其他种类碳源的利用程度均高于对照组。因此,接菌处理会在一定程度提高土壤细菌对碳源的利用率。
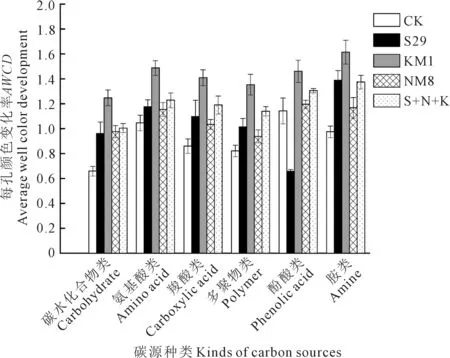
图2 绿豆根际土壤细菌对不同碳源的利用率Fig.2 Utilization ratio of different carbon sources by mung bean rhizosphere soil bacteria
2.4 盐碱胁迫下3株促生菌对绿豆根际土壤细菌多样性及群落结构的影响
2.4.1 绿豆根际土壤细菌Alpha多样性和OTU 通过采用Illumina HiSeq平台对不同接种处理下的绿豆根际土DNA进行测序,其覆盖率均大于97%,说明测序结果足够反应样本的真实情况,存在遗漏的可能性较小。表3为测序土壤样品Alpha多样性指数结果,其中菌株S29、NM8、KM1以及复合菌处理的土壤Shannon指数均显著高于对照土壤,Simpson指数则呈现相反的结果,说明接种不同的耐盐碱促生菌能够提高盐碱胁迫下绿豆根际土壤的细菌多样性;除此之外,4种接菌处理下的土壤的Chao1也得到了显著提升,表明促生菌可以提高土壤细菌的物种丰富度。

表3 细菌群落Alpha多样性指数Table 3 Alpha diversity index of bacterial community
2.4.2 绿豆根际土壤群落组成 细菌门水平的相对丰度如图3所示,在S29、KM1、NM8和S+N+K组土壤样品中,放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的相对丰度均小于其对照组,且3个菌门在复合菌处理的土壤中相对丰度最低,分别为16.16%、11.12%和3.82%;另外6个菌门在接菌处理土壤中的相对丰度均高于对照土壤,变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、绿弯菌门(Chloroflexi)、芽单胞菌门(Gemmatimonadetes)和蓝细菌门(Cyanobacteria)在S+N+K组土壤中的相对丰度较高,分别为42.67%、11.05%、5.93%、2.90%和1.07%。

图3 绿豆根际土壤门水平的细菌群落组成Fig.3 Bacterial community composition of mung bean rhizosphcre soil in phylum level
属水平上来看,不同处理间属水平的细菌组成差异明显。其中卓贝尔氏菌属(Zobellella)在CK、KM1和NM8组的相对丰度为0,未被检测到,在S29和S+N+K中相对丰度分别为2.51%和7.51%。同时沙雷氏菌属(Serratia)仅存在于菌株KM1和复合菌处理的土壤中,相对丰度分别为1.36%和0.19%。此外,在4种接菌处理的土壤中,norank_c__Acidobacteria、norank_f__Anaerolineaceae、norank_f__MSB-1E8、Nocardioides、norank_o__JG30-KF-CM45、norank_f__Gemmatimonadaceae、Altererythrobacter和Marmoricola的相对丰度均高于CK。
2.4.3 绿豆根际土壤细菌Beta多样性 对OTU数据进行PCA分析(Principal component analysis),即主成分分析,结果如图5所示。同一处理的3个样本距离较近,重复性较好,且5个处理间有一定距离,表明样本间存在一定差异。主成分1(PC1)和主成分2(PC2)的贡献率分别为58.99%和18.68%,S+N+K组和S29组沿主成分1与NM8、KM1、CK组明显区分,且NM8和KM1组沿主成分2与CK、S+N+K组明显区分,表明组间微生物差异较大,而NM8组与KM1组距离不明显,微生物差异较小。

图5 绿豆根际土壤细菌菌群主成分分析Fig.5 Principal component analysis of soil bacterial flora in mung bean rhizosphere
3 讨 论
目前利用PGPR促进植物生长已成为当下的研究热点,然而单株菌在促生功能和环境适应上存在一定的局限性,因此将具有不同促生功能的菌株复合施用是当下提高其稳定性的重要手段[15]。刘冠一等[16]研究发现盐碱胁迫下,复合菌对苜蓿的促生作用明显优于单株菌。花生的盆栽试验中,接种复合菌后花生的株高和鲜重较对照增加了37.60%和63.90%,土壤养分含量也得到显著提高[17]。在本试验中,在盐碱土中接菌处理下绿豆根系鲜重和干重得到显著提高,且复合菌处理下促生效果更明显,反映了不同促生菌的共同施用能够相互协同促进植物的生长。

图4 绿豆根际土壤属水平的细菌群落组成Fig.4 Bacterial community composition of mung bean rhizosphere soil in genus level
土壤酶作为植物与养分之间的纽带,既能客观地反映土壤的肥力情况,又能间接地影响土壤中营养元素的循环[18-19],其活性受微生物数量和种类影响较大,同时也是衡量土壤微生物功能多样性的指标[20]。在本试验中,接菌处理后的绿豆根际土壤的碱性磷酸酶和蔗糖酶活性均高于对照;其中菌株S29、NM8和复合菌能够增加土壤脲酶活性,且复合菌处理对土壤脲酶和蔗糖酶的提高比例高于单株菌。这是因为促生菌的施用一方面能够加快土壤中有机物分解速度,为酶促反应提供底物,另一方面充足的碳源和氮源促进了微生物的生长繁殖,其代谢产物是土壤酶的重要组成[21]。过氧化氢酶能够分解对植物有毒害作用的过氧化氢,在土壤和生物体中分布广泛。试验中所有促生单菌或复合菌处理后,土壤过氧化氢酶都有下降的趋势,这可能由于施用促生菌后土壤微生态环境发生了变化,盐碱胁迫得以缓解,对植物有害的过氧化氢含量有所减少。总体来看,耐盐碱促生菌的施用提高了盐碱胁迫下绿豆根际土壤酶活性,对改良盐碱土壤有一定作用。
Biolog-Eco平板法能够评价土壤微生物群落结构并获得大量功能多样性方面的信息[22]。施用微生物菌剂能够使土壤微生物功能发生改变,形成不同代谢类型的土壤微生物种群,进而改变土壤微生物群落结构[23]。本试验测定了240 h内不同接种处理下的土壤细菌对碳源的利用情况,菌株KM1、NM8和复合菌处理能够增强其土壤细菌对六大碳源的利用率,其他研究也得到了相似的结果[24-25]。值得注意的是,菌株S29处理后,土壤细菌对酚酸类碳源的利用能力有所下降,其原因可能是不同菌株的施用影响了根系分泌物的数量和种类[22],其与微生物之间的相互作用形成了差异性的效应。因此,探究接种不同促生菌对绿豆根际分泌物的影响将是今后研究的重要内容。
高通量测序技术能够更加全面地揭示土壤微生物群落结构的复杂性和多样性[26]。研究结果表明,所有接菌处理下的Shannon和Chao1指数高于对照,Simpson指数呈现相反的结果,说明接种促生菌能够提高绿豆根际土壤细菌多样性和丰富度。在一定范围内,酸杆菌门的相对丰度与pH值成反比[27],酸杆菌门在所有接菌处理的土壤中相对丰度均有所增加,猜想可能是促生菌的施用降低了盐碱土的pH值,土壤环境更加适合酸杆菌的生长。虽然门水平上的接菌处理优势细菌组成与对照组基本相同,但变形菌门、芽单胞菌门和蓝细菌门等有益菌[28-29]的相对丰度在接菌处理组中表现为增加,复合菌处理表现得尤为明显。卓贝尔氏菌和沙雷氏菌分别存在于菌株S29、KM1和复合菌处理的土壤中,芽孢杆菌在所有土壤中均被检测到,表明试验所施用的菌株均能够在盐碱条件下生存且在绿豆根际定殖。因此,试验中接种的耐盐碱促生菌能够调节绿豆根际土壤细菌群落结构,增加土壤中有益菌的相对丰度,从而间接地促进绿豆生长。
4 结 论
研究结果表明,盐碱胁迫下,促生菌能够显著增加根系鲜重和干重,复合菌促生效果更明显。所有接菌处理均能够提高土壤碱性磷酸酶和蔗糖酶活性,并增加绿豆根际土壤细菌对碳源的利用能力、土壤细菌多样性和物种丰富度并促进有益菌的生长,说明促生菌的施用明显改善了绿豆根际微生态,缓解了盐碱胁迫对于绿豆生长的不利影响。
