TVS和CEUS诊断子宫内膜良恶性病变的价值
2022-01-27关义满刘雅宁李德鑫常雅丽
关义满,刘雅宁,张 钗,李德鑫,常雅丽*
1.河北医科大学第三医院,河北 石家庄 050000;2.河北省深州市医院,河北 深州 053800
子宫内膜癌是主要子宫内膜恶性病变。子宫内膜癌临床分期主要以Ⅰ期和Ⅱ期为主,5年生存率可达90%左右,因此子宫内膜癌的早期诊断对改善患者预后具有重要意义。但有研究[1]提示子宫内膜肿瘤的良性和恶性具有较多相似性,临床区分较为困难。经阴道超声检查(transvaginal ultrasonography,TVS)可清晰观察子宫结构变化,无需开刀,属于无创检查,受外界干扰小、无需进行膀胱充盈、结构准确、具有较快的检测速度且可重复多次检查,以期成为检查临床子宫内膜疾病的主要方法[2]。超声造影(contrast-enhanced ultrasound,CEUS)可通过造影剂在组织血管内的灌注情况并对目标区域血管灌注情况动态观察,对肝癌、乳腺癌、甲状腺癌等肿瘤组织的灵敏度和特异度均较高,有利于判定肿瘤性质[3]。因此,本研究对TVS和CEUS鉴别子宫内膜良恶性病变的临床价值进行了探讨,旨在为子宫内膜癌的良恶性鉴别提供数据参考。
1 资料与方法
1.1 一般资料
选取2018年6月至2021年8月在我院就诊的子宫内膜病变患者108例,年龄28~70岁,平均年龄(48.80±10.11)岁。纳入标准:病理学确诊;在我院行TVS、CEUS检查;临床资料完整。排除标准:合并有其他系统恶性肿瘤、急慢性感染、血液系统疾病、免疫系统疾病等;有盆腔手术治疗史。本次研究获得医院伦理委员会批准,患者及家属知情同意。经病理学检查,恶性病变60例(子宫内膜癌),良性病变48例。良性病变中:子宫内膜息肉23例,子宫内膜增殖症13例,囊性萎缩性子宫内膜7例,子宫黏膜下肌瘤5例。恶性病变患者和良性病变患者年龄、体质量指数、高血压、糖尿病、空腹血糖、血压及产次等比较,无统计学意义(P>0.05)。
1.2 方法
(1)TVS和CEUS检查。使用彩色多普勒超声诊断仪(型号VOLUSON-E8,美国GE公司),探头频率为5~9 MHz,探头型号为RIC5-9-D。TVS检查患者平卧位,超声探头经阴道置入对子宫形态、大小及病变位置和形态进行探查,观察病变组织内部回声、血流状态以子宫肌层与周围组织的毗邻关系,计算阻力指数(RI)、达峰时间(TTP)和峰值强度(Peak)。CEUS检查以六氟化硫微泡为造影剂(瑞士博莱科信宜药业公司生产),造影剂与5 mL生理盐水充分混合后制成浓度为5 mg/mL的悬浮液,经肘部浅静脉注入,屏气深呼吸,不同角度观察病灶,尤其是病灶直径、位置、回声及形态等,观察不同分化程度病灶的增强时间及增强特征,将全程动态图像进行存储。造影结束后观察不同分化程度病灶的增强时间及增强特征,计算RI、TTP和Peak,以及曲线下面积(AUC)、平均渡越时间(MTT)。
(2)分期。Ⅰa期指肿瘤无浸润或浸润肌层深度小于1/2。Ⅰb期指肿瘤浸润肌层深度大于等于1/2。Ⅱ期指肿瘤浸润宫颈间质,但未超出子宫外。Ⅲ期局部和(或)区域扩散。Ⅳ期指肿瘤侵犯膀胱和(或)直肠黏膜和(或)远处转移[4]。
1.3 统计学处理
2 结果
2.1 TVS、CEUS鉴别子宫内膜良恶性病变的价值
CEUS诊断子宫内膜良恶性病变的灵敏性、准确性和阴性预测值明显高于TVS检查(P<0.05)。见表1。
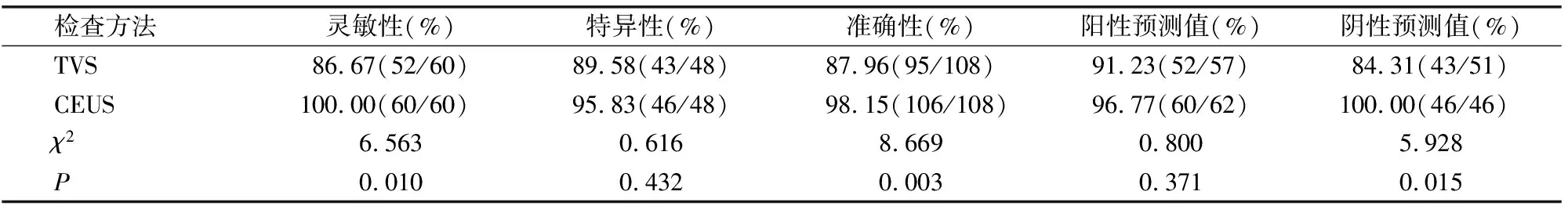
表1 TVS、CEUS鉴别子宫内膜良恶性病变的价值
2.2 子宫内膜良恶性病变RI、Peak、TTP等参数比较
恶性病变RI和TTP明显低于良性病变(P<0.05),Peak明显高于良性病变(P<0.05)。见表2。
2.3 不同年龄、病理分期恶性病变RI、Peak、TTP等参数比较
<50岁或≥50岁恶性病变患者RI、Peak、TTP、AUC及MTT差异比较无统计学意义(P>0.05);Ⅲ~Ⅳ期RI和TTP明显低于Ⅰ~Ⅱ期(P<0.05),而Peak明显高于Ⅰ~Ⅱ期(P<0.05)。见表3。
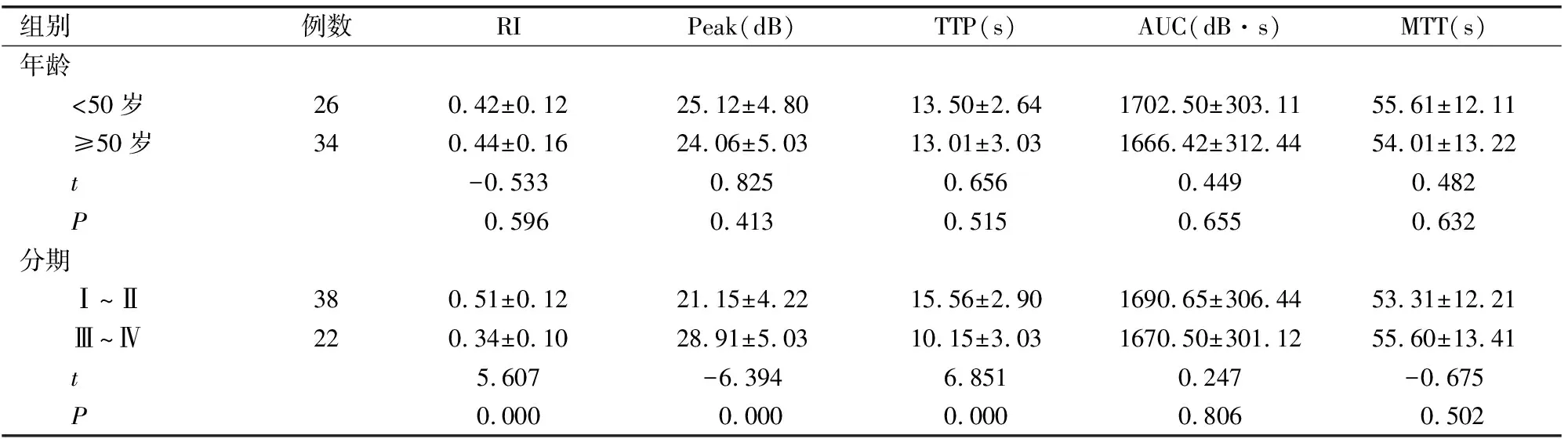
表3 不同年龄子宫内膜恶性病变RI、Peak、TTP等参数比较
2.4 RI、Peak和TTP鉴别诊断价值
RI、Peak和TTP诊断子宫内膜恶性病变的ROC曲线下面积分别为0.740、0.789和0.856(P<0.05)。见表4和图1。
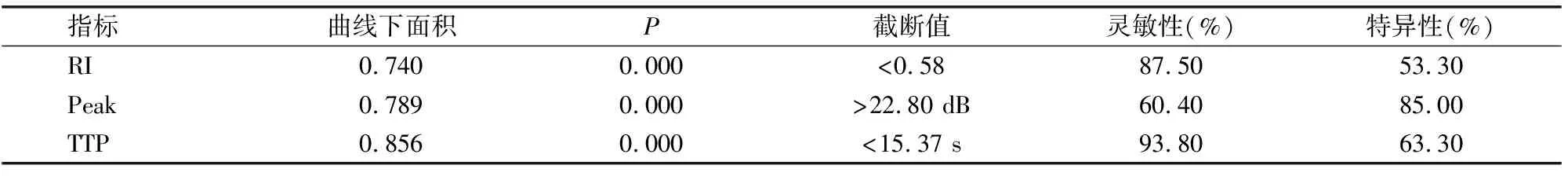
表4 ROC曲线参数
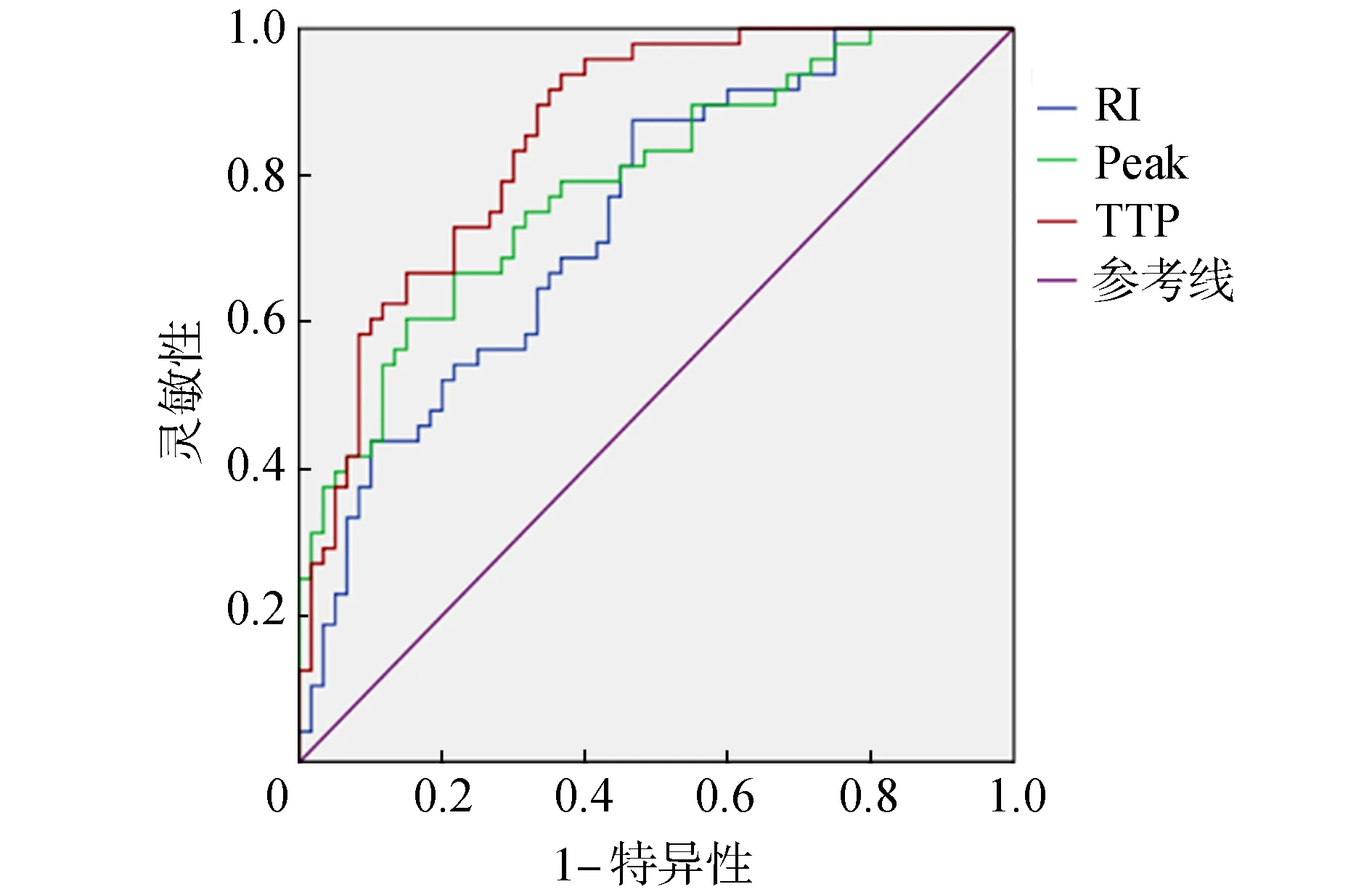
图1 ROC曲线图
3 讨论
CEUS属于一类对比增强超声检查方法,通过造影剂的静脉注射有助于提高病变组织的微循环血流显像能力,进而动态、清晰地观察病变组织的内部血流灌注变化情况,为临床诊断提供准确、科学的数据参考[5]。但相关研究[6,7]提示经阴道超声仅通过形态学诊断的临床价值有限,无法有效反映病变组织的微循环灌注情况。
本研究结果显示,CEUS诊断子宫内膜良恶性病变的灵敏性、准确性和阴性预测值明显高于TVS检查。子宫内膜恶性病变病灶血管具有走行迂曲、异常增生和血管管径粗细不均等表现肿瘤新生血管普遍特点,而且血管无逐渐变细过程,管壁普遍较薄且血管壁平滑肌细胞及弹力纤维数量较少,甚至部分血管段只有一层内部细胞,通过造影剂注射后,子宫内膜癌组织的CEUS图像可变现为显著异常早期增强,病灶周边迅速变为整体增强;达到增强达峰后造影剂边缘多不整齐且分布欠均匀,增强晚期呈现显著低增强,还可见未受累肌层与病灶间的明显界限,进而有效鉴别子宫内膜恶性肿瘤;此外,肿瘤组织由于特殊的肿瘤新生血管特点浸润时间短,病灶局部无显著形态结构变化,而经阴道超声检查对该区域无法显示,故CEUS诊断子宫内膜良恶性病变的灵敏性、准确性和阴性预测值明显高于TVS检查。
分析认为,TVS诊断子宫内膜病还需注意以下两点:(1)注意鉴别黏膜下肌瘤及子宫内膜息肉,黏膜下肌瘤处于宫腔低回声区且基底膜中断,主要呈圆形;而子宫内膜息肉处于宫腔内高回声区且基底膜连续,呈椭圆形。(2)部分患者子宫内膜分泌紊乱或过分分泌可增加局部子宫内膜厚度,混淆子宫息肉。因此,需要尽可能选取月经后增殖早期进行检查。
RI代表恶性病变阻力指数、TTP代表达峰时间、Peak代表达峰时间的峰值强度,均是超声显像的重要指标[8]。CEUS能够有效获取病灶组织的关键造影参数进而分泌病灶的血流灌注特点,通过量化指标分析不同时间段病灶与周围正常肌层的灌注特点[9,10]。本研究发现,恶性病变Peak明显高于良性病变,RI和TTP明显低于良性病变,进一步对恶性病变患者的影像学参数比较发现Ⅲ~Ⅳ期RI和TTP明显低于Ⅰ~Ⅱ期,而Peak明显高于Ⅰ~Ⅱ期。CEUS依靠实时双幅造影对比成像技术及微血管成像造影技术观察和监测病灶,再辅以造影定量软件对微血管密度进行分析观察,进而观察目标造影显像结果更加清晰,有助于获得更加精准的影像学指标,还可依靠影像学参数鉴别恶性病变的发展阶段,为提高临床诊断准确率提供数据。RI、Peak和TTP诊断子宫内膜恶性病变具有良好的灵敏性和特异性。超声造影剂无法通过血管内皮屏障至组织间隙,但可有效穿过肺毛细血管床,对病变组织中血管分布动态显示,有效提高对微细血管、深部组织、肿瘤新生血管的检查特异度和灵敏度,提高子宫内膜疾病的诊断和鉴别的精准度[11,12]。
既往临床试验主要分析了子宫内膜病变的诊断方法,但对肿瘤的良恶性的影像参数还需进一步详细分析。本研究通过TVS及CEUS对子宫内膜良恶性的鉴别结果进行相关分析,发现相较于TVS,CEUS鉴别诊断子宫内膜良恶性疾病有较好的价值,并提出了进一步的研究方向,具有一定的临床价值和创新性。
