超声联合计算机在晚期恶性梗阻性黄疸治疗中的应用
2022-01-27韩东亮刘昭明
韩东亮,李 广,姚 皓,刘昭明
1.衡水市人民医院科教处,河北 衡水 053000;2.衡水市人民医院肝胆外科,河北 衡水 053000
恶性胆道阻塞(malignant biliary obstruction,MBO)是在压迫或恶性肿瘤转移下,造成患者胆管变窄,使得胆汁排泄受阻,其常见的临床症状为体重下降、尿黄、呕吐、腹胀、全身皮肤和巩膜黄染加重等,严重时部分患者甚至出现脓毒血症、凝血障碍、肝肾衰竭等,直至死亡[1,2]。学者专家将MBO常见病因划分为胆管内癌性栓子堵塞管腔、胆管癌、壶腹癌等[3]。临床研究显示,恶性胆道阻塞发生原因是患者体内分泌的胆汁不能及时排出体外,导致胆汁中胆红素反流,进入血液中形成高胆红素,进而损伤患者肝细胞、血管内皮、破坏免疫系统[4-6]。
恶性阻塞性黄疸确诊较为困难,目前还是以影像学检查、实验室肝功能检查、血清肿瘤标志物和胆红素等为主要依据[7]。影像学检查主要是检查患者胆管性质,如有无发生淋巴结肿大或转移,胆管狭窄部位扩增程度等[8]。影像学检查手段主要有磁共振胰胆管成像、内镜下逆行胰胆管造影、磁共振成像(MRI)、计算机断层扫描术(CT)、彩超等[9]。研究发现,彩超操作简便,但是对于早期患者容易出现漏诊;与CT和彩超相比,超声内镜诊断率显著提高[10];与其他影像学技术相比,CT对恶性阻塞性黄疸准确率高达80%~97%[11];磁共振成像能够准确诊断患者梗阻部位扩张程度,并且能够同时显示胆管周围及胆管自身情况[12]。近年来,有学者专家报道指出,磁共振成像技术可以与磁共振胰胆管成像结合使用,大大提高准确率[13];内镜下逆行胰胆管造影技术不仅可以通过造影显示患者胆管及其周围情况,还可以对患者胆管组织及细胞进行检验[14]。本研究旨在评价常规超声、超声造影联合计算机辅助在晚期恶性梗阻性黄疸手术治疗中的应用。
1 资料与方法
1.1 一般资料
选取2019年1月至2020年6月于本院住院部经专家会诊后判定为晚期恶性梗阻性黄疸患者54例,分为内镜下逆行胰胆管造影术(endoscopic retrograde cholangiopancreatography,ERCP)组18例、经皮经肝穿刺胆道引流术(percutaneous transhepatic biliary drainage,PTCD)组22例、超声内镜引导下胆道引流术(endoscopic ultrasound-guided biliary drainage,EUS-BD)组14例。ERCP、PTCD、EUS-BD三组患者年龄和性别差异无统计学意义(P>0.05),具有可比性。研究受试者自愿签署知情同意书,并得到我院伦理委员会同意。纳入标准:患者年龄大于或等于45岁;具有典型性晚期恶性阻塞性黄疸的症状之一;实验室检测异常;影像学检查异常,如磁共振成像、CT或腹部超声等检查证实为恶性肿瘤;国际公认的TNM肿瘤分期T3期及以上患者。排除标准:既往接受过内镜下逆行胰胆管造影、经皮经肝穿刺胆道引流术、超声内镜等治疗患者;其他因素导致的黄疸,如胆管周围病变压迫、胆管炎症、胆系结石等;住院期间因出现多器官衰竭死亡的病例;进行多次治疗失败后改用其他治疗方案。
1.2 实验方法
1.2.1ERCP组手术操作[15]
术前准备:患者在进行手术前,完善血清相关检测指标,如血型、术前四项、凝血功能、生化指标、肿瘤标志物、肝肾功能、血常规等;进行影像学检查,如增强CT、磁共振成像、腹部CT等对患者梗阻部位、性质、转移等情况进行检查;术前给予患者营养支持、抑酸补液、改善凝血功能、纠正电解质等;术前30 min内禁止饮食饮水,纳肛100 mg吲哚美辛栓。所有受试者在术前均需自愿签订知情同意书。
手术过程:患者采取仰卧位,常规进行心电图(electrocardiogram,ECG)检测、开通静脉通路、吸氧;十二指肠镜按照顺序通过患者口腔、食管、胃,到达十二指肠降段后,寻找其乳头开口,如乳头部位出现梗阻或胆管中上端部位出现梗阻,则保留乳头,反之则将乳头切开,选择性插管;插管成功后,推入造影剂,在X线下观察患者胆管梗阻情况。术中给予100 mg盐酸哌替啶针、100 mg地西泮针、10 mg 654-2针。
1.2.2PTCD组手术操作[16]
术前准备同ERCP组。手术过程:根据术前检查选择合适的穿刺点;患者采取平躺姿势,常规进行ECG检测、开通静脉通路、吸氧;消毒后铺上无菌洞巾,使用多卡因针缓慢逐层浸润麻醉,同时穿刺针沿着患者麻醉点缓慢穿刺到达肝管,在X线下进一步引入导丝、扩张,在导丝引导下进入引流导管,打通患者梗阻部位到达十二指肠,同时在导丝的引导下将内外引流管送入十二指肠并固定。
1.2.3EUS-BD组手术操作[17]
术前准备同ERCP组。手术过程:患者采取仰卧位,常规进行ECG检测、开通静脉通路、吸氧;十二指肠镜按照顺序通过患者口腔、食管、胃,到达十二指肠,同时在超声、血流多普勒、计算机辅助手段联合下实时观察十二指肠与胆管或胆管与胃壁的关系,根据胆管及其周围神经和血管状态,选择合适的穿刺点,穿刺成功后,拔出针芯,回抽过程中则可以见到胆汁。胆汁经过穿刺针进入导丝后,使得导丝盘曲于患者胆管内。
术后均禁水禁食,鼻吸氧、心电监护,并密切关注患者出血情况、消化道穿孔、腹痛等并发症发生,同时给予保肝、抗炎等处理,并检查患者肝肾功能和血液常规等指标。
1.3 观察指标
收集三组患者术前及术后7天并发症、手术成功率、术后疗效、肝功能指标及平均住院天数等相关资料。本研究中,术后疗效包括腹痛、皮肤瘙痒、尿黄、巩膜或皮肤黄染等;并发症包括胆漏、导管滑脱、发热、腹痛、胰腺炎等;肝功能指标包括谷丙转氨酶、血清总胆红素、碱性磷酸酶。
1.4 统计学分析
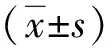
2 结果
2.1 手术结果
3组54例患者分别接受手术治疗,所有手术均治疗成功。ERCP组治疗患者18例,共放入16枚全覆膜金属支架和2枚8.5F塑料支架;22例患者进行PTCD引流,其中2例患者因外置引流管滑落后再行一次PTCD治疗;14例患者进行EUS-BD治疗,置入14枚全覆膜金属支架。
2.2 肝功能变化
2.2.1谷丙转氨酶变化情况
如图1所示,三组患者术后谷丙转氨酶均较术前显著下降(图中**表示与本组术前相比,P<0.01);三组患者术后谷丙转氨酶组间比较无显著差异(P>0.05)。
2.2.2血清总胆红素变化情况
如图2所示,三组患者术后血清总胆红素均较术前显著下降(图中**表示与本组术前相比,P<0.01);三组患者术后血清总胆红素组间比较无显著差异(P>0.05)。
2.2.3碱性磷酸酶变化情况
如图3所示,三组患者术后碱性磷酸酶均较术前显著下降(图中**表示与本组术前相比,P<0.01);三组患者术后碱性磷酸酶组间比较无显著差异(P>0.05)。
2.3 术后并发症比较
如表1所示,与ERCP组和PTCD组相比,EUS-BD组术后并发症显著下降(P<0.05)。
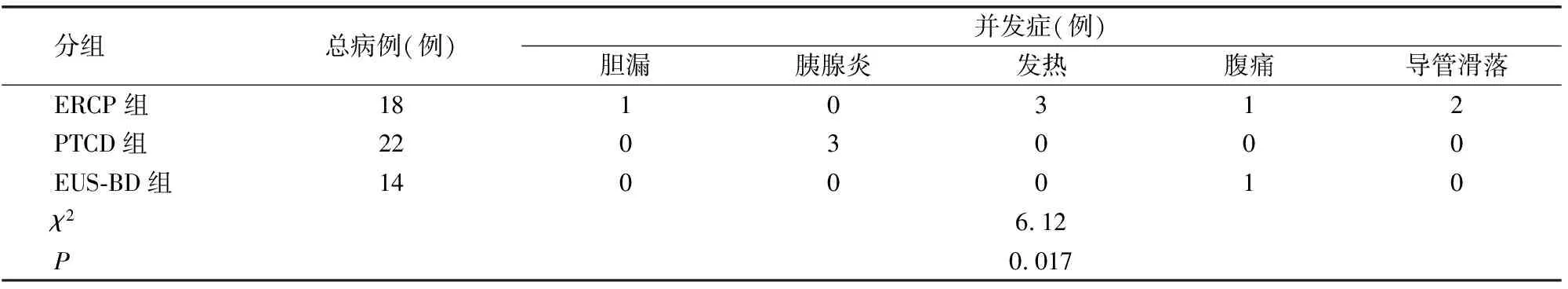
表1 术后并发症比较
2.4 住院天数比较
如表2所示,EUS-BD组患者住院天数显著短于其他两组(P<0.05)。
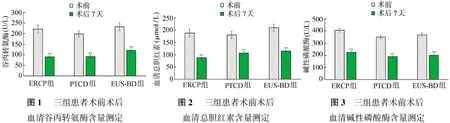
图1 三组患者术前术后血清谷丙转氨酶含量测定图2 三组患者术前术后血清总胆红素含量测定 图3 三组患者术前术后血清碱性磷酸酶含量测定

表2 住院天数比较
2.5 病理分析
与PTCD组(图4)相比,ERCP组和EUS-BD组患者胆汁引流避免了电解质失衡对导管造成的伤害。

图4 PTCD组胆管超声
3 讨论
随着环境变化与社会发展,恶性黄疸发病率呈现逐渐增加的趋势。然而其发病率存在隐蔽性,多数患者出现症状或确诊时已经是晚期,丧失了手术机会[18]。如若及时采取有效干预,可以明显延长患者生存周期[19]。数据显示,传统外科手术切除率仅为20%左右,且有较高的病死率[20]。近年来,随着影像学技术的发展,除了采用传统胆道引流法外,还发展出多种内科微创保守治疗法。本研究中,笔者对超声联合计算机辅助下治疗晚期恶性梗阻性黄疸ERCP、PTCD及EUS-BD三种手术方法进行了比较,并分析了其术后疗效及并发症等发生情况。
ERCP是指通过十二指肠降部肠镜检查患者十二指肠乳头,并将造影剂注入乳头,X线片显示胰胆管的技术[21]。与传统手术相比,该术有安全、创伤小、恢复快等优点。本研究中,ERCP、PTCD及EUS-BD三种手术后,病理分析显示ERCP组恶性黄疸患者胆汁引流避免了电解质失衡对导管造成的伤害,该研究结果与前人研究一致,即ERCP法安全性好。PTCD是治疗恶性黄疸的另一种方式,效率高、操作简单,但该术容易引起胆漏、感染、出血等并发症[22]。本研究中发现PTCD组患者并发症、住院时间等均高于其他两组,该结果与前人研究一致,即PTCD术并发症多。EUS-BD是指在超声内镜的指引下,将自膨式金属支架置于患者胆道与消化道之间,并将患者胆汁引流至十二指肠或胃中,进而降低黄疸[23],与其他方法相比,该法具有操作简单、安全可靠、预后性好、并发症少等优点,本研究得到同样结论。与ERCP组、PTCD组相比,EUS-BD组治疗黄疸效果显著,并发症少、住院时间短,且胆汁引流伤害最小。总之,本研究发现患者采用常规超声联合计算机辅助技术,比ERCP组超声造影及PTCD组常规超声更具备优势。
