基于SPECT和PET的免疫成像技术研究进展
2022-01-27张莉莉
张莉莉,向 韡,刘 超*,刘 刚*
1.广西医科大学广西生物医药协同创新中心,广西组织器官修复医用生物材料工程技术研究中心,广西南宁 530021;2.厦门大学公共卫生学院 分子影像暨转化医学研究中心,福建厦门 361102
利用免疫学方法对疾病进行诊断与治疗已成为一种有效的临床策略。机体免疫系统极其复杂,特别是其发挥功能时呈现动态多样性。分子影像技术为无创监测体内免疫过程提供了很多独特优势,有益于各种疾病的诊断与治疗。例如,癌症、自身免疫性疾病、炎症性疾病、感染或败血症等,均可利用免疫成像技术通过靶向特定细胞类型、生物标志物或炎症功能分子来实时监测相关疾病的发生发展、治疗反应及演进转归。
目前,用于免疫监测的临床成像技术主要有正电子发射断层成像(PET)和单光子发射计算机体层摄影(SPECT)。基于SPECT和PET的分子成像技术能够对全身进行无创可视化,其分子显像剂通常采用放射性同位素标记抗体、细胞因子和受体/配体等功能分子,这些显像剂的摄取可以量化,可对检测目标进行动态示踪[1]。SPECT和PET分子成像技术用于临床免疫监测的需求日益增长,加之与其他成像方法联合的多模态成像技术,例如与计算机断层扫描(CT)、光学成像(OI)、磁共振成像(MRI)联合,成为了当前监测体内免疫系统动态的主流技术[2-8]。根据具体关联环境选择免疫成像方式可望取得更有利于临床评估的成像效果。
先进的分子影像技术在一定程度上可实现免疫细胞、免疫活性物质的精准定位及功能监测,并发展了一系列多学科交叉融合的创新分子影像标记技术和方法,例如,在注射前,使用显像剂直接标记免疫制剂(包括细胞、细胞因子、肽);通过报道基因转导技术标记靶细胞;使用基于抗体的示踪剂靶向细胞表面标记物、免疫检查点、细胞分泌产物,可以识别特定免疫细胞群的定位及功能。本文综述了使用直接标记技术、酶报道基因技术、基于抗体标记技术等方法的SPECT和PET免疫成像技术的研究进展,对当前免疫分子影像学技术的局限性进行了探讨,并对未来免疫成像新技术的发展和应用进行了展望。
1 直接标记示踪技术
放射性标签在体外与细胞孵育时,能够主动与细胞结合或被细胞摄取,在过继性细胞疗法(ACT)中,可直接标记细胞后注射到人体,通过扫描成像示踪细胞;亦可使用放射性标签标记细胞因子、配体,可直接注射到体内后与体内表达相关受体的细胞结合,通过成像检测细胞定位或细胞表面物质的表达情况(图1)。
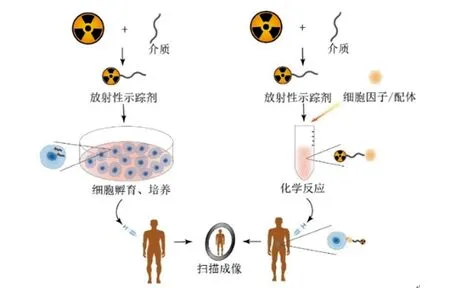
图1 直接标记示踪技术
1.1 标记细胞
在免疫疗法中,免疫细胞在体内的准确定位、功能状态以及治疗反应的实时监控对于疗效的评估及治疗方案优化至关重要。FDA生物制剂评估和研究中心的细胞、组织和基因治疗咨询委员会不断发布声明,应鼓励和资助用于跟踪体内细胞的非侵入性成像技术及其标记技术的开发[9]。
对于过继性细胞疗法(ACT),使用放射性核素直接标记过继性细胞是一种追踪其体内迁移和存活的直接方法。111In是一种常用的放射性核素[10],因其半衰期长和标记程序简单而常用于人类淋巴细胞的标记和成像。Malviya等[11]研究显示使用111In-oxine标记小鼠NK细胞的技术可行性。Stanton等[2]的一项临床研究也表明了使用111In标记T细胞的有效性,即标记并输注后不会影响T细胞的活力及其分泌细胞因子的功能。在该研究中给患者输注标记的抗HER2特异性T细胞后,同时使用SPECT/PET-CT成像监测到T细胞迁移至肿瘤转移部位并浸润(图2),表明了该技术是追踪嵌合抗原受体T细胞(CAR-T)的有效方式[2]。采用111In-oxine标记细胞进行长期示踪已成为金标准方案,但除了111In-oxine,用于改进免疫成像的其他放射性示踪剂也在不断研发,如99mTc、89Zr、68Ga、64Cu和18F[12]。89Zr-oxine标记方法已在大量临床前细胞示踪动物模型中得到成功验证,新近研究使用89Zr-oxine标记了从10名患者中分离的白细胞,在体外评估了标记效率、细胞活力、趋化性和DNA损伤,与111In-oxine进行了比较,结果表明了89Zr标记后,细胞内保留量和细胞活力与111In相当,有望促进使用PET跟踪89Zr-oxine标记细胞的临床转化应用研究[13]。Wang等[12]研究了68Ga-oxine标记CAR-T后利用PET进行体内跟踪的可行性,结果表明了与89Zr-oxine相似,68Ga-oxine可直接用于活细胞标记。此外,研究显示68Ga和64Cu制备示踪剂用于标记红细胞(RBC)和白细胞(WBC),可与111In示踪剂相媲美[14]。
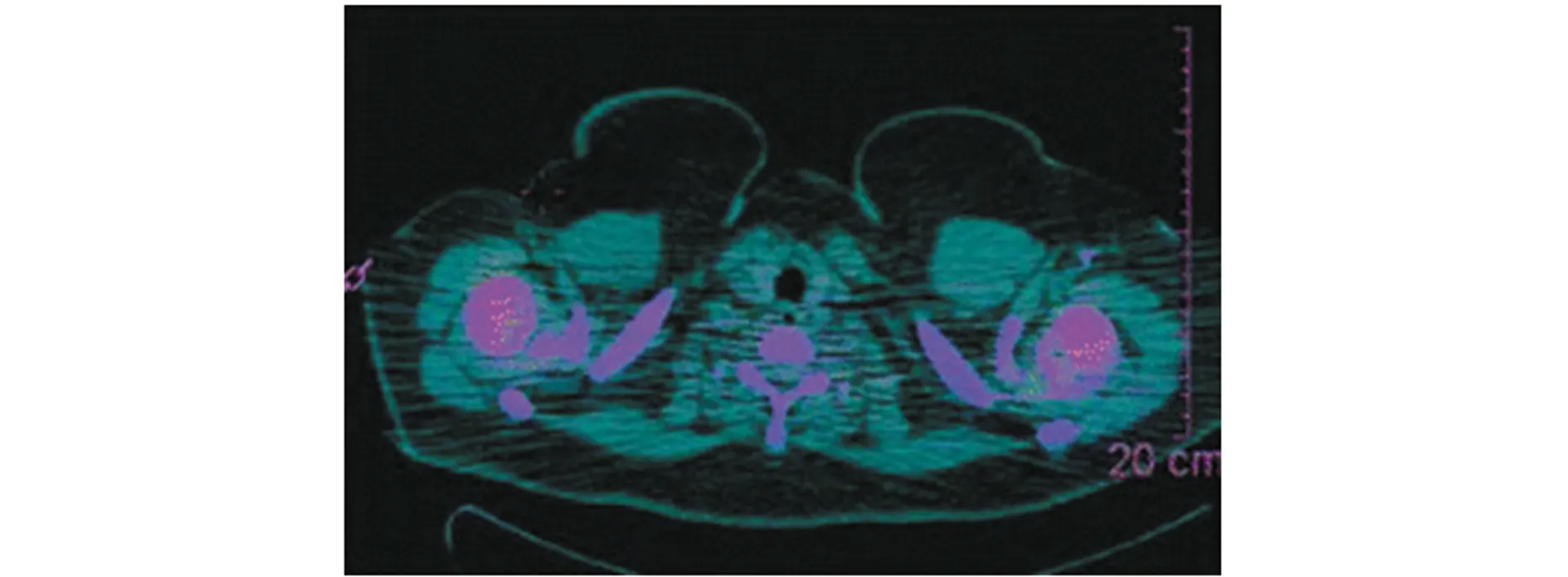
图2 注射111In标记的T细胞24 h后的SPECT/CT融合
除了NK细胞和T细胞,在体内追踪树突状细胞(DCs)的迁移将有助于免疫治疗方案的优化实施。目前有大量研究利用DCs的吞噬特性,使用超顺磁氧化铁纳米粒子(SPIONs)对其进行标记,并通过MRI进行示踪监测,然而氧化铁纳米颗粒易引起氧化应激反应,可能会影响DCs细胞功能[15,16]。亦有研究利用免疫细胞的激活会增强葡萄糖摄取原理,使用示踪剂18F-氟脱氧葡萄糖(18F-FDG)对DCs进行放射性标记后注射到小鼠体内,可通过PET/CT观察到DCs在体内的迁移[17]。
1.2 标记细胞因子及配体
白细胞介素(IL)在调节免疫应答的过程中起重要作用。目前,使用放射性核素直接标记各种IL,通过成像技术监测各种炎症、自身免疫性疾病、癌症中的免疫反应已有广泛的研究。例如,白细胞介素-2(IL-2)是一种对T细胞生存和功能至关重要的细胞因子,其受体IL-2Rs在活化的T细胞中高表达,研究显示,18F标记IL-2可通过PET成像检测到小鼠结肠癌模型中CD25+肿瘤浸润淋巴细胞[18](图3)。最近,18F-FB-IL-2被用作T细胞显像的PET示踪剂,但其生产比较复杂和耗时,因此研发了2种放射性标记IL-2的衍生物,即18F-AlF-RESCA-IL-2和68Ga-Ga-NODAGA-IL-2,并且与18F-FB-IL-2进行了体外和体内特性的比较。该研究表明18F-AlF-RESCA-IL-2和68Ga-Ga-NODAGA-IL-2的生产比18F-FB-IL-2更为简单高效,两种示踪剂在体内外实验中均表现良好,在淋巴组织和人外周血单个核细胞(hPBMC)异种移植中具有较高的摄取率[19]。放射性标记IL-2的免疫成像也用于炎症疾病的诊断、移植排斥反应。例如,使用99mTc标记IL-2,在不同类型糖尿病患者中,通过SPECT和MRI联合检测能够更准确地对炎症部位进行定位,以区分低T细胞浸润的2型糖尿病与自身免疫性1型糖尿病[7]。使用99mTc标记IL-2的SPECT/CT也已经在肺移植患者中测试了移植后的急性同种异体移植排斥反应[3]。
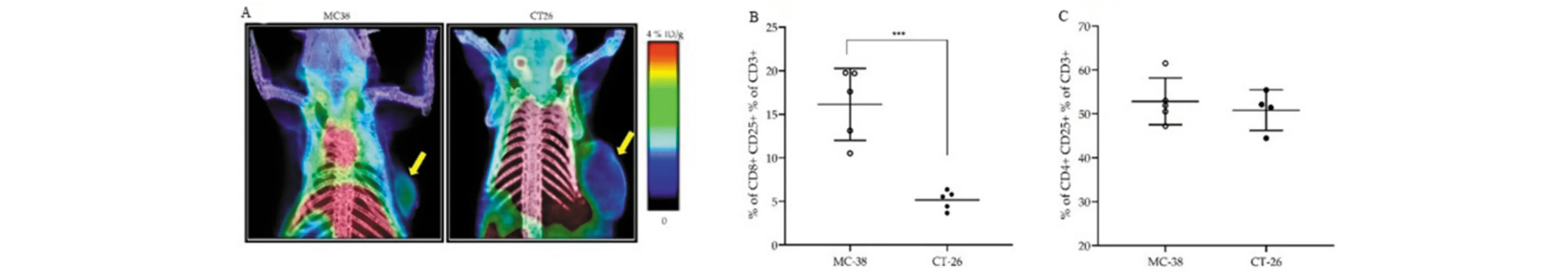
图3 (A)MC38和CT26小鼠PET-CT图像显示18F-FB-IL-2的分布;(B)MC38和CT26肿瘤中CD8+CD25+细胞占CD3+细胞的百分比;(C)MC38和CT26肿瘤中CD4+CD25+细胞占CD3+细胞的百分比[18]
免疫检查点PD1/PD-L1已成为生物医学研究热点,特别是在肿瘤免疫治疗中,然而,PD1/PD-L1在肿瘤免疫微环境中的表达极其复杂,成像技术可能有助于监测其全身水平及其动态变化与治疗结果的相关性[20],新近临床研究表明成像技术检测PD1/PD-L1表达具有可行性[21]。如使用高亲和工程蛋白支架(HAC-PD1)对PET成像示踪剂进行优化,将多种HAC-PD1放射性示踪变体用于临床前成像和生物分布研究,以评估其检测人体内PD-L1表达的能力[22]。BMS-986192是一种可与人PD-L1受体高亲和性结合的连接蛋白,68Ga标记的BMS-986192(68Ga-BMS-986192)在体内和体外表现出优异的PD-L1靶向特性,表明68Ga-BMS-986192可用于肿瘤中PD-L1表达的PET成像,并有望进一步推动PD-L1配体的临床应用[23]。总之,这些新兴的无创、全身和定量的成像技术及装备有助于提高对动态肿瘤微环境的检测。
2 报道基因示踪技术
报道基因成像技术是通过将报道基因与示踪剂相结合,通常在体外将报道基因导入细胞表达报道蛋白,报道蛋白结构可促进示踪剂摄取或直接标记,以便在体内对细胞进行跟踪。理想的报道基因/蛋白是不破坏细胞正常功能或无免疫原性。报道基因策略已用于ACT细胞的定位和监测,包括酶报道基因、同向转运体报道基因、蛋白结合报道基因[24](图4)。

图4 报道基因标记技术的3个主要分子成像方法及机制在体外将报道基因导入细胞表达报道蛋白:(a)酶可以与核素标记的核苷类似物(底物探针)相结合,催化底物磷酸化后将其截留在细胞内;(b)转运体报道基因产物表达在细胞膜上,可以将几个造影剂分子运输到细胞内,使细胞被标记;(c)结合蛋白报道基因产物通常也在细胞的质膜上表达,与放射性标记物直接结合
2.1 酶报道基因
利用酶与示踪剂标记的底物结合,使示踪剂保留在过继性细胞中进行成像是一种有效的方法,例如目前成像常用的酶报道基因:单纯疱疹病毒胸苷激酶(HSV1-tk),可以与核素标记的核苷类似物(底物探针)相结合,如18F-羟甲基丁基鸟嘌呤(FHBG)和18F-羟丙基甲基鸟嘌呤(FHPG),当酶催化其磷酸化后被截留在细胞内,通过PET成像检测CTL细胞[25](图5)。
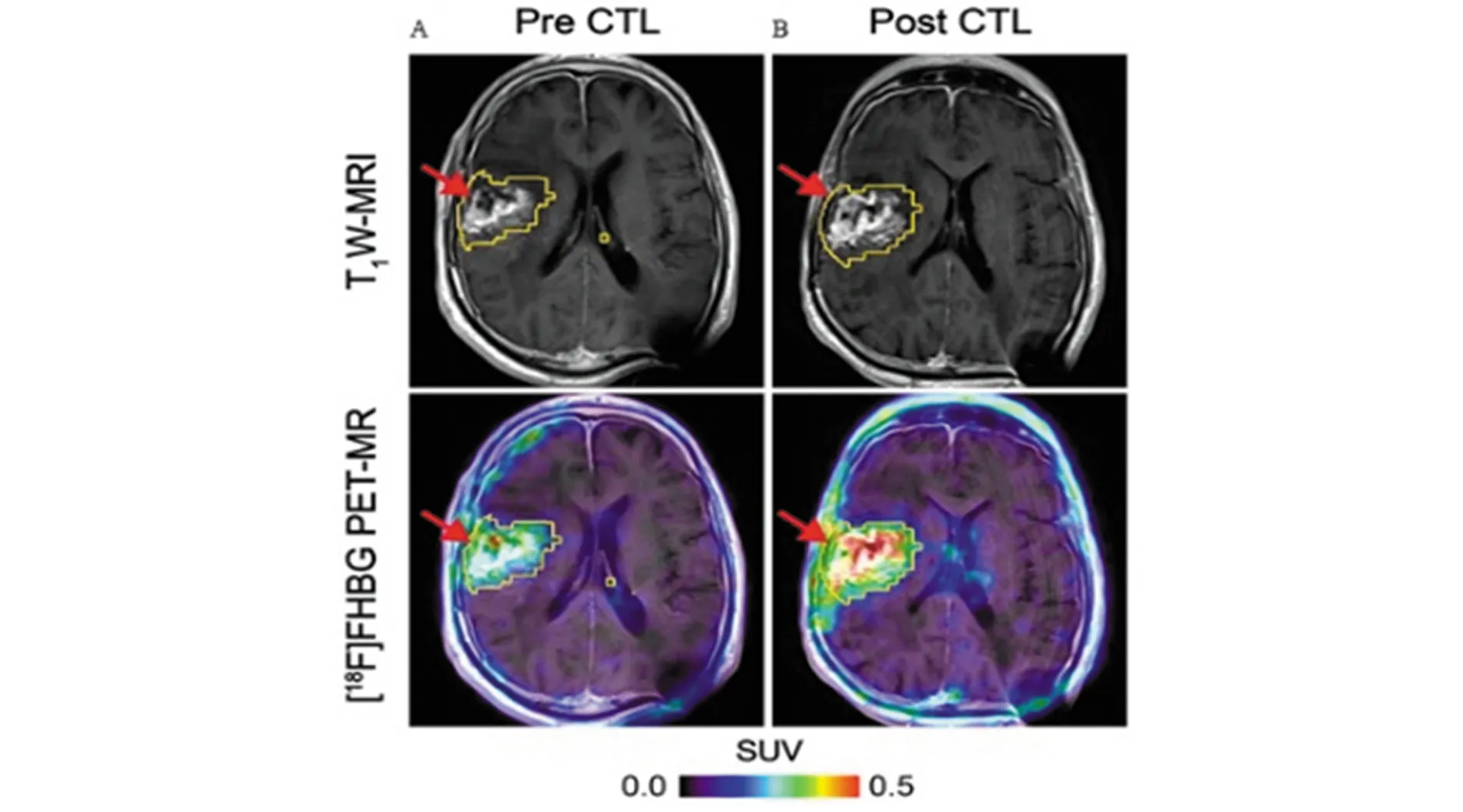
图5 对复发右额顶叶胶质母细胞瘤的66岁男性患者进行[18F]FHBG PET成像
Keu等[25]研究发现使用[18F]FHBG探针的PET成像可以示踪CAR-T工程细胞中HSV1-tk报道基因的表达,进一步优化体内细胞迁移监测的成像方法将有利于推动癌症细胞疗效检测。HSV1-tk报道基因存在的缺陷主要是体内的CD8+T细胞对HSV免疫而导致过继性细胞被清除,此外,某些化疗和骨髓移植使用的预防性抗病毒药物,例如更昔洛韦,可能会杀死表达HSV1-tk的细胞。为了降低抗病毒药物对工程细胞的毒性,Likar等[26]设计了一个新的酶报道基因:人类脱氧胞苷激酶(dCK)的双突变报道基因dCKDM,与HSV1-tk基因转导的细胞相比,转导dCKDM的细胞在体内和体外对嘧啶类放射性药物18F-FEAU的摄取率和保留率更高,对抗病毒药物敏感性降低。最近研究显示,HSV1-tk基因(sr39tk)突变改造后转染B7H3 CAR-T细胞可提高更昔洛韦的酶活性且不影响细胞功能,该基因工程改造系统在进行PET成像的同时,可减少CAR-T细胞的消融[27]。无免疫原性的PET成像报道基因如人脱氧胞苷激酶三突变体(hdCK3mut)也被研究应用于临床免疫治疗中的工程细胞定位的全身检测。对于先前接触过单纯疱疹病毒的CAR-T治疗患者,使用表达HSV-T hdCK3mut作为PET成像的报道基因,不仅可消除淋巴细胞对工程细胞的适应性免疫反应,还可以持续使用抗病毒药物[28]。
2.2 转运体报道基因
目前,用于免疫成像的转运体报道基因有碘化钠转运体(NIS)、去甲肾上腺素运体(NET),应用较广泛的为NIS,已经在多种免疫细胞的体内示踪中进行了功能验证,包括CAR-T细胞、调节性T细胞(Tregs)和DCs。
Emami-Shahri等[29]在CAR-T细胞工程表达了人碘化钠转运体(hNIS),使用99mTcO4作为示踪剂,通过SPECT评估了hNIS作为CAR-T细胞免疫治疗成像报道基因的作用,对移植细胞进行了长期监测(图6),结果显示,99mTcO4-hNIS系统的可行性和实用性。最近,Jacob等[30]报道了使用放射性示踪剂99mTcO4对转导了NIS报道基因的Tregs进行放射性标记,进而采用SPECT示踪Tregs体内行为,在监测器官移植后或自身免疫性疾病发作或治疗期间的抑制性免疫反应监测中效果显著,可用于Tregs无创示踪。Ahn使用生物发光成像(BLI)和PET的多模态报告系统,将hNIS作为核成像报道基因、Luc2作为光学成像报道基因,联合荧光素酶的BLI和124I的PET成像可监测到骨髓源性DC(BMDC)在注射后第7天向引流腘窝淋巴结的迁移,证实了多模态报道基因系统作为一种新成像平台的应用潜力[5]。
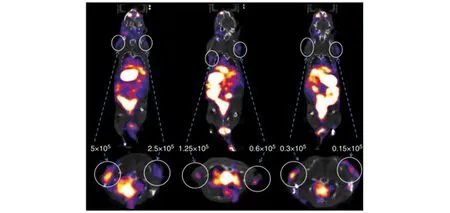
图6 用hNIS的T细胞治疗小鼠,SPECT/CT成像显示,在第21天肿瘤内有T细胞聚集[29]
人去甲肾上腺素运体(hNET)基因是另一种非免疫原性转运体报道基因,可介导偏碘苯胍(MIBG)或偏氟苯胍(MFBG)的特异性摄取,使用放射性示踪剂标记MIBG/MFBG可示踪表达hNET的工程细胞。与MIBG相比,MFBG可以更快地进行肿瘤细胞显像示踪。因此,Moroz等[31]使用18F-MFBG替代123I/124I-MIBG的方案,用于转导hNET报道基因的T细胞PET成像并获得成功。
2.3 结合蛋白报道基因
与上述标准报道基因相似,通过转染使细胞表达抗体、抗原、受体等蛋白,使用可结合这些蛋白的示踪剂也可通过分子影像技术检测体内工程过继性细胞的转运[32]。
螯合肽(DOTA)可与放射性元素螯合而被用于多种放射性示踪剂的研发,Krebs等[33]将抗DOTA抗体报道基因1(DAbR1)转导到CAR-T细胞中并表达抗DOTA抗体,使用DOTA与86Y或177Lu放射性元素螯合制备示踪剂,采用PET或SPECT成像可示踪转导了DAbR1基因的CAR-T细胞(图7)。靶向前列腺特异性膜抗原(PSMA)的放射性示踪剂具有高的检测灵敏度[34],有研究将PSMA基因作为CAR-T细胞的报道基因,使用18F放射性标记的靶向剂DCFPyL可结合PSMA尿素基,该示踪剂(18F-DCFPyL)能够识别原发和转移性肿瘤部位的CAR-T细胞,通过PET成像检测CAR-T细胞的浸润[35],但在高表达PSMA肿瘤中,PSMA报道基因示踪系统不适合用于追踪过继性细胞。具有多个成像探针的报道基因系统是生长抑素受体(SSTRs),可通过68Ga标记DOTATATE或DOTATOC进行PET成像,也可采用99mTc标记奥曲肽进行SPECT成像,但体内免疫细胞表达SSTR2受体,因而会降低成像的特异性。此外,该报道基因可能会干扰细胞免疫功能[24],从而限制了该报道基因的应用。

图7 PET/CT图像显示CAR-DAbR1 T细胞在右肩肿瘤部位的归巢和聚集[33]
3 基于抗体的示踪技术
目前大多数靶向示踪剂由抗体或多肽组成,这些抗体或多肽可用于的放射性标记、染料标记,可通过PET、SPECT成像系统实现目标细胞和组织可视化[36](图8)。
图8 基于抗体的示踪技术
3.1 靶向免疫细胞分化抗原
随着蛋白质标记技术的快速发展和针对细胞表面标记物的抗体实用性提高,因此使用放射性标记抗体对特定细胞进行体内成像的方法引起广泛关注。细胞分类功能蛋白的抗体示踪剂已常用于监测相应细胞群在体内的位置、运动和相对密度,例如T细胞标记物CD3、CD4、CD8、CD2和CD7;B细胞标记物CD20;髓系细胞标记物CD11b。
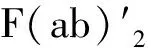
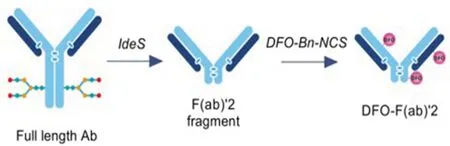
图9 从全长抗体中制备片段示意图[4]
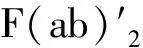
3.2 靶向免疫检查点
多种免疫检查点抗体已成功研发并用于免疫治疗,如PD-L1、PD1、CTLA-4、T细胞免疫球蛋白ITIM结构域(TIGIT)等免疫检查点的抗体,标记这些抗体的PET免疫成像可以帮助诊断和监测治疗反应,已成为体内监测免疫治疗的主要技术手段[42,43]。
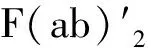
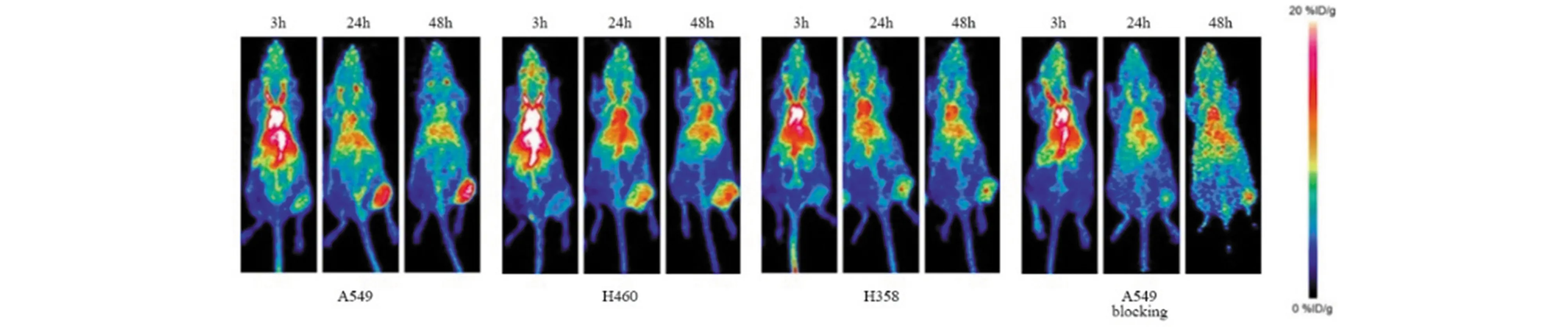
图10 使用64Cu-DOTA-ipilimumab对肺癌移植小鼠进行PET成像,监测CTLA-4在非小细胞肺癌模型中的表达[49]
3.3 靶向细胞因子
针对免疫环境中特有的细胞因子标记示踪是另一种监测炎症疾病、肿瘤发展的成像策略。虽然基于肽和蛋白质的直接探针标记法可以有效地对病灶部位进行检测,但过程非常复杂耗时,而且这些探针的体内药物代谢行为欠佳,对细胞因子抗体的放射性标记可弥补直接标记的不足[51]。
肿瘤坏死因子-α(TNF-α)是一种促炎因子,临床上已将TNF-α单抗广泛应用于自身免疫性疾病的治疗。近年来,使用放射性物质标记的抗TNF-α的单克隆抗体,通过SPECT成像对其进行体内定位示踪,用于炎症性慢性疾病的诊断[52]。新近一项临床研究中,L5~S1节段椎间盘突出常伴有炎症疼痛的患者进行腰椎椎间盘切除术,手术前使用99mTc标记英夫利昔单抗(一种抗TNF-α单克隆抗体)进行SPECT成像显示其S1神经根感染,而患者无疼痛后再次进行SPECT成像,结果显示在手术/椎间盘部位没有检测到残留信号,表明了SPECT成像中TNF-α信号的消失与局部炎症反应的减少/消除有关[53]。目前也已有大量报道对IL进行体内成像以检测炎症或评估其作用,例如,IL-1β在先天免疫应答中起关键作用,主要由中性粒细胞、单核细胞、巨噬细胞和树突状细胞分泌,使用89Zr标记IL-1β抗体可用于PET成像以检测结肠炎中固有免疫的激活[54](图11)。在一项免疫原性放疗(RT)与IL-2替代免疫检查点阻断剂的联合治疗研究中,使用64Cu标记治疗活性IL-2和PD-L1,实现了PET成像来评估治疗作用机制及其副作用[55]。
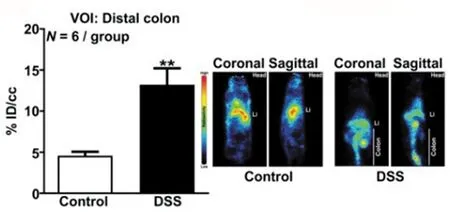
图11 使用89Zr-IL-1β检测结肠炎症[54]
4 总结与展望
免疫成像的临床应用要求成像方法必须是无创安全的,且能够对患者的免疫治疗效果进行精确的定量评估。所讨论的三种示踪技术,每一种成像方法都有其独特的优点和局限性。直接标记技术的示踪物能够在体外主动与培养的细胞结合,也可以将示踪物直接注射到体内后与细胞结合。但由于不同的细胞膜性质和不同的吞噬能力,直接标记免疫细胞进行示踪是一项具有挑战性的任务,此外,由于细胞增殖或死亡,直接标记的示踪剂信号可能被稀释或丢失;在标记细胞死亡的情况下,吞噬细胞(例如巨噬细胞、树突状细胞)会吸收细胞碎片并导致假阳性信号,因此应用直接标记示踪技术时,成像时间应在几天之内。报道基因示踪技术通过利用自然表达的方式,可以对靶细胞群进行体内的重复成像观察。然而,这种方法需要为每个报道基因所表达的独特靶点(如细胞表面受体)开发对应的放射性示踪物制剂,成本较高。基于抗体的示踪技术其具有特异性高,且相对容易标记的优势,然而,当使用单克隆抗体靶向特定细胞群时,特别是抗体Fc区域完整时,可能会耗竭其目标细胞群,表面受体的抗体也可能表现出激动剂或拮抗剂的活性,进而影响细胞功能,降低它们成像适用性。使用抗体作为载体的另一难点是其清除途径,在肝脏、肾脏、胆囊和胃肠道等器官中可能会出现非特异性的放射性结合;此外,基于抗体的显像剂的一个主要缺点是清除率慢,由于它们的组织穿透能力差,体内代谢时间长,常常需要等待数天才能获得高分辨率的图像而影响预后评估。综上所述,在选择某一成像技术时,需要根据具体的研究目标来选择合适的成像方式。
体内免疫成像仍是一个很有前景的前沿创新领域,具有巨大的科学价值和临床应用潜力。总的来说,在未来的临床应用中,多模态成像有望通过信号共定位的信息融合,实现对免疫系统的定性和定量跟踪,可望成为最理想检测技术。体内免疫系统的动态演进以及免疫细胞的动力学行为复杂性,需要不断深入开展基于免疫治疗方面的创新研究以促进免疫成像监测工具研发,系统揭示其作用原理并指导实验性治疗研究的顺利开展,不断优化成像模式将有助于丰富免疫治疗方法,进而推动其临床应用并造福患者。
