人乳头状瘤病毒相关性口咽鳞状细胞癌的临床病理学特征分析
2022-01-27陈彤箴朱晓丽李小秋
张 岩,陈彤箴,朱晓丽,李小秋
复旦大学附属肿瘤医院病理科,复旦大学医学院肿瘤学系,复旦大学病理研究所,上海 200032
口咽鳞状细胞癌(oropharyngeal squamous cell carcinoma,OPSCC)是指发生在扁桃体、舌根、软腭和口咽壁等部位的恶性肿瘤。近30年来,由于吸烟和饮酒人群占比降低,头颈部(口腔、下咽及喉)鳞状细胞癌的发病率开始下降,但是OPSCC的发病率却有明显上升趋势[1]。既往研究[2-4]表明,人乳头状瘤病毒(human papilloma virus,HPV)在西方国家OPSCC中的检出率为40%~80%,提示HPV感染是OPSCC发生的重要致病因素之一[1,5-6]。OPSCC-HPV现被认为是一种独立的肿瘤类型,被列入第四版世界卫生组织《头颈部肿瘤分类》[7]中。第8版美国癌症联合会(American Joint Committee on Cancer,AJCC)口腔及口咽癌分期系统[8]新增了OPSCC-HPV TNM分期标准。为加深对该肿瘤的认识,我们分析了64例OPSCC-HPV患者的临床病理学特征和鉴别诊断,并比较了第7版[9]和第8版AJCC口咽癌临床TNM分期。
1 资料和方法
1.1 病例来源
收集复旦大学附属肿瘤医院病理科2013年10月—2019年7月诊断的64例OPSCC-HPV患者,其中46例系会诊病例,18例系本院常规外检病例。调阅所有病理学切片,由2名有经验的专科病理科医师独立复核诊断。第四版世界卫生组织《头颈部肿瘤分类》推荐口咽癌中的肿瘤细胞P16免疫组织化学染色弥漫阳性可以作为高危型HPV感染的替代指标,因此本研究的病例纳入标准为HPV阳性或P16免疫组织化学染色弥漫阳性的OPSCC。
1.2 免疫组织化学检测
标本经固定、脱水、石蜡包埋和常规4 μm切片,分别作H-E染色。免疫组织化学染色采用全自动免疫组织化学染色仪BenchMark XT(美国Roche公司),所用一抗P16、P63、Ki-67和表皮生长因子受体(epidermal growth factor receptor,EGFR)均购自美国Roche公司(克隆号分别为E6H4、4A4、30-9和5B7),细胞角蛋白(cytokeratin,CK)5/6和P40均购自福州迈新生物技术开发有限公司(克隆号为D5/16B4和ZR8),CAM5.2多克隆抗体购自美国Becton Dickinson公司。
1.3 HPV DNA的聚合酶链反应(polymerase chain reaction,PCR)检测
从石蜡组织中提取基因组DNA,采用PCR-反向点杂交法检测HPV。HPV基因分型检测试剂盒购自亚能生物技术(深圳)有限公司。可检测23种HPV亚型,包括高危型HPV-16、18、31、33、35、39、45、51、52、53、56、58、59、66、68、73、82、83和低危型HPV-6、11、42、43、81。
1.4 Epstein-Barr病毒早期RNA(Epstein-Barr virus early RNA,EBER)原位杂交检测
使用地高辛标记的EBER1/2 DNA探针检测肿瘤中Epstein-Barr病毒(Epstein-Barr virus,EBV)编码的EBER。EBV检测试剂盒购自福州泰普生物科学有限公司。
2 结 果
2.1 临床资料(表1)

表1 64例OPSCC-HPV患者的临床病理学特征Tab.1 Clinicopathological features of 64 patients with OPSCC-HPV
64例患者中,男性50例,女性14例。发病年龄33~76岁,平均年龄55.1岁。44例位于扁桃体,4例位于舌根,9例位于口咽壁,7例同时累及扁桃体、舌根和口咽壁。36例以进行性增大的颈部包块为首发症状,18例以咽痛、扁桃体痛或异物感为首发症状,2例同时出现颈部包块和咽部不适。57例伴颈部淋巴结转移,其中30例影像学检查提示伴囊性变(图1A)。至少23例有口交性行为史,40例有长期吸烟和(或)饮酒史。6例先后或同时出现第二原发癌。6例初次就诊时被诊断为原发不明的颈部淋巴结转移性鳞癌,12~56个月后再次出现颈部包块增大(图1B)或原发灶症状,继而在口咽部位查见原发灶(图1C)。33例行放化疗,23例行手术+放化和(或)化疗,3例行放疗,1例行化疗,1例观察随访。随访时间2~77个月(平均21.6个月,中位16.0个月),2例局部复发,6例颈部淋巴结转移,1例颈椎转移,3例死亡,其中2例死于肿瘤破裂大咯血。比较第7版和第8版AJCC临床分期,T分期不变,第8版N2期全部降级为N1期。第8版临床总分期明显降级,Ⅰ~Ⅱ期患者占比增加85.4%,Ⅲ期降低52.7%,Ⅳ期降低32.7%,新旧两版临床总分期一致率仅为3.6%(2/55)(表2)。
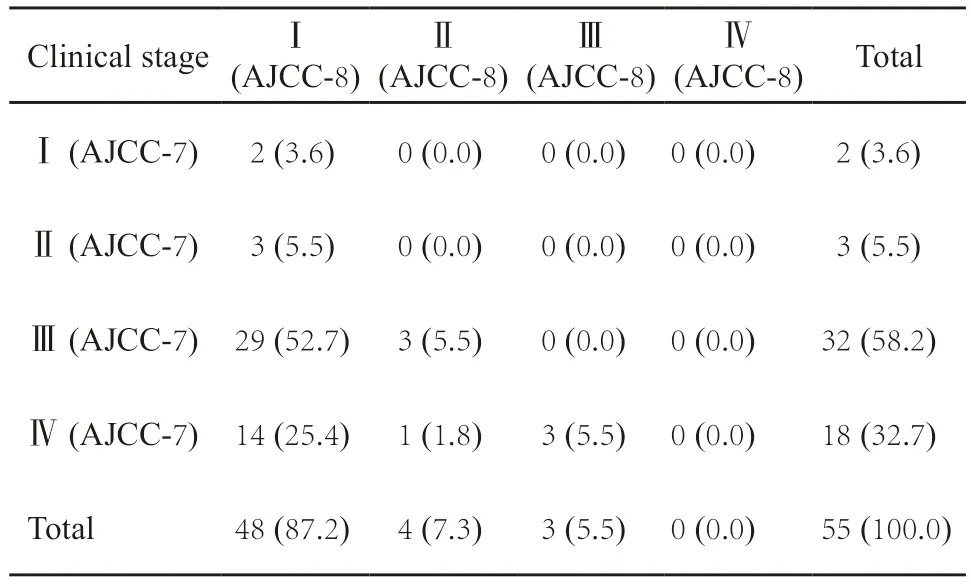
表2 第7版和第8版AJCC临床分期比较Tab.2 Comparison of clinical stage between AJCC-7 and AJCC-8[n (%)]
2.2 病理学检查
肿瘤最大径0.3~4.3 cm,颈部转移性淋巴结最大径1.0~7.0 cm。鳞状细胞癌63例,腺鳞癌1例。所有鳞状细胞癌病例(包括腺鳞癌中的鳞状细胞癌成分)主要呈非角化性鳞状细胞癌形态。肿瘤细胞呈浸润性生长,排列成大小不等、形态不规则的片状、巢状、索状或簇状(图1D)。瘤细胞异型性明显,细胞边界清楚,细胞质少到中等量、嗜酸性;细胞核圆形或椭圆形,核膜清晰,染色质细腻或呈空泡状,核浆比高,核分裂象易见(图1E)。33例可见肿瘤性坏死。3例表现为基底样鳞癌形态(图1F)。4例灶区呈乳头状形态。8例癌巢周边细胞质增多,H-E染色增强,出现反向成熟或骤然角化现象(图1D)。4例肿瘤累及表面上皮。16例伴促结缔组织增生性间质反应。45例肿瘤上皮巢内见浸润性淋巴细胞。1例腺鳞癌中的腺癌成分由分化好的腺腔组成(图1G)。转移性淋巴结可伴坏死及囊性变(图1H)。
2.3 免疫组织化学染色
60例患者行P16免疫组织化学染色,其中59例肿瘤细胞呈细胞核和细胞质的弥漫强阳性,表面正常鳞状上皮及癌巢周边出现反向成熟或骤然角化现象的肿瘤细胞均不表达P16(图1I)。28例行P63染色,12例行P40染色,21例行CK5/6染色,19例行EGFR染色,肿瘤细胞均呈弥漫强阳性。在1例腺鳞癌中,鳞癌成分弥漫强阳性表达CK5/6和P63,腺癌成分CAM5.2弱阳性,两种成分P16均呈弥漫强阳性。28例行Ki-67染色,Ki-67增殖指数范围30%~90%(平均69%),其中24例Ki-67增殖指数≥60%。
2.4 HPV DNA检测
39例患者行HPV DNA检测,均呈阳性结果,亚型全部为高危型病毒感染,其中HPV-16型36例(图1J),HPV-18型1例,HPV-31型和HPV-53型同时阳性1例,HPV-58型1例。在39例HPV阳性患者中,P16阳性者34例,P16阴性者1例,P16未染者4例。余25例只行P16免疫染色,均示肿瘤细胞弥漫强阳性。

图1 OPSCC-HPV典型图像Fig.1 Typical images of OPSCC-HPV
2.5 EBV检测
35例患者行EBER检测,肿瘤组织中均无EBV检出。
3 讨 论
HPV是一种环状双链DNA性传播病毒,整合到宿主DNA中,表达E6和E7癌蛋白,后者抑制视网膜母细胞瘤蛋白的活性,导致P16蛋白过表达,根据其致癌潜能分为高危组和低危组。HPV是OPSCC的1个重要致病因素。Lam等[10]分析中国香港地区207例OPSCC患者,发现P16高表达与HPV感染密切相关(P<0.001),其灵敏度和特异度分别达到97.7%(42/43)和84.8%(139/164)。Ang等[11]研究认为,P16是检测口咽癌中HPV感染非常可靠的替代指标。本组35例患者同时行P16和HPV检测,二者一致率较高,达到97.1%(34/35)。值得注意的是,非病毒相关的改变也可以导致P16表达升高。免疫组织化学方法检测P16蛋白水平具有简便、经济和高灵敏度的优势。对P16免疫组织化学阳性结果的判读非常重要,要结合组织学形态,避免假阳性结果的出现。本研究把肿瘤细胞P16弥漫的细胞核和细胞质强着色判读为阳性。
本研究的男性患者明显多于女性,T分期较早,至少50%(23/46)的患者有口交性行为。75%(48/64)的肿瘤位于扁桃体和舌根,远高于发生于口咽壁者(14.1%,9/64),该结果接近Cianchetti等[12]的报道(85%),提示扁桃体和舌根是OPSCC-HPV较常见的发病部位。值得注意的是,56.3%(36/64)的患者以颈部包块增大为首发症状就诊,咽部症状不明显,可能与原发灶肿瘤较小、位置较深及表面黏膜不常受累有关。此外,52.6%(30/57)的转移性淋巴结在影像学或组织学上具有坏死、囊性变的改变。Goldenberg等[13]也提出转移性淋巴结囊性变是OPSCC-HPV的1个重要诊断线索。本研究样本量较小,死亡病例数少,需通过扩大样本量和延长随访时间,更准确地评估预后相关危险因素。
本研究中所有鳞状细胞癌(包括腺鳞癌中的鳞状细胞癌成分)主要呈非角化性鳞状细胞癌形态,这与已有研究[14-16]数据相似,表明非角化性鳞状细胞癌是最常见类型。OPSCC-HPV的其他少见组织学类型包括淋巴上皮瘤样癌[17]、腺癌[18]和神经内分泌癌[19]等,文献报道的病例数较少,预后不一。
颈部淋巴结转移性鳞状细胞癌,特别是出现分化较差、核呈空泡状、核仁明显等特征时,需与鼻咽癌转移进行鉴别。Maxwell等[20]报道了1组EBV-/HPV+的鼻咽非角化性癌患者,此外,Polz-Gruszka等[21]报道了62例波兰OPSCC患者中有6例(9.7%)共感染HPV/EBV。因此,通过检测HPV和EBV有助于提示原发灶来源,但最终还是要结合临床及影像学检查综合分析来判断肿瘤原发灶。OPSCC-HPV转移到颈部淋巴结时,常表现为坏死及囊性变,当转移灶呈大巢团、界限清楚、似有基底膜样物质及癌巢周边肿瘤细胞呈栅栏状,且临床及影像学检查没有找到原发灶时,容易误诊为鳃裂囊肿恶变,检测HPV并仔细寻找被膜和淋巴窦等淋巴结结构有助于两者的鉴别。在活检标本中,当癌细胞核深染、细胞质特别少、核分裂象多时,形态学上可以类似于小细胞神经内分泌癌,但后者核染色质常呈点彩状,突触素和嗜铬素等神经内分泌标记阳性,角蛋白也常表现为核旁点状阳性。对所有原发灶不明,以颈部淋巴结转移性鳞状细胞癌为首发症状的患者,检测P16蛋白或HPV有利于准确的病理学诊断及肿瘤原发灶的判断,对于患者预后判断也具有重要价值。
虽然OPSCC-HPV患者常伴有淋巴结转移,且组织学形态常是非角化性鳞状细胞癌,但对治疗敏感,预后较好[6,11,22]。有研究[11,22]表明,HPV是口咽癌独立的预后因素。由于其独特的生物学行为,第7版AJCC头颈部肿瘤分期标准不足以准确反映该疾病的自然史,第8版AJCC分期系统新增加了OPSCC-HPV分期,将其与非OPSCC-HPV区别开来,能够更加准确地预测OPSCC-HPV患者的预后。在本组患者中,与第7版AJCC分期相比,第8版临床总分期明显降级,Ⅰ~Ⅱ期患者占比增加85.4%,但需通过扩大样本量和延长随访时间来准确评估预后相关危险因素。有部分临床试验关注于在保证最大化治疗效果的同时,降低治疗强度,避免过度治疗造成的不良反应。然而,仍有部分OPSCC-HPV患者对治疗不敏感,预后差,其分子机制及遗传学改变有待进一步研究。目前,在美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)肿瘤学临床实践指南和中国临床肿瘤学会头颈部肿瘤指南[23-24]中,降低治疗策略并没有得到一致认可,仍然按照传统方案进行治疗。
综上所述,OPSCC-HPV具有独特的临床病理学特征。男性患者多见,与口交性行为有关,临床上多以颈部包块渐进性增大为首发症状就诊。最常见的组织学类型是非角化性鳞状细胞癌,Ki-67增殖指数较高。颈部转移性淋巴结常伴坏死及囊性变,易误诊为鳃裂囊肿恶变或鼻咽癌转移。P16免疫组织化学染色可以作为评估HPV感染状态的替代标志物,其中HPV-16是最常见的亚型。在日常病理学诊断中,所有原发性OPSCC及原发部位不明的颈淋巴结转移性鳞状细胞癌(尤其是非角化性鳞状细胞癌)均应行P16或HPV检测。
利益冲突声明:所有作者均声明不存在利益冲突。
