长链非编码RNA NR2F1-AS1靶向微小RNA-145-5p调控结肠癌细胞增殖、迁移和侵袭的分子机制
2022-01-27赵刚武青生赵延礼马生彪王巍穆元忠
赵刚,武青生,赵延礼,马生彪,王巍,穆元忠
结肠癌是常见的恶性肿瘤,表现为细胞增殖失控,肿瘤复发和转移是导致其治疗失败的主要原因[1]。目前,结肠癌的病因和发病分子机制尚未完全清楚,探讨影响结肠癌细胞恶性行为的分子机制对于阐明结肠癌发病机制的及寻找治疗靶点意义重大。长链非编码RNA(lnc RNA)参与肿瘤细胞生物学行为调控的长度大于200个核苷酸的非编码RNA,其表达失调与肿瘤进展关系密切[2-3]。lncRNA NR2F1-AS1是核受体亚族2F组成员1(nuclear receptor subfamily 2 group F member 1,NR2F1)的反义 RNA,研究显示,其在肝细胞癌[4]、骨肉瘤[5]等肿瘤中表达升高,干扰NR2F1-AS1表达可抑制肿瘤细胞的增殖、迁移和侵袭。但NR2F1-AS1在结肠癌中的表达及其作用还未知。微小RNA(miRNA)在肿瘤进展中也起重要调控作用[6]。lnc RNA可调控miRNA的表达,两者共同参与肿瘤进程[7]。生物信息学软件预测显示,miR-145-5p可能是NR2F1-AS1的靶基因。有报道显示miR-145-5p在结直肠癌中表达降低,过表达miR-145-5p可抑制癌细胞增殖和侵袭,为结直肠癌的治疗提供了潜在治疗靶点[8]。目前,NR2F1-AS1能否靶向miR-145-5p调控结肠癌进展还未知。本研究主要探讨了NR2F1-AS1和miR-145-5p对结肠癌HCT116细胞恶性行为的影响,分析NR2F1-AS1对miR-145-5p的靶向调控作用,以期从lncRNA/miRNA途径揭示结肠癌进展的机制,并为结肠癌治疗靶点选择提供新的方向。
1 资料与方法
1.1 一般资料收集2015年3月至2017年5月青海省第五人民医院外科手术切除并经病理证实为原发性结肠腺癌组织25例,另留取距肿瘤边缘3 cm的癌旁组织(正常结肠组织)。其中男16例,女9例,年龄(61.25±5.78)岁。组织高分化7例,中分化9例,低分化9例。淋巴结转移14例,未转移11例。病人术前未进行放、化疗等治疗。病人或其近亲属签署知情同意书。本研究符合《世界医学协会赫尔辛基宣言》相关要求。
1.2 细胞和实验试剂结肠癌细胞株HCT116(中国科学院上海细胞库),胎牛血清(FBS)(浙江天杭生物科技股份有限公司),RPMI 1640培养基、CCK-8试剂盒、LipofectamineTM2000试剂盒、双荧光素酶活性检测试剂盒和BCA蛋白检测试剂盒(北京索莱宝科技有限公司),胰蛋白酶(美国Sigma公司),si-NR2F1-AS1、si-NC、pcDNA-NR2F1-AS1、pcDNA、miR-145-5p mimcs、miR-NC、anti-miR-145-5p、antimiR-NC(上海吉玛制药技术有限公司),逆转录试剂盒、RNA抽提试剂盒和PCR试剂盒(深圳晶美生物工程有限公司),PCR引物(上海生工生物工程公司),鼠抗人细胞周期蛋白D1(Cyclin D1)、细胞周期蛋白依赖性激酶抑制剂1A(P21)单克隆抗体(美国Santa Cruz公司),兔基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)多克隆抗体(北京中杉金桥生物试剂公司)。
1.3 实验方法
1.3.1 HCT116细胞培养 复苏HCT116细胞,加入含10%FBS的RPMI 1640培养基,于37℃、湿度97%、5%二氧化碳的培养箱中培养。显微镜观察细胞生长状况,待细胞融合至80%左右时,0.25%胰蛋白酶消化,以1∶3比例传代。
1.3.2 NR2F1-AS1与miR-145-5p靶向关系验证生物信息学软件预测显示,NR2F1-AS1与miR-145-5p结合的核苷酸序列。PCR扩增含miR-145-5p结合位点的NR2F1-AS1核苷酸序列,插入载体,构建NR2F1-AS1野生型荧光素酶报告载体(WT-NR2F1-AS1)。同时,将结合位点突变后构建NR2F1-AS1突变型荧光素酶报告载体(MUT-NR2F1-AS1)。用LipofectamineTM2000试剂盒分别将WT-NR2F1-AS1、MUT-NR2F1-AS1与miR-145-5p mimic或miR-NC共转染。24 h后,收集细胞,检测荧光素酶活性。具体操作参照双荧光素酶活性检测试剂盒说明书。分别转染si-NR2F1-AS1、si-NC、pcDNA-NR2F1-AS1及pcDNA至HCT116细胞,48 h后收集细胞,实时荧光定量PCR(RT-qPCR)检测miR-145-5p表达水平。
1.3.3 RT-qPCR检测组织或细胞中NR2F1-AS1和miR-145-5p表达水平 RNA提取试剂盒分离总RNA,检测RNA纯度和浓度后将其逆转录为互补DNA(cDNA)。再以cDNA为模板,行PCR扩增。NR2F1-AS1正向5'-CAGCGGTGCAAACCATGTGC-3',反向5'-GTAAACCAAGTCGGTTGAACG-3';GAPDH正向5'-CAGTGCCAGCCTCGTCTATG APDH-3',反 向 5'-CTTCTGACACCTACCGGGGA-3';miR-145-5p 正向 5'-CCAGCTGGGCTCA CTGAACAATGA-3',反向 5'-CAACTGGTGTCGTGGAGTCGGC-3';U6 正向 5'-TGCGGGTG CTCGCTTCGGCAGC-3',反向 5'-CCAGTGCAGGGTCCGAGGT-3'。 GAPDH 为NR2F1-AS1的内参,U6为miR-145-5p的内参,用2-ΔΔCt法计算基因相对表达量。
1.3.4 细胞转染和分组 取1×105个HCT116细胞接种6孔板,用Lipofectami-neTM2000分别将si-NR2F1-AS1(si-NR2F1-AS1组)、si-NC(si-NC组)、miR-145-5p mimcs(miR-145-5p 组)、miR-NC(miRNC组)、si-NR2F1-AS1与anti-miR-145-5p(si-NR2F1-AS1+anti-miR-145-5p组)、si-NR2F1-AS1与 anti-miR-NC(si-NR2F1-AS1+anti-miR-NC组)转染60%融合的细胞。转染48 h收集细胞,用于后续实验。
1.3.5 CCK-8法检测细胞增殖 各组细胞以每孔5×103个接种于96孔板中,每组设置3个复孔。将CCK溶液和细胞培养液按1∶9混合,在培养24 h、48 h和72 h后,取100 μL加入各孔内孵育,全自动酶标仪在4 h后于450 nm处测定吸光度(optical density,OD)值。实验重复3次。
1.3.6 Transwell检测细胞迁移和侵袭 侵袭实验:将无血清培养基和Matrigel按照8∶1混合,取50 μL铺于Transwell上室备用。用无血清培养基重悬各组HCT116细胞调整浓度为5×104个/毫升。在上室、下室中分别加入100 μL细胞悬液、500 μL完全培养基。孵育48 h后取出上室。将Transwell膜下表面的细胞分别用4%多聚甲醛固定、0.4%结晶紫染色。倒置显微镜下随机选取5个视野,对穿膜细胞计数。迁移实验:无需铺设Matrigel基质胶,后续实验步骤与侵袭实验相同。
1.3.7 蛋白质印迹法(Western blotting)检测蛋白表达 RIPA法提取总蛋白后进行蛋白定量。取适量蛋白置于100℃煮沸5 min。冷却至室温后,每组样本取30 μg行聚丙烯酰胺凝胶电泳。转膜后进行膜的封闭。用一抗孵育液在4℃孵育膜10 h。洗膜后,再用二抗孵育液在37℃孵育膜1 h。洗膜后,进行化学发光显色、凝胶成像系统拍照。以Image J软件分析蛋白条带相对内参甘油醛-3-磷酸脱氢酶(GAPDH)的灰度值。
1.4 统计学方法利用SPSS 22.0软件分析实验数据。计量资料以±s表示。两组间比较采用独立样本t检验;多组间比较采用单因素方差分析和SNK-q检验。P<0.05表示差异有统计学意义。
2 结果
2.1 结肠癌组织中NR2F1-AS1和miR-145-5p的表达与癌旁组织比较,结肠癌组织中NR2F1-AS1表达升高,miR-145-5p表达降低(P<0.05)。见表1。
表1 NR2F1-AS1和miR-145-5p在结肠癌组织中的表达/±s

表1 NR2F1-AS1和miR-145-5p在结肠癌组织中的表达/±s
注:①与癌旁组织比较,P<0.05。
组别癌旁组织结肠癌组织t值P值miR-145-5p 1.00±0.08 0.55±0.05①23.85 0.000例数25 25 NR2F1-AS1 1.01±0.11 3.39±0.33①34.21 0.000
2.2 NR2F1-AS1靶向调控miR-145-5p的表达NR2F1-AS1与miR-145-5p序列存在结合位点(图1)。共转染WT-NR2F1-AS1的miR-145-5p组细胞荧光素酶活性为0.49±0.05,低于miR-NC组1.03±0.09(t=15.735,P<0.001);而共转染 MUT-NR2F1-AS1的miR-145-5p组细胞荧光素酶活性为1.01±0.08,与miR-NC组细胞荧光素酶活性1.00±0.07比较,差异无统计学意义(t=0.282,P=0.781)。pcDNANR2F1-AS1组miR-145-5p表达水平为0.44±0.04,低于 pcDNA 组 1.00±0.08(t=18.783,P<0.001)。 si-NR2F1-AS1组miR-145-5p表达水平为2.88±0.27,高于si-NC组0.98±0.09(t=20.028,P<0.001)。

图1 NR2F1-AS1的序列中含有与miR-145-5p互补的核苷酸序列
2.3 干扰NR2F1-AS1表达对结肠癌HCT116细胞增殖、迁移和侵袭的影响与si-NC组相比,si-NR2F1-AS1组细胞中NR2F1-AS1表达水平降低(P<0.05),表明转染si-NR2F1-AS1可干扰NR2F1-AS1表达。与si-NC组比较,si-NR2F1-AS1组P21蛋白水平高于si-NC组(P<0.05),CyclinD1、MMP-2和MMP-9蛋白水平以及OD值、迁移和侵袭数低于si-NC组(P<0.05)。见图2和表2。

图2 干扰NR2F1-AS1表达对结肠癌HCT116细胞增殖、迁移和侵袭影响的相关蛋白表达
表2 干扰NR2F1-AS1表达对结肠癌HCT116细胞增殖、迁移和侵袭的影响/±s

表2 干扰NR2F1-AS1表达对结肠癌HCT116细胞增殖、迁移和侵袭的影响/±s
注:Cyclin D1为细胞周期蛋白D1,P21为细胞周期蛋白依赖性激酶抑制剂1A,MMP-2为基质金属蛋白酶-2,MMP-9为基质金属蛋白酶-9。
组别MMP-9蛋白重复次数NR2F1-AS1 OD值(450 nm)24 h 48 h 72 h迁移细胞数/个侵袭细胞数/个CyclinD1蛋白p21蛋白MMP-2蛋白si-NC si-NR2F1-AS1 t值P值0.72±0.07 0.30±0.03 16.545 0.000 9 9 1.01±0.09 0.53±0.05 13.987 0.000 0.61±0.06 0.52±0.04 3.744 0.002 1.21±0.11 0.68±0.06 12.690 0.000 1.62±0.13 0.87±0.07 19.099 0.000 126.39±11.43 61.48±6.57 14.771 0.000 108.26±10.22 52.47±5.63 14.344 0.000 0.63±0.06 0.25±0.03 16.994 0.000 0.33±0.03 0.78±0.07 17.726 0.000 0.69±0.06 0.27±0.03 18.783 0.000
2.4 miR-145-5p过表达对结肠癌HCT116细胞增殖、迁移和侵袭的影响miR-145-5p组细胞miR-145-5p表达水平高于miR-NC组(P<0.05),表明转染miR-145-5p mimics能够上调miR-145-5p表达水平。miR-145-5p组细胞P21蛋白水平高于miR-NC组(P<0.05),而CyclinD1、MMP-2和MMP-9蛋白水平、OD值、迁移和侵袭数低于miR-NC组(P<0.05)。见图3和表3。

图3 miR-145-5p过表达对结肠癌HCT116细胞增殖、迁移和侵袭影响的相关蛋白表达
表3 miR-145-5p过表达对结肠癌HCT116细胞增殖、迁移和侵袭的影响/±s
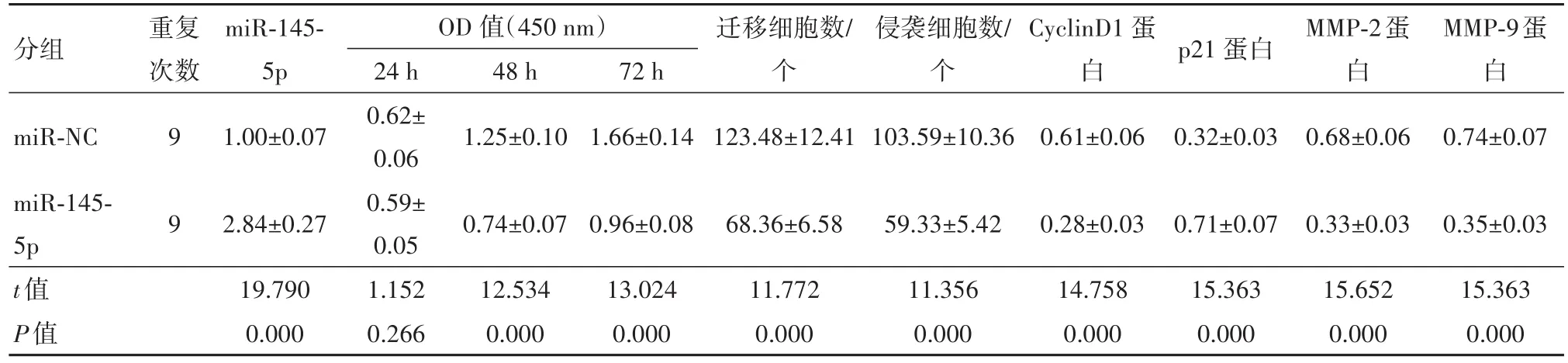
表3 miR-145-5p过表达对结肠癌HCT116细胞增殖、迁移和侵袭的影响/±s
注:Cyclin D1为细胞周期蛋白D1,P21为细胞周期蛋白依赖性激酶抑制剂1A,MMP-2为基质金属蛋白酶-2,MMP-9为基质金属蛋白酶-9。
分组重复次数p21蛋白miR-145-5p 48 h 72 h迁移细胞数/个侵袭细胞数/个CyclinD1蛋白MMP-2蛋白MMP-9蛋白OD值(450 nm)24 h miR-NC miR-145-5p t值P值1.00±0.071.25±0.101.66±0.14123.48±12.41103.59±10.360.61±0.060.32±0.030.68±0.060.74±0.07 0.35±0.03 15.363 0.000 9 9 2.84±0.27 19.790 0.000 0.62±0.06 0.59±0.05 1.152 0.266 0.74±0.07 12.534 0.000 0.96±0.08 13.024 0.000 68.36±6.58 11.772 0.000 59.33±5.42 11.356 0.000 0.28±0.03 14.758 0.000 0.71±0.07 15.363 0.000 0.33±0.03 15.652 0.000
2.5 抑制miR-145-5p表达逆转了干扰NR2F1-AS1表达对结肠癌HCT116细胞增殖、迁移和侵袭的作用si-NR2F1-AS1+anti-miR-145-5p组细胞CyclinD1、MMP-2和MMP-9蛋白水平以及OD值、迁移和侵袭数高于si-NR2F1-AS1+anti-miR-NC组,miR-145-5p表达水平和P21蛋白水平低于si-NR2F1-AS1+anti-miR-NC组(P<0.05)。见图4和表4。

图4 增殖、迁移侵袭相关蛋白表达
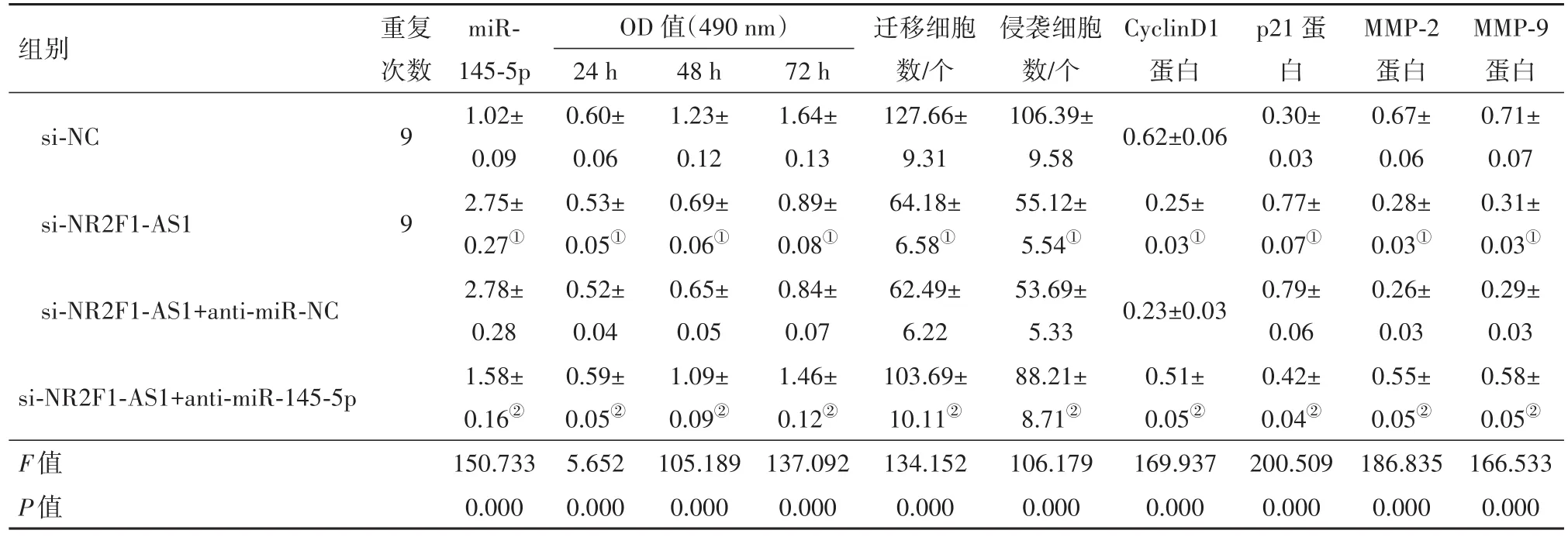
表4 抑制miR-145-5p表达逆转了干扰NR2F1-AS1表达对结肠癌HCT116细胞增殖、迁移和侵袭的作用(xˉ±s,n=9)
3 讨论
Lnc RNA是肿瘤发生发展的重要调控因子。NR2F1-AS1是近年来新发现的一种调控肿瘤发展进程的lnc RNA。Guo等[9]研究显示,NR2F1-AS1在甲状腺癌组织和细胞中呈高表达,其通过靶向上调miR-338-3P 表达抑制甲状腺癌进展。Wang等[10]研究显示,NR2F1-AS1在子宫内膜癌中表达升高,抑制NR2F1-AS1表达对子宫内膜癌细胞活力和转移能力具有显著抑制作用,这与其靶向上调miR-363表达有关。本研究发现,结肠癌组织中NR2F1-AS1表达水平明显高于癌旁组织,提示NR2F1-AS1可能参与结肠癌启动和发展。转染si-NR2F1-AS1至结肠癌HCT116细胞进行功能实验,结果显示干扰NR2F1-AS1表达可降低HCT116细胞活力,减少迁移和侵袭细胞数,同时伴有促增殖蛋白CyclinD1、促转移蛋白MMP-2和MMP-9的表达下降以及抗增殖蛋白P21蛋白的表达升高,提示NR2F1-AS1可能是结肠癌的潜在治疗靶点。
生物信息学软件预测显示,miR-145-5p可能是NR2F1-AS1的靶基因。为探讨NR2F1-AS1抗结肠癌的可能机制,本研究开展双荧光素酶报告基因法证实NR2F1-AS1可与miR-145-5p直接结合。随后的分析显示干扰NR2F1-AS1能够促进miR-145-5p表达,而NR2F1-AS1过表达则对miR-145-5p水平具有抑制作用,提示结肠癌中存在NR2F1-AS1/miR-145-5p 分子轴。miR-145-5p 在前列腺癌[11]、膀胱癌[12]、非小细胞肺癌[13]等肿瘤中表达降低,作为抑癌基因参与肿瘤的发生发展。本研究显示,miR-145-5p在结肠癌组织中呈低表达,过表达miR-145-5p可抑制HCT116细胞增殖、迁移和侵袭,与相关报道结果一致[8],证实miR-145-5p在结肠癌中的抑癌作用,提示上调miR-145-5p表达有助于阻碍结肠癌进程。本研究还显示,干扰miR-145-5p表达可逆转干扰NR2F1-AS1表达对HCT116细胞增殖、迁移和侵袭的抑制作用,提示干扰NR2F1-AS1表达通过靶向上调miR-145-5p表达发挥抗结肠癌作用。
总之,在结肠癌组织NR2F1-AS1表达升高,干扰NR2F1-AS1可能通过上调miR-145-5p表抑制结肠癌细胞HCT116细胞恶性行为,发挥抗结肠癌作用,是结肠癌治疗的潜在靶点。但本研究还存在不足之处,仅在细胞层面探讨了NR2F1-AS1对结肠癌的影响,接下来将通过裸鼠实验模型进一步探讨NR2F1-AS1对结肠癌细胞裸鼠移植瘤生长的影响及其它可能的调控机制。
