锚蛋白B在鼻咽癌组织中的表达及其对鼻咽癌细胞增殖、迁移和侵袭的影响
2022-01-27代文意
代文意
鼻咽癌是一种低分化、高转移性的恶性肿瘤,其发病率呈增长趋势[1]。由于鼻咽部位隐匿,鼻咽癌的临床症状多样,导致多数病人在确诊时已出现颈淋巴结转移,预后较差[2]。目前,鼻咽癌发生发展的机制尚未明确,因此,探讨影响鼻咽癌复发和转移的分子机制对于该疾病的治疗具有重要意义。锚蛋白B(ANK2)是细胞骨架家族成员,参与调控细胞增殖、分化和凋亡等生命活动。ANK2对多种肿瘤的发展具有调控作用。ANK2在肝癌病人组织中表达增加,是影响病人预后生存的独立因素[3];迁移和侵袭受到抑制的耐长春新碱胃癌细胞中ANK2表达降低[4]。目前,ANK2在鼻咽癌中的表达及其对鼻咽癌细胞恶性行为的影响还未知。本研究主要检测了ANK2基因在鼻咽癌组织和细胞中的表达,分析了ANK2基因与鼻咽癌临床病理特征的关系,并通过转染ANK2小干扰RNA至鼻咽癌细胞,探讨了干扰ANK2表达对鼻咽癌细胞增殖、迁移和侵袭的影响极可能的作用机制,以期为鼻咽癌的靶向分子治疗提供新思路。
1 资料与方法
1.1 一般资料选取2015年10月至2018年10月南阳市中心医院存档的67例鼻咽癌组织蜡块为研究对象,其中男性39例,女性28例,年龄(56.34±6.72)岁,年龄范围为34~69岁。其中高分化鼻咽癌15例,中分化20例,低分化32例。按照鼻咽癌TNM分期分为Ⅰ期11例,Ⅱ期11例,Ⅲ期16例,Ⅳ期29例。纳入标准:(1)获取组织学标本前,病人无鼻咽癌放化疗史;(2)病人一般资料完整。另选取50例鼻咽部炎症组织作为对照组,其中男性27例,女性23例,年龄(57.19±6.85)岁,年龄范围为31~70岁。两组年龄、性别等一般资料比较差异无统计学意义(P>0.05),具有可比性。
两组病人或其近亲属签署了知情同意书。本研究符合《赫尔辛基宣言》原则。
1.2 细胞和实验试剂人永生化鼻咽上皮细胞系NP69和鼻咽癌细胞系6-10B、5-8F,美国模式菌种收集中心;胎牛血清(FBS),浙江天杭;MTT、二喹啉甲酸(BCA)、RPMI 1640培养基和双荧光素酶活性检测试剂盒,北京索莱宝;RNA抽屉试剂盒、逆转录试剂盒和PCR试剂盒,大连宝生物;LipofectamineTM2000试剂盒,美国Invitrogen公司;兔抗人磷酸化糖原合成酶激酶3β(p-GSK3βser9)、β-连环蛋白(β-catenin)和c-myc抗体,美国Cell Signaling Technology公司;引物序列、ANK2小干扰RNA及乱序无意义阴性序列(si-NC),上海吉玛生物技术有限公司。
1.3 实验方法
1.3.1 细胞培养 复苏NP69、6-10B和5-8F细胞,均用含10%FBS的RPMI 1640培养基(完全培养基)置于二氧化碳培养箱中培养。
1.3.2 实时荧光定量逆转录聚合酶链式反应(qRTPCR)检测组织或细胞中ANK2 mRNA水平 用RNA抽屉试剂盒提取组织或细胞中总RNA,逆转录为cDNA后,进行扩增。引物序列ANK2正向5'-CAGCTACATTGTGTGGCATTCTA-3',反向 5'-CTACAGTGCAGTGGCCAGAAG-3';GAPDH 正 向 5'-GCACCGTCAAGGCTGAGAAC-3',反 向 5'-TGGTGAAGACGCCAGTGGA-3'。 2-ΔΔCt法 计 算 ANK2 mRNA相对GAPDH的表达量。
1.3.3 5-8F细胞转染 于6孔板中培养5-8F细胞(1.0×105个/孔),24 h后,用混合均匀的LipofectamineTM2000试剂与si-ANK2(si-ANK2组)或si-NC(si-NC组)孵育12 h。然后更换为完全培养基,再培养24 h,收集细胞。RT-qPCR法检测细胞中ANK2 mRNA表达验证转染效果。同时设置对照组,5-8F细胞正常培养,不进行转染操作。
1.3.4 四甲基偶氮唑盐比色法(MTT)检测细胞增殖 于96孔板中培养对照组、si-NC组和si-ANK2组细胞(2.5×104个/孔),每组设3个复孔。培养48 h后,加20μL MTT(5 mg/mL),孵育4 h。弃培养基,加150μL二甲基亚砜,振荡混匀,酶标仪490nm处测定吸光度(A)。细胞存活率(%)=A实验组/A对照组×100%。实验重复3次。
1.3.5 Transwell检测细胞迁移和侵袭 将对照组、si-NC组和si-ANK2组细胞用不含FBS的RPMI 1640培养基调整浓度为5×104个/毫升。迁移实验:于Transwell小室上室加100 μL各组细胞悬液,下室加500 μL完全培养基。培养48 h后,弃培养基,取出小室。将各组细胞用4%多聚甲醛固定30 min,然后置于0.4%结晶紫染色液中将细胞染色15 min。用PBS清洗后,显微镜观察,计数。侵袭实验:预先将Matrigel基质胶铺于Transwell上室,自然晾干后,再加100 μL各组细胞悬液,后续操作同迁移实验。
1.3.6 蛋白质印迹法(Western blotting)检测5-8F细胞中相关蛋白表达 于6孔板中培养对照组、si-NC组和si-ANK2组细胞(1.0×105个/孔),每组设3个复孔。培养48 h后,收集细胞。用RIPA试剂提取细胞中总蛋白,并用BCA蛋白试剂盒测定蛋白浓度。用SDS-PAGE电泳实验分离蛋白,并转至硝酸纤维素膜,用5%脱脂奶粉中封闭2 h。分别置于稀释后的 p-GSK3βser9(1∶400)、β-catenin(1∶400)和 c-myc(1∶400)抗体中4℃孵育过夜,洗膜后,置于辣根过氧化酶标记的二抗(1∶200)中室温孵育1 h。洗膜后,加显影液显影,曝光拍照。
1.4 统计学方法利用SPSS 22.0软件分析实验数据。χ2检验分析鼻咽癌组织中ANK2 mRNA表达水平与临床病理特征的关系。以±s表示计量资料,两组间比较用独立样本t检验;多组间比较用单因素方差分析,进一步两两比较用LSD-t检验。以P<0.05表示差异有统计学意义。
2 结果
2.1 ANK2基因在鼻咽癌组织和细胞中的表达ANK2 mRNA在鼻咽部炎症组织和鼻咽癌组织中的表达水平分别为(1.05±0.08)、(2.57±0.19)。与鼻咽部炎症组织比较,鼻咽癌组织中ANK2 mRNA表达升高(t=53.119,P<0.001)。ANK2 mRNA在NP69细胞、鼻咽癌细胞6-10B和5-8F中的表达水平分别为(1.06±0.09)、(2.34±0.16)、(2.95±0.21)。与 NP69细胞比较,鼻咽癌细胞6-10B和5-8F中ANK2 mRNA表达升高(t=20.918,P<0.001;t=24.817,P<0.001)。由于鼻咽癌5-8F细胞中ANK2 mRNA表达水平高于6-10B细胞,因此选择5-8F细胞进行后续实验。
2.2 ANK2基因表达与鼻咽癌临床病理特征的关系ANK2高表达与鼻咽癌病人肿瘤分化程度、TNM分期和淋巴结转移密切相关(P<0.05),与病人年龄、性别无关(P>0.05)。结果见表1。
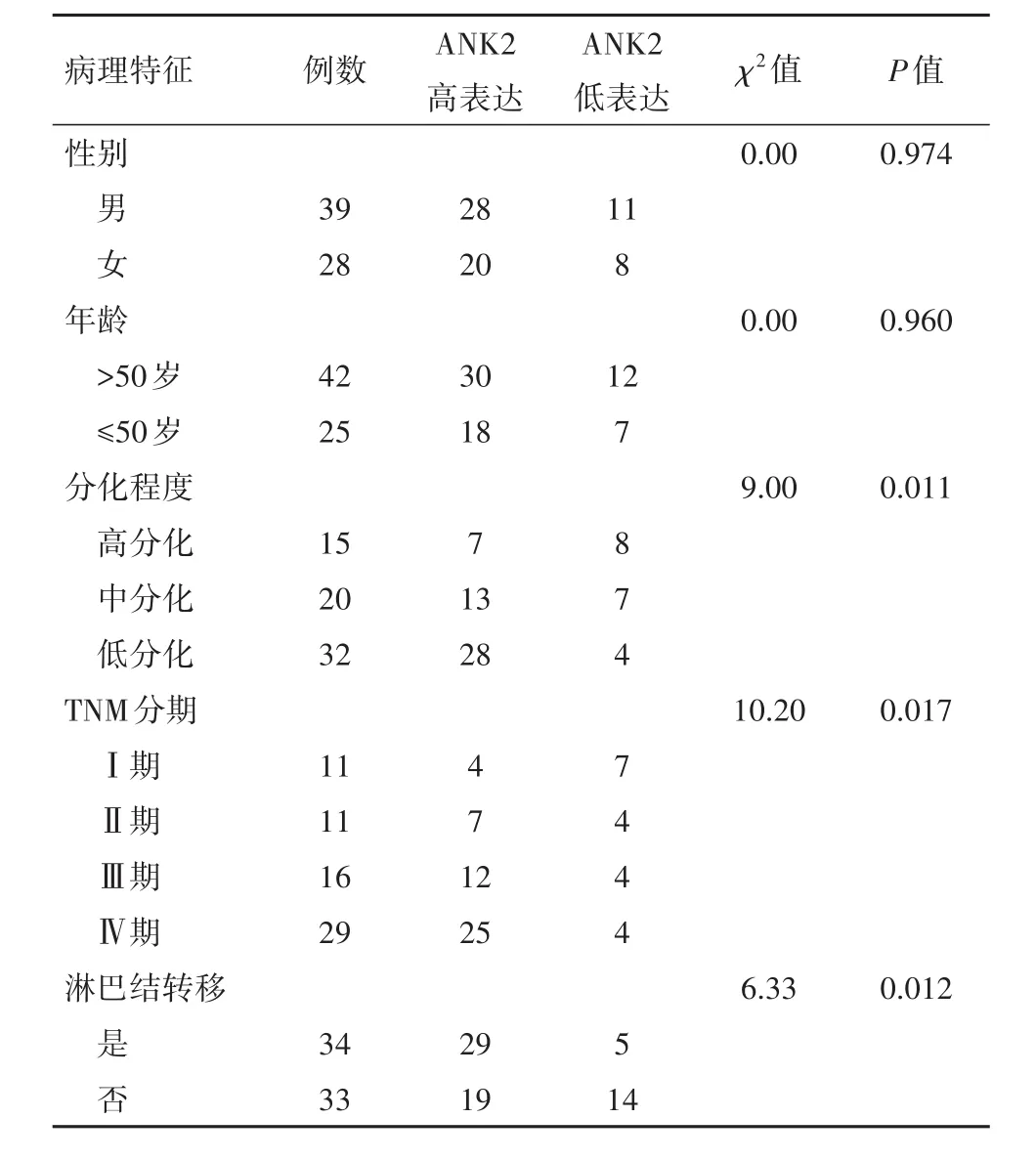
表1 锚蛋白B(ANK2)基因表达与鼻咽癌临床病理特征的关系/例
2.3 ANK2小干扰RNA转染效果验证对照组、si-NC组、si-ANK2组5-8F细胞中ANK2 mRNA表达水平分别为(1.06±0.08)、(1.04±0.07)、(0.36±0.03)。与si-NC组比较,si-ANK2组5-8F细胞中ANK2 mRNA表达水平显著降低(t=26.787,P<0.001)。对照组与si-NC组5-8F细胞中ANK2 mRNA表达水平比较差异无统计学意义(t=0.564,P=0.580)。
2.4 干扰ANK2表达对鼻咽癌细胞增殖、迁移和侵袭的影响si-ANK2组5-8F细胞存活率、迁移数和侵袭数均低于si-NC组(P<0.001)。对照组与si-NC组各检测指标比较差异无统计学意义(P>0.05)。结果见表2。
表2 干扰锚蛋白B(ANK2)表达对5-8F细胞存活率、迁移和侵袭细胞数的影响/±s

表2 干扰锚蛋白B(ANK2)表达对5-8F细胞存活率、迁移和侵袭细胞数的影响/±s
注:①与si-NC组比较,P<0.05。
细胞存活率/%100±3.26 98.64±2.57 45.29±1.23①3 238.05 0.000组别对照组si-NC si-ANK2 F值P值9 9 9重复次数 迁移细胞数142.69±10.24 138.64±10.13 61.21±5.08①244.04 0.000侵袭细胞数102.38±8.71 98.46±8.14 43.98±4.39①178.28 0.000
2.5 干扰ANK2表达对鼻咽癌细胞Wnt/β-catenin信号通路的影响与si-NC组比较,si-ANK2组5-8F细胞p-GSK3βser9、β-catenin和c-myc蛋白水平显著降低(P<0.001)。对照组与si-NC组各检测指标比较差异无统计学意义(P>0.05)。结果见图1和表3。

图1 蛋白质印迹法(Western blotting)检测兔抗人磷酸化糖原合成酶激酶3β(p-GSK3βser9)、β-连环蛋白(β-catenin)和c-myc蛋白表达
表3 干扰锚蛋白B(ANK2)表达对5-8F细胞兔抗人磷酸化糖原合成酶激酶3β(p-GSK3βser9)、β-连环蛋白(β-catenin)和c-myc蛋白表达的影响/±s
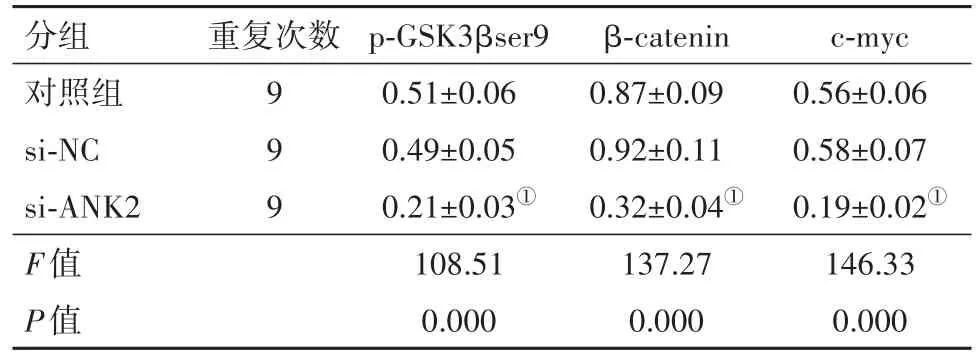
表3 干扰锚蛋白B(ANK2)表达对5-8F细胞兔抗人磷酸化糖原合成酶激酶3β(p-GSK3βser9)、β-连环蛋白(β-catenin)和c-myc蛋白表达的影响/±s
注:①与si-NC组比较,P<0.05。
分组对照组si-NC si-ANK2 F值P值c-myc 0.56±0.06 0.58±0.07 0.19±0.02①146.33 0.000重复次数9 9 9 p-GSK3βser9 0.51±0.06 0.49±0.05 0.21±0.03①108.51 0.000 β-catenin 0.87±0.09 0.92±0.11 0.32±0.04①137.27 0.000
3 讨论
ANK2基因的过度表达在多种肿瘤的发生发展中发挥重要作用。研究显示,干扰ANK2表达可抑制胃癌细胞的增殖和转移,阻滞细胞周期进展[5];ANK2表达的下调有效削弱了胰腺癌细胞的增殖、侵袭和迁移性,下调ANK2可延缓胰腺癌的发展进程[6]。本研究结果显示,ANK2基因在鼻咽癌组织和细胞系中表达升高,其高表达与鼻咽癌病人肿瘤分化程度、TNM分期和淋巴结转移密切相关等临床病理特征密切相关,提示ANK2与鼻咽癌的复发和转移有关;通过进一步转染ANK2小干扰RNA至鼻咽癌细胞后,发现干扰ANK2的鼻咽癌细胞的存活率、迁移数和侵袭数均降低,说明干扰ANK2阻碍了鼻咽癌细胞增殖、迁移和侵袭,这提示ANK2是鼻咽癌治疗的潜在分子靶点。
Wnt/β-catenin信号通路传导与肿瘤的发生发展密切相关,是近年来肿瘤分子学领域研究的热点[7]。在LRP蛋白的作用下,Wnt蛋白作用于Frz蛋白激活细胞内的Dvl蛋白,诱导细胞中的信号转导,使GSK-3β磷酸化并抑制其活性,进而抑制β-catenin降解,使其蓄积[8]。细胞质中游离的β-catenin转入细胞核后,进一步激活下游Cyclin D1、c-myc等靶基因的转录,增强细胞的增殖、迁移和侵袭[9-12]。研究显示,核仁和纺锤体相关蛋白1(NUSAP1)能够通过增强Wnt/β-catenin信号传导促进鼻咽癌细胞的恶性表型,进而促进鼻咽癌的发展进程[13]。本研究结果显示,干扰ANK2表达后,鼻咽癌细胞中p-GSK3βser9、β-catenin和c-myc蛋白表达降低,说明干扰ANK2表达抑制了鼻咽癌细胞中Wnt/β-catenin信号通路,这也可能是干扰ANK2抑制鼻咽癌细胞增殖、迁移和侵袭的原因之一。
综上所述,鼻咽癌组织和细胞系中ANK2基因表达升高,干扰ANK2表达对鼻咽癌细胞的增殖、迁移及侵袭具有显著抑制作用,这可能与干扰ANK2表达抑制了鼻咽癌细胞中Wnt/β-catenin信号通路的激活有关,ANK2有可能成为鼻咽癌的治疗的新靶点。
