微小RNA-766-5p通过调控组氨酸磷酸酶基因表达影响胃癌细胞增殖和放射敏感性
2022-01-27刘国成官一平王成黄国军
刘国成,官一平,王成,黄国军
放疗是胃癌(gastric cancer)的治疗手段之一,可优化病人预后,放疗耐受是临床放疗的主要障碍[1],γ-H2AX含量升高是放疗耐受的标志之一[2-3]。研究胃癌的放疗耐受机制有助于发现其放疗增敏靶点,从而减轻病人痛苦、提高治疗效果。
研究表明,miR-766-5p在结直肠癌组织中表达上调,抑制miR-766-5p可抑制癌细胞的增殖、迁移和侵袭并促进细胞凋亡[4]。miR-766-5p在胃癌中的表达尚不清楚。生物信息学分析发现,组氨酸磷酸酶(phospholysine phosphohistidine inorganic pyrophosphate phosphatase,LHPP)的 3’UTR 区含有与miR-766-5p互补的序列,LHPP在人宫颈癌组织中表达降低,LHPP过表达抑制宫颈癌细胞增殖、迁移和侵袭[5]。而miR-766-5p和LHPP在胃癌中的表达及胃癌细胞增殖、放射敏感性的影响尚未可知。因此,假设miR-766-5p可通过靶向LHPP基因影响胃癌细胞的增殖和放射敏感性。
本研究自2019年2―10月通过以不同放射剂量处理胃癌AGS细胞,检测miR-766-5p和LHPP在AGS细胞中的表达及对AGS细胞增殖和放射敏感性的影响。
1 材料与方法
1.1 材料人胃上皮细胞GES-1及人胃癌细胞系AGS、MGC803、MKN-28和 SGC-7901购 自 美 国ATCC;LHPP抗体、CyclinD1抗体、γ-H2AX抗体和抗β-actin抗体购自Abcam公司;DMEM高糖培养基、RPMI-1640培养基和胎牛血清(fetal bovine serum,FBS)购自美国Gibco公司;Total RNA提取试剂盒、real-time PCR试剂盒、反转录试剂盒(RT-PCR)购自宝生物工程(大连)有限公司;Lipofectamine 2000转染试剂盒购自美国Invitrogen公司;引物、miR-766-5p模拟物(miR-766-5p)、miR-766-5p抑制剂(antimiR-766-5p)、LHPP干扰物(si-LHPP)、阴性对照(miR-con、anti-miR-c006Fn和 si-con)及 LHPP双荧光报告质粒购自上海吉玛制药有限公司;BCA蛋白检测试剂盒购自江苏凯基生物技术股份有限公司。
1.2 方法
1.2.1 细胞培养 将人胃上皮细胞GES-1及人胃癌细胞系AGS、MGC803、MKN-28和SGC-7901培养于含10%FBS和1%青-链霉素的RPMI-1640培养基,在湿度95%、37℃5%二氧化碳培养箱中常规培养。待细胞生长融合为80%时,洗涤,胰蛋白酶消化传代。
1.2.2 细胞转染 收集AGS对数生长期细胞,接种于6孔板(密度为1×l06个/毫升),以不转染的细胞为空白对照(NC)组。细胞融合度达80%时,根据Lipofectamine 2000试剂盒说明书进行操作,将等体积用无血清培养液稀释的脂质体和各组载体(antimiR-con、anti-miR-766-5p、miR-con、miR-766-5p、sicon和si-LHPP)混合,继续培养6h,换成完全培养基,转染48h收集细胞,验证转染结果,进行后续实验。根据转染分组:空白对照NC组、anti-miR-con组、anti-miR-766-5p组、miR-con组、miR-766-5p组、antimiR-766-5p+si-con组、anti-miR-766-5p+si-LHPP组。
1.2.3 Real-time PCR检测RNA的表达 收集人胃上皮细胞GES-1及人胃癌细胞系AGS、MGC803、MKN-28和SGC-7901及转染48 h的AGS细胞,进行总RNA的提取,然后按照反转录PCR试剂盒说明书合成cDNA,取cDNA为模板进行Real-time PCR反应,合成 LHPP mRNA 和 miR-766-5p。运用 2−ΔΔCt法进行数据分析,以β-actin为内参照进行校正。
1.2.4 克隆形成实验测定放射处理后细胞存活分数 取转染后各组AGS细胞,接种于6孔板(1×104个细胞/孔),培养24 h,将细胞在射剂量为0、2、4、6、8 Gy进行照射处理,照射条件为37℃,照射面积10 cm×10 cm,靶距100 cm。照射后每组取500个细胞接种于培养皿中,加入10 mL培养液混匀,培养2周,至出现肉眼清晰可见的细胞克隆,弃培养液并洗涤细胞,4%冷甲醛固定细胞20 min,结晶紫染色30 min,晾干后计数,以所形成的细胞集落>50个为有效菌落。根据GraphPad Prism5单击多靶模型拟合细胞存活曲线,计算放射增敏比(SER)。计算细胞克隆形成率=(细胞克隆数平均值/接种细胞总数)×100%,细胞存活分数(survival fraction,SF)=受照射细胞克隆形成率/对照细胞克隆形成率)×100%。
1.2.5 MTT法测定细胞存活率 收集各组对数生长期的AGS细胞,接种于96孔板中(1×103个细胞/孔),以不加细胞的培养液为空白对照,72h后每孔加入20 μL MTT,培养4 h弃培养上清,每孔再加入150 μL DMSO,酶标仪测定490 nm 吸光度(A)值。细胞存活率=(A实验组-A空白对照组)/(A阴性对照组-A空白对照组)×100%。
1.2.6 蛋白质印迹法(Western blotting)检测蛋白表达 RIPA裂解液加入GES-1细胞和各组胃癌细胞,收集蛋白,测定总蛋白浓度。取蛋白样品进行SDSPAGE,转膜,5%脱脂奶粉封闭2 h,加入一抗稀释液(LHPP抗体1∶800、CyclinD1抗体1∶1 000、γ-H2AX抗体1∶1 000、β-actin抗体1∶2 000),4 ℃孵育过夜,加入稀释的酶标二抗,室温孵育1 h。以β-actin为内参照,分析蛋白表达水平。
1.3 统计学方法数据分析采用SPSS 19.0统计软件进行,结果以±s表示,两组间比较采用独立样本t检验;多组间比较采用单因素方差分析,用LSD法进行两组间的比较。以P<0.05为差异有统计学意义。
2 结果
2.1 胃癌细胞系中miR-766-5p和LHPP的表达与GES-1相比,miR-766-5p在胃癌细胞AGS、MGC803、MKN-28、SGC-7901表达量均显著上升(P<0.05),LHPP mRNA和蛋白的表达量显著下降(P<0.05),见表1。后续实验选择AGS细胞进行研究。
表1 胃癌细胞系中miR-766-5p和LHPP的表达/±s

表1 胃癌细胞系中miR-766-5p和LHPP的表达/±s
注:①与GES-1细胞组比较,P<0.05。
组别GES-1 AGS MGC803 MKN-28 SGC-7901 F值P值LHPP protein 1.08±0.12 0.45±0.05①0.35±0.05①0.30±0.04①0.46±0.05①63.68 0.000重复次数3 3 3 3 3 miR-766-5p 1.00±0.10 3.30±0.24①2.89±0.19①2.05±0.21①1.99±0.19①64.89 0.000 LHPP mRNA 4.46±0.25 0.85±0.09①1.01±0.11①0.75±0.08①0.99±0.10①385.37 0.000
2.2 转染anti-miR-766-5p抑制胃癌细胞系AGS增殖与NC组相比,anti-miR-766-5p组细胞中miR-766-5p表达量降低(P<0.05),LHPP mRNA和蛋白表达量显著上升(P<0.05),CyclinD1表达降低(P<0.05),γ-H2AX表达增多(P<0.05),细胞存活率显著下降(P<0.05),具有统计学意义。表明抑制miR-766-5p表达可抑制AGS细胞增殖。见表2。
表2 转染anti-miR-766-5p对AGS胃癌细胞增殖和相关蛋白表达的影响/±s

表2 转染anti-miR-766-5p对AGS胃癌细胞增殖和相关蛋白表达的影响/±s
注:①与NC组比较,P<0.05。
组别细胞存活率/%重复次数miR-766-5p LHPP CyclinD1γ-H2AX NC anti-miR-con anti-miR-766-5p F值P值100.00±5.16 100.03±3.08 63.49±0.06①110.82 0.000 3 3 3 3.38±0.26 3.40±0.25 1.00±0.10①122.32 0.000 0.42±0.05 0.45±0.05 1.12±0.12①72.67 0.000 1.15±0.11 1.13±0.12 0.45±0.05①49.28 0.000 0.85±0.09 0.88±0.09 1.35±0.14①19.77 0.002
2.3 转染anti-miR-766-5p增加AGS细胞放射敏感性与对照NC相比,anti-miR-766-5p组细胞存活分数随放射剂量的增加呈下降趋势,放射增敏比为1.72。见表3。说明抑制miR-766-5p表达可提高胃癌AGS细胞的放射敏感性。

表3 转染anti-miR-766-5p联合X射线照射对AGS胃癌细胞作用的单击多靶模型的参数值
2.4 miR-766-5p靶向调控LHPP的表达通过TargetScan对miR-766-5p和LHPP结合进行预测显示,LHPP的3’-UTR序列中含有与miR-766-5p互补的核苷酸序列。
构建含有miR-766-5p结合位点的LHPP-3’UTR野生型及突变型报告基因载体,在AGS细胞中转染miR-766-5p mimics和LHPP野生型及突变型报告基因载体,与miR-con组相比,miR-766-5p组LHPP WT荧光素酶活性降低[(0.40±0.05)比(1.05±0.15),P<0.05],而突变型MUT荧光素酶活性无变化。与miR-con组相比,miR-766-5p组的LHPP蛋白表达量显著下降[(0.16±0.03)比(0.45±0.04),P<0.05];与anti-miR-con组相比,anti-miR-766-5p组的LHPP蛋白表达量显著上升[(1.10±0.12)比(0.42±0.05),P<0.05]。说明miR-766-5p靶向负调控LHPP的表达。
2.5 敲减LHPP可以逆转anti-miR-766-5p对AGS细胞增殖和放射敏感性的影响与对照anti-miR-con组相比,anit-miR-766-5p组AGS的细胞存活分数随照射剂量增加逐渐下降,差异有统计学意义(P<0.05),而且LHPP蛋白表达显著增多(P<0.05),CyclinD1表达下降(P<0.05),γ-H2AX表达增多(P<0.05),细胞存活率显著降低(P<0.05),放射增敏比SER为 1.641;与miR-766-5p+si-con组相比,miR-766-5p+si-LHPP组的细胞存活分数显著升高(P<0.05),LHPP表达显著减少(P<0.05),CyclinD1表达上升(P<0.05),γ-H2AX表达减少(P<0.05),细胞存活率显著上升(P<0.05),放射增敏比SER为0.604,见表4,5。说明敲减LHPP可逆转anti-miR-766-5p对AGS细胞增殖和放射敏感性的作用。
表4 敲减LHPP可以逆转anti-miR-766-5p对AGS细胞增殖和相关蛋白的影响/±s
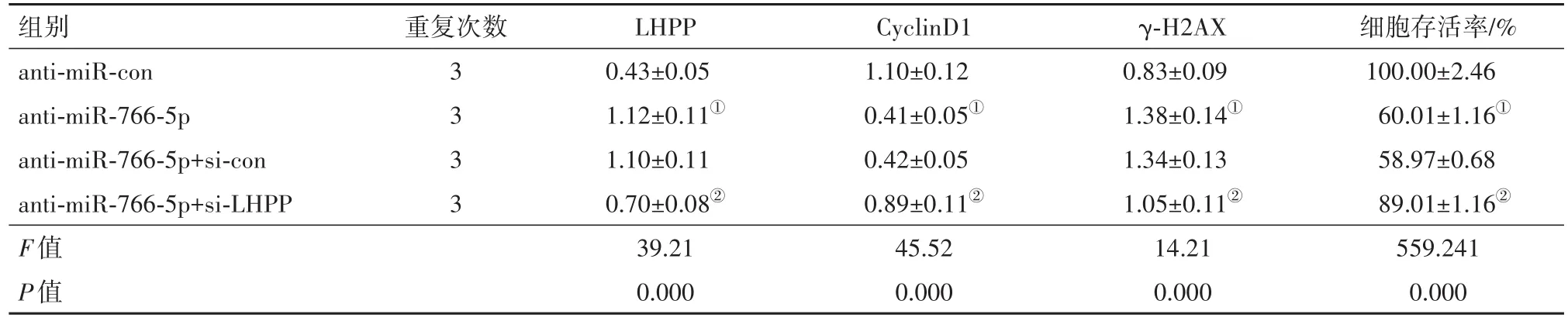
表4 敲减LHPP可以逆转anti-miR-766-5p对AGS细胞增殖和相关蛋白的影响/±s
注:①与anti-miR-con组比较,P<0.05。②与anti-miR-766-5p+si-con组比较,P<0.05。
组别anti-miR-con anti-miR-766-5p anti-miR-766-5p+si-con anti-miR-766-5p+si-LHPP F值P值细胞存活率/%100.00±2.46 60.01±1.16①58.97±0.68 89.01±1.16②559.241 0.000重复次数3 3 3 3 LHPP 0.43±0.05 1.12±0.11①1.10±0.11 0.70±0.08②39.21 0.000 CyclinD1 1.10±0.12 0.41±0.05①0.42±0.05 0.89±0.11②45.52 0.000 γ-H2AX 0.83±0.09 1.38±0.14①1.34±0.13 1.05±0.11②14.21 0.000
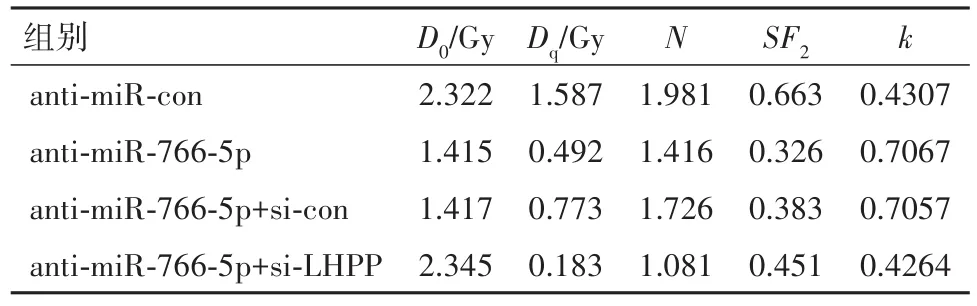
表5 各组AGS细胞转染处理联合X射线照射对AGS胃癌细胞作用的单击多靶模型的参数值
3 讨论
胃癌是全球癌症相关死亡的第三大原因,其5年生存率约为25%,在确诊时4%的病人已发生转移[6]。放射抵抗和耐受是癌症转移和复发的主要原因,严重威胁病人生存质量。γ-H2AX在多种癌症中表达异常,与辐射导致DNA双链断裂的修复有关,是放疗耐受的主要标志物之一[7]。
研究表明,miRNA在胃癌中表达异常,以抑癌或致癌的作用影响着胃癌的发生发展,在临床中具有诊断和预后标志物及化疗工具等作用[8]。miR-766-5p在结直肠癌组织中含量显著高于正常组织,抑制其表达可靶向癌细胞侵袭抑制因子(SCAI)抑制癌细胞的增殖、迁移和侵袭,促进细胞凋亡[4]。miR-766在肝细胞癌组织中表达上调并与病人预后有关,通过靶向NR3C2促进癌症进展[9]。Wang等[10]通过对多个肿瘤细胞系研究发现,miR-766通过直接靶向p53抑制因子MDM4来提高p53水平和信号活性,增强了p53介导的细胞周期阻滞和增殖抑制。miR-766-5p在胃癌中的表达和作用尚不清楚。本研究发现,miR-766-5p在胃癌细胞AGS、MGC803、MKN-28和SGC-7901中表达量均显著上升,提示抑制miR-766-5p表达可抑制胃癌AGS细胞增殖并增强细胞的放射敏感性。另外,本研究通过发现,LHPP与miR-766-5p存在互补结合位点,双荧光素酶报告实验检测显示miR-766-5p可能调控LHPP的表达。LHPP是无机焦磷酸酶,也是一种蛋白组氨酸磷酸酶和肿瘤抑制因子,在肝细胞癌病人中,LHPP的低表达与肿瘤的严重程度增加和总体生存率降低有关[11]。基因组研究表明,LHPP与多种疾病的发生有关,包括抑郁症[12]、三阴性乳腺癌[13]、急性淋巴细胞白血病(ALL)[14]。李德馨等[15]最新研究表明,LHPP在低分化胃腺癌中表达下调,且与腺癌的分化程度相关。体外和体内实验表明,iDPP/LHPP纳米复合物对黑色素瘤生长有明显抑制作用,且无明显不良反应[16]。LHPP在膀胱癌组织和细胞中被下调,促进癌细胞的增殖和生长,LHPP可通过失活AKT/p65信号通路抑制膀胱癌细胞增殖和生长[17]。本研究结果表明,LHPP在胃癌细胞AGS、MGC803、MKN-28和SGC-7901中表达量均显著下调,与李德馨等结果一致。进一步的实验结果表明,敲减LHPP可逆转抑制miR-766-5p对AGS细胞增殖和放射敏感性的作用,证实了miR-766-5p和LHPP在胃癌细胞中存在调控关系。
本研究阐述了在胃癌AGS、MGC803、MKN-28和SGC-7901细胞系中,miR-766-5p表达上调,LHPP表达下调。在胃癌AGS细胞中,抑制miR-766-5p可靶向促进LHPP表达,进而增强胃癌AGS细胞的放射敏感性,抑制癌细胞增殖。miR-766-5p是胃癌潜在的放射增敏靶点。
研究还表明,LHPP在宫颈癌组织和细胞系中也低表达,其过度表达可通过抑制AKT的激活降低细胞增殖、迁移和侵袭[5]。在结直肠癌细胞中过表达LHPP通过PI3K/AKT通路抑制结直肠癌细胞增殖[18]。在结直肠癌中下调miR-766-5p可抑制癌症进展[9]。因此推测miR-766-5p可能通过PI3K/AKT通路靶向LHPP抑制胃癌并增强其放射敏感性。下一步将研究miR-766-5p和LHPP在胃癌病人样本中的表达,及对肿瘤转移、侵袭,进一步探讨miR-766-5p和LHPP对胃癌临床诊断和治疗中的作用。
