TOLL样受体9/激活蛋白-1信号通路在过敏性鼻炎中的作用
2022-01-27王骏李世东景阳杨颖朱旭丽贠勇刚
王骏,李世东,景阳,杨颖,朱旭丽,贠勇刚
过敏性鼻炎为耳鼻喉科常见临床疾病,随着生活环境的改变,发病率呈逐年增高的趋势[1]。且过敏性鼻炎与其他多种呼吸系统疾病的发生发展均密切相关,研究表明,患过敏性鼻炎的病人,发生哮喘的比率明显高于其他人群[2]。过敏性鼻炎的机制复杂,相关因素较多。大多研究认为,由炎症递质引发的免疫细胞合成的相关细胞因子白细胞介素-4(IL-4)、白细胞介素-5(IL-5)等均参与了过敏性鼻炎的发病机制中[3]。目前认为,过敏性鼻炎是由免疫球蛋白E(IgE)介导的I型变态反应。TOLL样受体(TLRs)家族在机体免疫反应中发挥重要作用,TLRs与相应的配体结合后,能够通过相应的信号通路,介导机体炎症和免疫反应的发生[4]。激活蛋白-1(AP-1)是支气管哮喘发病的关键因子,处于TLR9信号通路下游。得到证实,通过抑制TLR9/AP-1信号通路能够有效控制哮喘的发作[5]。本研究自2019年3—8月研究TLR9/AP-1信号通路在过敏性鼻炎中的作用机制,报告如下。
1 材料与方法
1.1 实验动物及分组清洁级健康雄性SD大鼠48只,体质量200~300 g,购于陕西省人民医院实验动物中心,在安静、温暖(18~25℃)、避强光、昼夜光照节律的实验室饲养1周后供本研究实验所用,自由饮水和摄食。为每只SD大鼠编号,按照随机数字表法分为对照组、实验组、干预组,每组16只。本研究中对于大鼠的处理符合动物伦理学相关标准。
1.2 方法
1.2.1 动物模型制备 实验组、干预组大鼠参考文献[6]中的方法进行过敏性鼻炎大鼠的动物模型制备:造模第1天,将卵清蛋白(OVA)0.3 mg、氢氧化铝30 mg溶于1 mL生理盐水中,腹腔注射。第15~21天,每日每侧鼻孔滴入4%的OVA 50 μL;1%OVA雾化吸入5 min。末次滴鼻致敏后,1、2、3、6 h观察大鼠鼻痒、喷嚏、清涕等行为,根据参考文献[6]中记分方法总分大于5分为造模成功。对照组操作步骤与实验组、干预组相同,腹腔注射、鼻滴、雾化吸入均使用生理盐水。
1.2.2 干预措施 干预组造模成功后给予0.05%丙酸氟替卡松0.1 mL滴鼻;实验组造模成功后给予生理盐水0.1 mL滴鼻;对照组给予生理盐水0.1 mL滴鼻,三组均每日1次,共7次。
1.2.3 标本采集 血液标本采集:将各组16只大鼠按照随机数字表法分为两组,每组8只,分别于末次干预后6、12 h采用腹主动脉抽血法处死。采集血液后抗凝,离心,采集血清。鼻黏膜组织采集:大鼠处死后,从鼻背正中缝处裂开鼻腔,剥离下鼻黏膜组织−70℃冻存。
1.2.4 观察指标及检测方法 应用酶联免疫吸附测定(ELISA)法检测血清中TNF-α、IL-4、IgE含量(检测试剂盒购于北京中杉金桥生物有限公司)。参考文献[6]中方法对鼻痒、喷嚏、清涕进行评分,评分越高表明上述症状越严重。蛋白质印迹法(Western blotting)检测各组大鼠鼻黏膜组织中CFos、C-Jun表达。
1.3 统计学方法实验数据应用SPSS 22.0软件分析,正态计量资料用±s表示,两样本均数比较采用独立样本t检验,多个样本均数间比较采用单因素方差分析,多组之间两两比较采用SNK-Q检验的方法。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠干预后血清IgE、IL-4、TNF-α水平比较统计结果显示,实验组、对照组大鼠干预后6、12 h的血清IgE、IL-4、TNF-α水平均差异无统计学意义(P>0.05)。干预组大鼠,干预后12 h的血清IgE、IL-4、TNF-α水平均明显低于干预后6 h,差异有统计学意义(P<0.01)。干预后6、12 h,实验组大鼠血清IgE、IL-4、TNF-α水平均明显高于对照组,干预组大鼠血清IgE、IL-4、TNF-α水平均明显低于实验组,差异有统计学意义(P<0.01)。见表1。
表1 各组大鼠干预后血清免疫球蛋白E(IgE)、白细胞介素-4(IL-4)、肿瘤坏死因子-α(TNF-α)水平比较/±s
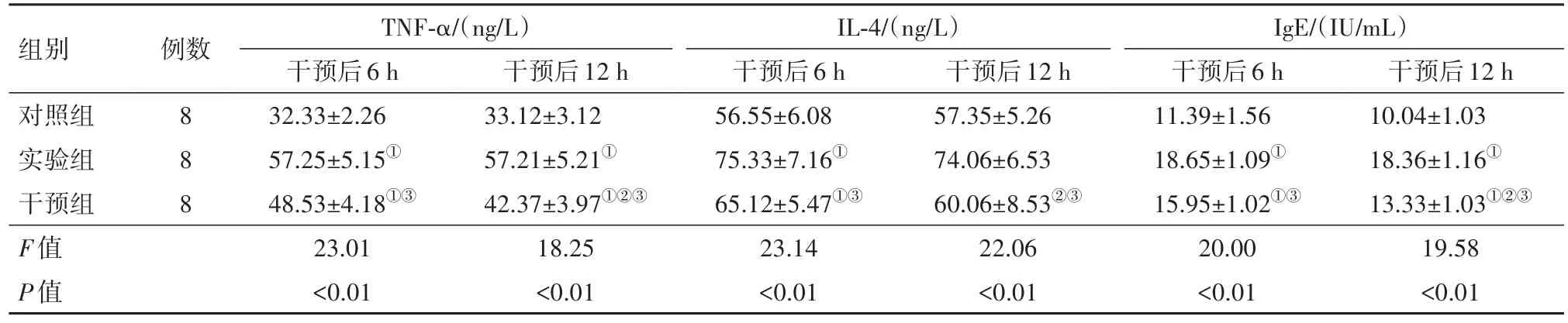
表1 各组大鼠干预后血清免疫球蛋白E(IgE)、白细胞介素-4(IL-4)、肿瘤坏死因子-α(TNF-α)水平比较/±s
注:①与对照组比较,P<0.05。②与干预后6 h比较,P<0.05。③与实验组比较,P<0.05。
组别对照组实验组干预组F值P值干预后12 h 10.04±1.03 18.36±1.16①13.33±1.03①②③19.58<0.01例数8 8 8 TNF-α/(ng/L)干预后6 h 32.33±2.26 57.25±5.15①48.53±4.18①③23.01<0.01干预后12 h 33.12±3.12 57.21±5.21①42.37±3.97①②③18.25<0.01 IL-4/(ng/L)干预后6 h 56.55±6.08 75.33±7.16①65.12±5.47①③23.14<0.01干预后12 h 57.35±5.26 74.06±6.53 60.06±8.53②③22.06<0.01 IgE/(IU/mL)干预后6 h 11.39±1.56 18.65±1.09①15.95±1.02①③20.00<0.01
2.2 各组大鼠干预后鼻痒、喷嚏、清涕评分比较统计结果显示,实验组、对照组大鼠干预后6、12 h的鼻痒、喷嚏、清涕评分均差异无统计学意义(P>0.05)。干预组大鼠,干预后12 h的鼻痒、喷嚏、清涕评分均明显低于干预后6 h,差异有统计学意义(P<0.01)。干预后6、12 h,实验组大鼠鼻痒、喷嚏、清涕评分均明显高于对照组,干预组大鼠鼻痒、喷嚏、清涕评分均明显低于实验组,差异有统计学意义(P<0.01)。见表2。
表2 各组大鼠鼻痒、喷嚏、清涕评分比较/(分,±s)
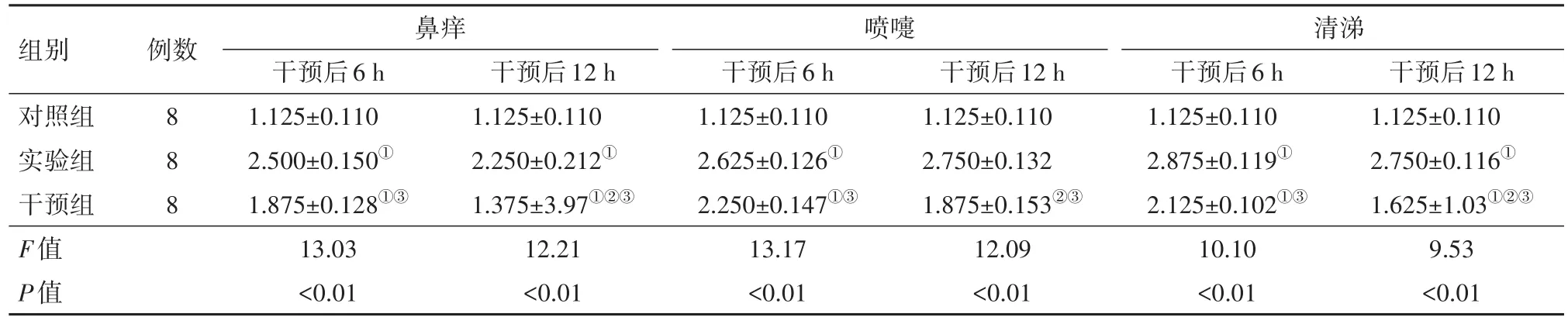
表2 各组大鼠鼻痒、喷嚏、清涕评分比较/(分,±s)
注:①与对照组比较,P<0.05。②与干预后6 h比较,P<0.05。③与实验组比较,P<0.05。
组别对照组实验组干预组F值P值干预后12 h 1.125±0.110 2.750±0.116①1.625±1.03①②③9.53<0.01例数8 8 8鼻痒干预后6 h 1.125±0.110 2.500±0.150①1.875±0.128①③13.03<0.01干预后12 h 1.125±0.110 2.250±0.212①1.375±3.97①②③12.21<0.01喷嚏干预后6 h 1.125±0.110 2.625±0.126①2.250±0.147①③13.17<0.01干预后12 h 1.125±0.110 2.750±0.132 1.875±0.153②③12.09<0.01清涕干预后6 h 1.125±0.110 2.875±0.119①2.125±0.102①③10.10<0.01
2.3 各组大鼠鼻黏膜组织中C-Fos、C-Jun表达水平比较实验组大鼠鼻黏膜组织中C-Fos、C-Jun灰度值明显高于对照组,干预组大鼠鼻黏膜组织中CFos、C-Jun明显低于实验组,差异有统计学意义(P<0.01)。见表3。图1。
表3 蛋白质印迹法(Western Blotting)检测各组大鼠鼻黏膜组织中C-Fos、C-Jun灰度值/±s

表3 蛋白质印迹法(Western Blotting)检测各组大鼠鼻黏膜组织中C-Fos、C-Jun灰度值/±s
注:①与对照组比较,P<0.05。②与实验组比较,P<0.05。
组别对照组实验组干预组F值P值C-Fos 0.425±0.050 0.850±0.012①0.575±0.047①②10.29<0.01例数8 8 8 C-Jun 0.425±0.030 0.950±0.052①0.615±0.047①②11.57<0.01

图1 各组大鼠鼻黏膜组织中C-Fos、C-Jun表达
3 讨论
TLRs家族在机体免疫反应中发挥重要作用,能通过识别相关分子诱导体内免疫应答的发生。呼吸道鼻黏膜富含巨噬细胞、树突状细胞等,具有较高水平的TLRs表达[7]。TLRs与相应的配体结合后,能够通过相应的信号通路,介导机体炎症反应的发生,以及免疫细胞对外来抗原的杀伤作用。大量的研究结论均证实,TLR受到病原体的刺激后,能够通过激活多个信号传导通路诱导相关基因的表达,参与体内炎症反应、免疫反应的发生发展[8-10]。AP-1是调节细胞生存和死亡途径的关键转录因子,能通过调节细胞因子、生长因子等的分泌,参与细胞的增殖、炎症等过程[11]。徐甜等[12]在研究中对药物治疗过敏性鼻炎的靶点进行筛选,研究结果显示,药物抗过敏性鼻炎的作用机制可能与AP-1、肿瘤坏死因子-α等有关。AP-1处于TLR9信号通路下游,由C-Jun、C-Fos核蛋白构成。已经得到证实,AP-1是支气管哮喘发病的关键因子,AP-1的水平与哮喘病人的症状严重程度呈正相关关系[13]。通过抑制AP-1及其下游因子的释放和分泌(IgE、IL-4、TNF-α等),能有效控制哮喘的发作[14]。
过敏性鼻炎为I型变态反应,是一种Th2偏离性慢性炎症反应。Th2细胞可通过分泌IL-4、IL-5等细胞因子促进B淋巴细胞合成IgE,IgE通过与肥大细胞与嗜碱性粒细胞的结合,释放组胺、白三烯等多种炎性递质,引起喷嚏、流涕等症状的发生[15]。TNF-α是具有多种生物学活性细胞因子,在机体免疫调节中发挥重要作用[16]。本研究中,通过检测各组大鼠血中IgE、IL-4、TNF-α的含量,反映体内炎性递质的水平。本研究统计结果显示,实验组、干预组干预后的IgE、IL-4、TNF-α水平均明显高于对照组,说明上述因子参与了过敏性鼻炎的发生。进一步统计发现,干预组IgE、IL-4、TNF-α水平、症状评分均明显低于实验组,说明经过药物的干预,能够对体内炎症水平和免疫反应发挥一定的抑制作用,能够明显改善过敏性鼻炎的症状。
为了进一步分析TLR9/AP-1信号通路在过敏性鼻炎中的作用,经Western blotting实验检测了各组大鼠干预后鼻黏膜组织中C-Fos、C-Jun的表达情况。结果证实,C-Fos、C-Jun 的表达情况与 IgE、IL-4、TNF-α的变化基本同步,说明TLR9/AP-1信号通路参与了过敏性鼻炎的发病过程,药物治疗可通过作用于该信号通路发挥有效的治疗效果。可见,药物治疗过敏性鼻炎的机制与抑制TLR9/AP-1信号通路及其下游因子的释放和分泌有关。
