秸秆还田方式对根际固氮菌群落及花生产量的影响
2022-01-25邱文静胡凯婕徐勤松蒋瑀霁
邱文静,栾 璐,郑 洁,3,胡凯婕,徐勤松,孙 波,蒋瑀霁*
(1 南京师范大学生命科学学院,江苏南京 210023;2 土壤与农业可持续发展国家重点实验室/中国科学院南京土壤研究所,江苏南京 210008;3 中国科学院大学,北京 100049)
氮是核苷酸、蛋白质和叶绿素的基本成分,是主要的植物营养元素之一。自然界中的氮素大部分以N2形式存在,大多数植物不能直接利用,因此氮也是最常见的作物生长限制性营养元素。目前,我国高强度集约化的作物生产系统严重依赖于氮肥施用,但施加的氮肥仅部分被植物吸收利用,其余则以含氮气体的形式进入大气,或以硝酸盐的形式淋溶进入水体[1–2]。大量施用氮肥在增产的同时破坏了土壤的氮素平衡,造成土壤板结、水体富营养化等问题[3]。如何减少氮肥施用,保障粮食安全是我国当前亟需解决的关键问题。
生物固氮是指固氮微生物通过固氮酶的作用将氮气转化为氨供植物吸收利用。据统计,生物固氮每年向陆地生态系统贡献4000~10000 万t氮,是农业生态系统中氮素的主要来源之一[4]。固氮菌中编码铁蛋白组分的nifH基因高度保守,因此常作为分子标记基因被广泛用于研究土壤固氮微生物多样性和群落组成[5]。固氮微生物作为土壤微生物类群中的重要组成部分,其多样性和群落结构可以影响土壤固氮的功能活性,调控土壤氮素循环平衡[6]。固氮菌不仅可以直接提供氮素促进植物生长,还能刺激宿主根呼吸速率,增强植物对氮磷营养元素的吸收。大量研究表明固氮微生物的丰度、多样性以及活性受到施肥管理和种植方式等多种因素的综合影响[7–9]。长期单施化肥或化肥配施秸秆会降低固氮菌多样性,显著改变其群落结构,而秸秆配施畜禽粪肥提高了固氮微生物的多样性[10]。Wakelin等[11]研究发现秸秆还田使农田土壤中非共生固氮菌丰度增加一倍,对维持固氮菌多样性起到了重要作用。当前,不同秸秆还田方式如何影响根际固氮微生物多样性和群落组成尚不明确。
东南丘陵区红壤地处热带和亚热带,水热资源丰富,农业生产与经济发展潜力巨大,是我国经济作物及粮食作物的重要基地,在农业可持续发展和生态环境建设中发挥着重要作用[12]。由于长期对耕地的不合理利用,导致土壤碳氮库容下降,固氮微生物多样性降低,其群落结构和功能活性退化,氮素平衡供应能力失调。因此,本研究以中低产田旱地红壤为研究对象,通过高通量测序技术,研究不同秸秆还田条件下根际固氮微生物多样性与群落组成特征,解析根际固氮菌群落对花生产量的潜在作用机制和影响程度,为建立红壤生态系统合理的秸秆还田措施,快速提升红壤质量与健康提供科学指导。
1 材料与方法
1.1 研究区概况
田间试验于2011年设置在江西省鹰潭市中国科学院红壤生态实验站 (116˚55′E、28˚13′N),属中亚热带季风气候,年均温17.8℃,年均降水量1795 mm。小区面积为 100 m2(5 m × 20 m)。供试土壤为第四纪红黏土发育的红壤(黏化湿润富铁土),原始植被为稀疏马尾松林。红壤呈强酸性,养分和有机质含量低,阳离子交换量低。试验前耕层土壤(0—20 cm)基本性状为:pH 4.73、有机碳 4.20 g/kg、全氮 0.43 g/kg、全磷 0.28 g/kg、全钾 11.05 g/kg、有效磷 1.73 mg/kg、速效钾 64.17 mg/kg、硝态氮 1.99 mg/kg 和铵态氮 5.61 mg/kg。
1.2 长期定位试验处理
本试验共设置5个施肥处理,分别为1)对照(CK):不施肥,只种花生;2)单施化肥(NPK):常规氮磷钾(NPK)肥;3)NPK肥+秸秆还田(NPKS);4)NPK肥+秸秆猪粪配施(NPKSM):秸秆猪粪配施按9∶1碳投入配比;5)NPK肥+秸秆生物质炭(NPKB)。所有处理均为花生单作(4—7月份),每个处理重复3次,随机区组排列。化肥施用量为:N 150 kg/hm2(尿素)、P2O575 kg/hm2(钙镁磷肥)和 K2O 60 kg/hm2(氯化钾),秸秆还田处理 (NPKS、NPKSM和NPKB)按照等碳量(1000 kg/hm2)计算秸秆、猪粪和生物质炭的施用量;秸秆生物质炭为水稻秸秆在生物炭炉中450℃下厌氧闷烧获得,所有肥料作基肥,播种前一次施入。
1.3 样品采集及分析方法
花生植株样品和根际土壤于2019年花生成熟期采集。每个小区随机选取10株花生,用不锈钢铲将整个根系挖出,轻轻抖掉表面的土壤,然后将剩余附着于花生根表面的土(2~4 mm)分离下来,混合均匀后用四分法取50 g土样,一部分风干后测定土壤化学性质,另一部分鲜样保存在−80℃冰箱,用于测定土壤固氮菌群落组成。花生成熟后人工采摘脱粒、风干后,计算每个试验小区的花生产量。
土壤pH采用电位计法测定[13],土壤有机碳采用重铬酸钾氧化法测定,全氮采用凯氏消煮法测定,全磷采用高氯酸–硫酸消煮—钼锑抗比色法测定,有效磷采用碳酸氢钠提取—钼锑抗比色法测定,速效钾采用原子吸收分光光度法测定,铵态氮和硝态氮采用流动分析仪测定。
1.4 DNA提取与高通量测序
采用基因组DNA纯化试剂盒(Fast DNA SPIN for Soil Kit)提取土壤中总基因组DNA,利用1%琼脂糖凝胶电泳检测基因组DNA纯度,采用Nano Drop分光光度计检测DNA浓度以及DNA 在230、260和280 nm波长下的吸光值,分析DNA质量和纯度。选用固氮菌特异性引物nifHF (5′–TGYGA YCCNAARGCNGA–3′)和nifHR (5′–ADNGCCA TCATYTCNCC-3′)对固氮微生物nifH基因进行聚合酶链式反应(PCR)扩增。PCR 采用TransStart Fastpfu DNA 聚合酶,20 μL 反应体系:5 × FastPfu Buffer 4 μL、2.5 mmol/L dNTPs 2 μL、5 μmol/L PCR 引物 0.8 μL、FastPfu Polymerase 0.4 μL、Template DNA 10 ng,ddH2O补充至20 μL。扩增程序:95℃预变性5 min;95℃ 变性 30 s,55℃ 退火 30 s,72℃ 延伸 45 s,35个循环;72℃延伸10 min。每个样本3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测。参照电泳结果,对PCR产物进行检测定量,按照每个样本的测序量要求,进行相应比例的混合。
通过Illumina MiSeq测序平台进行高通量测序。为了提高测序数据的质量,原始序列经QIIME(quantitative insights into microbial ecology)软件质控和过滤后,共获得655802条序列。采用Usearch软件将高质量序列聚类成可操作分类单元(operational taxonomic unit,OTU),按照97%相似性对非重复序列(不含单序列)进行OTU聚类,去除嵌合体,最终获得1649个OTU,选择每个OTU中最长的序列作为代表序列,参考 RDP (ribosomal database project)数据库中微生物功能基因序列的FunGene (Functional Gene)数据库,对每个代表序列进行比对,采用RDPclassifier贝叶斯算法对OTU代表序列进行分类学分析,并分别在各个分类水平:domain (域),kingdom (界),phylum (门),class (纲),order (目),family (科),genus (属),species (种)统计各样本的群落组成。进一步将每个样本稀释到相同测序浓度(22882条)后进行后续分析。
1.5 数据处理与统计
1.5.1 固氮菌Alpha多样性计算 Alpha多样性指数可用于表征区域群落内样本的群落多样性和丰富度,本研究固氮菌所采用的多样性指数有两种,分别是Shannon指数和Chao1指数。Shannon指数越大,说明群落多样性越高;Chao1指数越高,说明样本中物种丰富度越高。
Shannon指数:

式中:S—所测得的全部物种数;ni—第i个物种中所含的个体数;N—总的个体数量。
Chao1指数:

式中:SChao1—估计的OTU数;Sobs—实际观测到的OTU 数;n1—只含有一条序列的OTU数;n2—只含有两条序列的OTU数。
1.5.2 随机森林模型 随机森林模型用于定量计算驱动固氮菌群落变化及提升花生产量的重要预测因子,包括土壤性质和固氮菌群落。土壤性质包括pH、土壤有机碳、全氮、全磷、有效磷、速效钾、NO3−-N 和 NH4+-N含量,固氮菌群落包括群落组成(PCoA1)、多样性(Shannon指数和Chao1指数)。将样本随机分为两部分,其中约 2/3作为训练数据集,其余样本作为“袋外”数据集。当预测变量随机排列时,通过观察值与预测值之间均方误差(MSE)的增加值来评估每个因素的重要性。使用R语言中randomForest程序包进行计算,模型和预测变量的重要性分别使用“A3”和“rfPermute”程序包计算。
1.5.3 SEM结构方程模型 使用AMOS 23.0的最大似然评估方法进行结构方程模型(SEM)分析。SEM用于估算非生物和生物变量对花生产量直接和间接的贡献程度。SEM需要根据与花生产量相关的因素构建先验模型,排除导致模型拟合性变差的预测因素。根据非显著性卡方检验(P> 0.05),拟合优度指数(GFI)和近似均方根误差(RMSEA)等指标检查模型是否构建成功。
1.5.4 数据分析 用SPSS 26.0进行方差分析(ANOVA),结果用3次重复实验的平均值±标准差表示,不同处理间各指标利用Tukey法进行单因素方差分析,不同字母表示样本间差异显著(P< 0.05)。采用Pearson双侧检验法进行相关性分析。多元统计分析利用Rstudio软件在R 4.0.3中完成,其中固氮微生物多样性和群落组成的主坐标分析(PCoA)使用vegan 程序包完成。文中图均在GraphPad Prism 8.0.2软件中完成。
2 结果与分析
2.1 不同秸秆还田处理下土壤化学性质和花生产量的变化特征
不同秸秆还田处理下的土壤化学性质差异显著(表1)。红壤pH呈酸性,NPKSM处理显著高于NPK处理(P< 0.05)。秸秆还田后,土壤有机碳含量上升,在NPKB处理土壤中含量最高,分别是CK和NPK处理的2.77和2.15倍。全氮、全磷、有效磷、速效钾和NO3−-N 含量都遵循 NPKSM > NPKB≈ NPKS > NPK > CK。相比 CK 和 NPK 处理,NPKSM处理全氮含量分别增加1.96和1.61倍,全磷含量分别增加2.92和1.65倍,有效磷含量分别增加92.79和8.42倍,速效钾含量分别增加2.94和1.77倍,NO3−-N含量分别增加3.09和1.51倍。NH4+-N含量虽无显著变化,但NPKB处理中含量最低,NPK处理中含量最高。相比CK和NPK处理,NPKSM处理显著增加了花生产量 (图1,P< 0.05),NPKS和NPKB处理下花生产量虽有所提升,但差异并不显著 (P> 0.05)。

表1 不同秸秆还田方式对土壤化学性质的影响Table 1 Effects of different straw returning methods on soil chemical properties

图1 不同秸秆还田方式对花生产量的影响Fig. 1 Effects of different straw returning methods on peanut yield
2.2 不同秸秆还田处理下土壤固氮菌的多样性和群落组成
秸秆还田处理改变了固氮微生物的Alpha多样性(图2)。虽然显著性分析结果表明不同处理下固氮菌多样性无显著性差异,但在NPKS处理下Shannon指数最高,相比CK和NPK处理分别增加了15.2%和14.3%。而秸秆还田显著改变了固氮菌群落丰富度,与NPK处理相比,NPKS和NPKSM处理下Chao1指数分别增加了16.2%和6.2%,但NPKB处理下Chao1指数下降了9.6%。随机森林模型评估了固氮菌多样性驱动因子的影响程度,结果显示土壤有效磷是固氮菌Shannon指数和Chao1指数(6.62%和8.73%,P<0.05)最主要的决定因素。

图2 土壤固氮菌多样性的Shannon指数(a)与Chao1指数(c)和对Shannon指数(b)和Chao1指数(d)的随机森林分析Fig. 2 Shannon (a) and Chao1 indices (c) of soil nitrogen-fixing bacterial community,and random forest modelling analysis of soil properties on Shannon (b) and Chao1 indices (d)
基于Bray-Curtis 距离的主坐标分析PCoA发现(图3a),秸秆还田处理下固氮菌群落组成有明显差异 (P= 0.001),PCoA1轴和 PCoA2 轴分别解释了固氮菌群落差异的36.85%和23.95%。NPKS和NPKSM处理群落组成相似,NPK和NPKB处理群落组成相似。随机森林模型分析发现(图3b),速效钾、有效磷、全磷和土壤有机碳含量是固氮菌群落组成的主控因素(17.4%、14.2%、13.9%和8.5%,P< 0.01),其次为土壤 pH (11.0%,P< 0.05)、NH4+-N (8.3%,P< 0.05)和全氮 (7.7%,P< 0.05)。高通量测序结果表明,在门水平上固氮菌群落以α-变形杆菌纲(Alphaproteobacteria,82.5%)为优势类群(图4a),而秸秆还田增加了土壤中蓝藻门丰度(Cyanobacteria,2.0%)。在属水平上固氮菌群落以慢生根瘤菌属(Bradyrhizobium,51.9%)和中间根瘤菌属(Mesorhizobium,24.6%)为优势类群(图4b),NPKS和NPKSM处理中Bradyrhizobium丰度高于NPKB和NPK处理;Mesorhizobium丰度为NPK和NPKB处理最高,其次为NPKS和NPKSM处理。
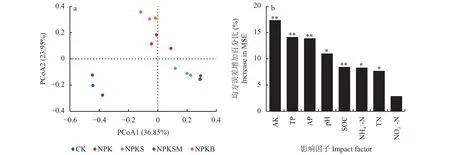
图3 土壤固氮菌群落的主坐标分析(PCoA) (a)和随机森林分析(b)Fig. 3 Primary co-ordinate analysis (PCoA) of soil nitrogen-fixing microbial communities (a) random forest modelling analysis of community composition (b)

图4 土壤固氮菌在门水平 (a)和属水平(b)的组成及相对丰度Fig. 4 Relative abundance of soil nitrogen-fixing bacterial community at the phylum level (a) and genus level (b)
2.3 土壤化学性质、固氮菌群落以及花生产量之间的相关性
Pearson相关性分析表明,土壤pH与β-变形菌纲 (Betaproteobacteria) (P< 0.01)、Mesorhizobium(P<0.05)和副伯克氏菌属 (Paraburkholderia) (P< 0.01)显著负相关,而与γ-变形菌纲(Gammaproteobacteria)显著正相关 (P< 0.05) (图5)。全氮、全磷、有效磷和速效钾与δ-变形菌纲(Deltaproteobacteria)和束藻属(Symploca)显著正相关(P< 0.01);NH4+-N和NO3−-N分别与Betaproteobacteria和Symploca显著正相关(P< 0.05)。花生产量与全磷、有效磷、速效钾及全氮含量,以及Deltaproteobacteria和Symploca显著正相关 (P< 0.01)。
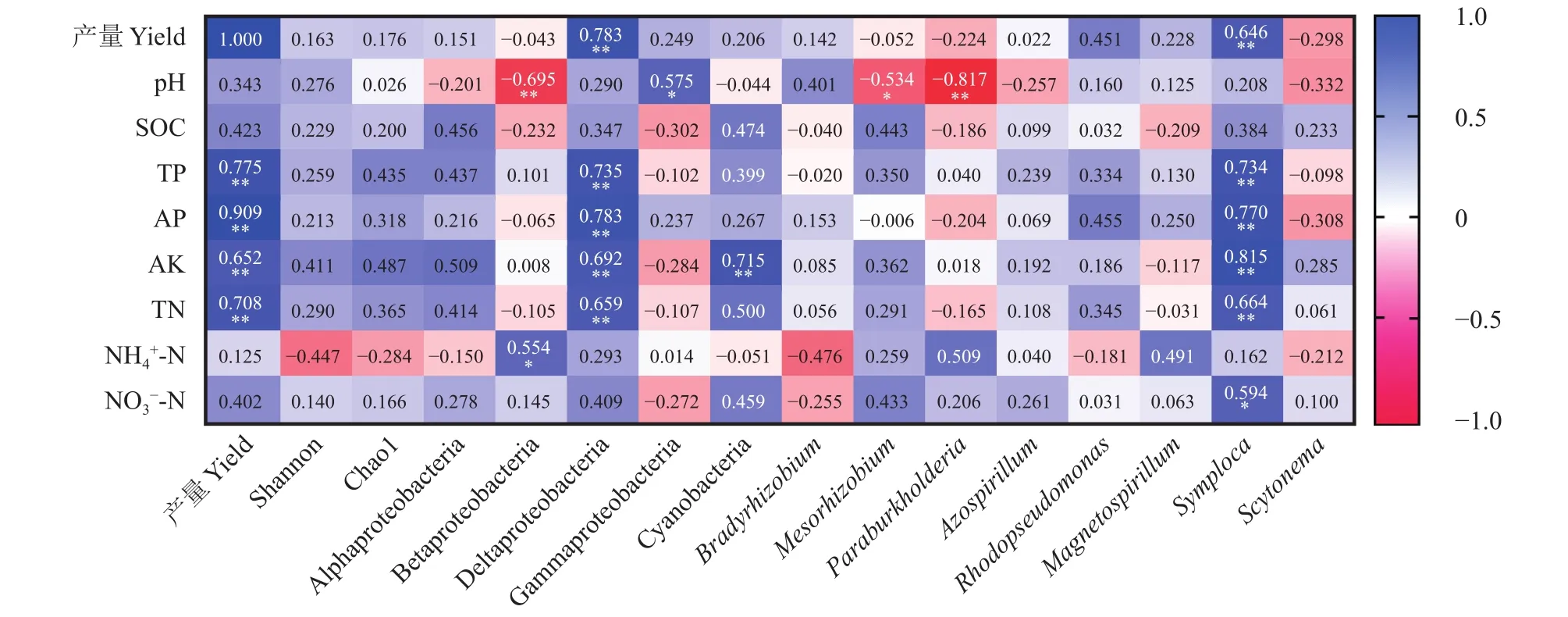
图5 土壤化学性质与固氮菌多样性指数、群落组成及优势类群相对丰度之间相关性Fig. 5 Correlations among soil chemical properties,the diversity and composition of nitrogen-fixing bacterial community,and relative abundance of dominant groups
2.4 随机森林和结构方程模型分析
随机森林模型分析结果(图6)发现,土壤有效磷 (均方误差增加百分比 7.7%,P< 0.01)、全磷 (均方误差增加百分比7.2%,P< 0.05)和全氮(均方误差增加百分比6.7%,P< 0.05)与固氮菌群落组成(均方误差增加百分比7.1%,P< 0.01)是花生产量的主要影响因素。根据Pearson相关性与随机森林模型分析,我们筛选出土壤性质(有效磷、全氮)、固氮菌群落组成、Deltaproteobacteria以及花生产量构建结构方程模型(图6)。结果表明,有效磷对花生产量表现出直接正效应 (路径系数 0.849,P< 0.001),固氮菌的群落组成对花生产量表现出显著负效应(路径系数−0.574,P< 0.05)。此外,有效磷还可以通过Deltaproteobacteria对花生产量表现出显著的正效应(路径系数 0.371,P< 0.05)。因此土壤性质既可以直接影响花生产量,还可以改变Deltaproteobacteria的相对丰度和固氮菌群落组成间接影响花生产量。
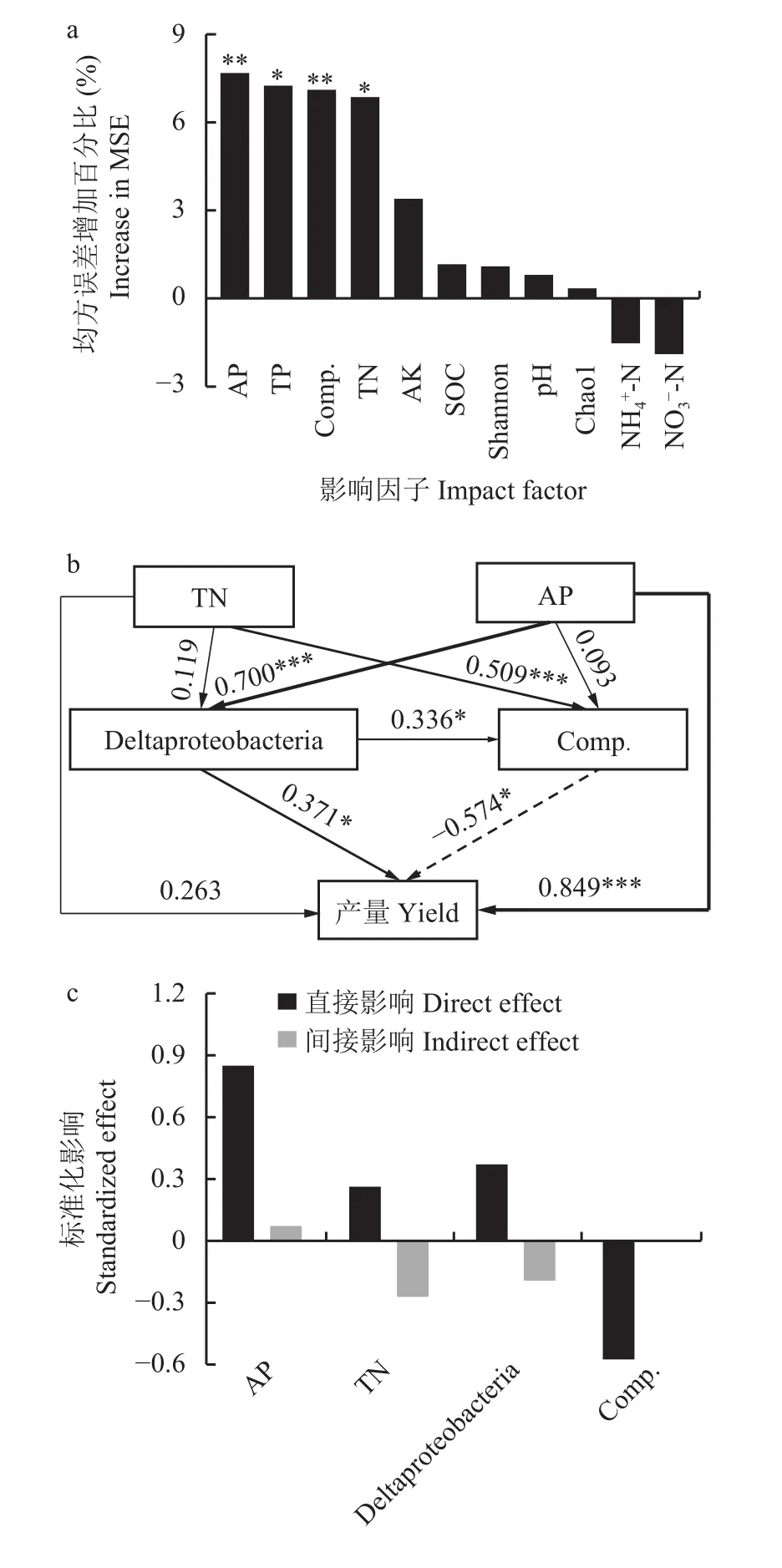
图6 生物因素和非生物因素对花生产量影响的随机森林模型和结构等式模型分析Fig. 6 Effects of biotic and abiotic factors on peanut yield based on random forest modelling and structural equation modelling
3 讨论
3.1 不同秸秆还田处理对固氮菌多样性的影响
秸秆还田能够改变土壤结构以及化学性质,进而驱动土壤微生物多样性变化[14]。我们用Shannon指数表示固氮菌多样性,Chao1指数表征群落丰富度。秸秆还田增加了固氮菌多样性和丰富度,这与Pereg等[15]研究结果一致。但值得注意的是,在NPKB处理下固氮菌丰富度低于NPK处理,这可能是由于生物炭中含有的苯和羟酸类有机化合物对微生物起抑制作用,降低了微生物群落的物种丰富度[16]。施用秸秆和猪粪通过增加土壤肥力显著影响了固氮菌多样性,其中有效磷是影响根际固氮微生物多样性的重要因素。生物固氮是高消耗ATP的过程,调节固氮酶附近的氧浓度,以及构建容纳固氮酶的细胞结构都需要磷元素的参与[17]。此外,我们发现土壤NH4+-N与固氮菌群落多样性和丰富度呈负相关。虽然有研究表明,NH3作为生物固氮的最终产物,其浓度升高能够降低生物固氮速率和固氮酶的活性,进而能够降低固氮菌的生长代谢速率及其群落多样性,但由于植物根系对氮素的吸收利用,减少了向细菌定殖区扩散的矿质氮,从而削弱了NH3对固氮活性的抑制效应[18–19]。
3.2 不同秸秆还田处理对固氮菌群落结构的影响
长期秸秆还田为微生物生长提供丰富资源的同时,驱动了根际微生物群落结构变化[20–21]。本研究发现不同秸秆还田方式能够显著影响土壤固氮菌群落组成,土壤pH、土壤有机碳、速效钾、有效磷、全磷、全氮以及NH4+-N驱动了固氮菌群落组成变化,特别是改变了Alphaproteobacteria、Betaproteobacteria和Cyanobacteria的相对丰度。我们发现固氮微生物群落中Bradyrhizobium是优势属,在NPKS和NPKSM处理下其相对丰度高于NPK和NPKB处理。秸秆还田处理下,NPKS和NPKSM处理对土壤中氮磷元素含量的提升效果比NPK和NPKB处理更好。Bradyrhizobium是一种兼性固氮菌,在土壤养分含量充足的情况下会优先消耗土壤中的营养资源以支持自身生长,并且Bradyrhizobium是参与秸秆分解的重要微生物,秸秆还田处理可能有利于其在作物根际生长定殖[22–23]。然而,Mesorhizobium(α-变形菌纲)相对丰度的变化趋势与Bradyrhizobium相反。Mesorhizobium偏好碱性环境,在酸性土壤中对养分的竞争力可能会降低,因此其相对丰度在NPKS和NPKSM处理下较低[24–25],而这也是土壤pH 显著影响Mesorhizobium和Paraburkholderia(β-变形菌纲)的相对丰度的原因,在酸性条件下这些偏好碱性的固氮菌类群对土壤pH的变化更为敏感[7,26]。此外,3种秸秆还田处理均增加了Cyanobacteria的相对丰度,其相对丰度与速效钾含量显著正相关。钾离子在细胞代谢过程中起到重要作用,在钾限制条件下会损伤某些蓝细菌的光合色素,同时抑制其光合活性和固氮酶活性[27–28]。
3.3 不同秸秆还田处理下固氮菌群落对花生产量的影响
秸秆还田在影响土壤性质和微生物群落结构的同时,在提升土壤肥力与促进作物增产方面具有重要作用[29]。本研究发现,相比CK和NPK处理,NPKSM处理下花生产量显著增加,NPKS和NPKB处理对花生产量影响不显著。秸秆还田后,微生物在秸秆分解过程中会与作物争夺土壤中的速效氮,而秸秆的速效养分需要在其完全腐解后才能被充分释放出来[30]。猪粪作为重要的有机肥资源,与秸秆配施后能激发秸秆的快速分解,在有效改善土壤物理结构的同时,增加了土壤养分水平和功能微生物活性,显著增强了植物对氮磷的吸收利用,进而提高了作物产量[31–32]。生物质炭的热解温度是影响作物产量的重要因素之一。Ye等[33]基于田间试验的荟萃分析发现,相比不施肥对照,施用400℃以下热解的生物质炭可以使作物增产97.4%,而施用400℃~550℃热解的生物质炭后,其增产效应降低约3倍,施用550℃以上热解制备的生物质炭后产量仅增加18%。本研究发现固氮菌群落组成对花生产量产生负效应,但δ-变形菌纲与花生产量显著正相关。有研究表明,在田间或盆栽条件下,施用化肥或秸秆会降低生物固氮的比例,而投入高C/N值的秸秆在短期内会导致根际微生物与作物竞争土壤的有效养分[34]。如,参与生物固氮的Bradyrhizobium和Mesorhizobium等多为异养菌,外源有机物料的投入为其提供了丰富的能源,增加了这些类群的相对丰度,但其可能会与植物竞争土壤养分,而不通过生物固氮供应植物利用[35]。此外,长期施肥虽然增加了土壤中养分的有效性,但减弱了根际微生物对植物的依赖。有研究表明在土壤氮素充足的条件下固氮植物会减少根瘤的生产,降低固氮的能源成本可以使固氮植物投入更多的能量来获取土壤中的养分元素[36]。Deltaproteobacteria中厌氧黏细菌属和脱硫弧菌属在土壤中氮素增加的情况下可以维持固氮能力,将硝态氮转化为铵态氮供植物吸收利用[37]。因此,秸秆还田提高了根际土壤中Deltaproteobacteria的相对丰度,可能促进了花生产量增加。
4 结论
本研究发现,秸秆还田可以显著改变土壤养分含量,其中以NPKSM处理对土壤肥力和花生产量的提升效果最佳。秸秆还田显著影响了根际固氮菌的多样性及其群落结构,其群落组成分别以Alphaproteobacteria和Bradyrhizobium为优势纲和优势属。有效磷是影响固氮菌多样性的主要因素,而速效钾、全磷、有效磷和pH是影响其群落组成的主要因素。全氮和有效磷可以直接或间接通过改变Deltaproteobacteria的相对丰度对花生产量产生显著的正效应,而群落组成对花生产量产生显著的负效应。上述研究结果为构建秸秆还田的长效管理措施、协同提升生物固氮潜力与红壤健康提供了科学参考。
