慢病毒载体miR-184过表达对前列腺癌细胞PC-3生物学行为的影响
2022-01-25
(1. 右江民族医学院研究生学院,广西 百色 533000;2. 右江民族医学院附属医院,广西 百色 533000)
前列腺癌是男性常见病及多发病,其高发病率和死亡率早已成为全球男性健康的重要问题之一。有数据显示,2018年全球有超过127.6万男性发病,前列腺癌的发病率(13.5%)已越居全球男性癌症发病率第二位[1]。虽然前列腺癌的发展是一个惰性过程,但前列腺癌仍然是男性癌症死亡的第三大原因。
目前临床上,最常用的慢性前列腺癌早期根治治疗方法主要包括手术根治性、非手术放射疗法及内分泌化学治疗,即采用去势性和抵抗性治疗前列腺癌、前列腺癌外放射疗法、前列腺癌近距离疗法,以及生物化学治疗[2]。但是目前的临床治疗仍不能很好地解决这方面的问题,如果能在前列腺癌发病的早期发现并给予及时的治疗将有助于提高患者的生存率,故发现新的诊断和治疗靶点是必不可少的。
已知microRNA是一类小的非编码RNA,由大约22个核苷酸长的非蛋白质编码 RNAs 组成,已在许多生物体中观察到,并通过与部分互补位点的碱基配对参与转录后基因调控,特别是在mRNA的非翻译区[3]。已有研究发现miRNA既能够促使肿瘤细胞生长,又能够控制肿瘤细胞的生长、转移与侵袭[4]。miR-184作为miRNAs家族成员之一,其是新发现的抑癌基因,并且在许多癌症细胞中较低表现,与胃癌、肝癌、乳腺癌等许多恶性肿瘤的出现和进展明显有关,但是却鲜见于前列腺癌组织中的表现及其生物功能的研究。为此,本研究将过表达miR-184慢病毒转染至前列腺癌细胞PC-3,探究其对PC-3细胞生物学行为影响,以期为临床治疗前列腺癌提供新的治疗靶点。
1 材料与方法
1.1材料 人类前列腺癌细胞PC-3(武汉普诺赛公司);无血清培养基RPMI-1640、胎牛血清(美国gibco公司);重组慢病毒LV-has-mir-184及阴性对照组病毒(上海吉凯基因公司);逆转录细胞试剂盒(赛默飞公司);结晶紫染液(北京索莱宝公司);BD matrigel细胞基质胶、Transwell小室(coring公司);miRNA-184引物合成(上海生工);SYBR Green PCR Master Mix(上海翊圣);CCK-8试剂盒、嘌呤霉素(上海碧云天公司)。
1.2细胞培养及慢病毒转染 PC-3细胞采用RPMI-1640培养基,在37 ℃、5% CO2条件下培养。实验结果共分成3组:将LV-has-mir-184和阴性对照组空病毒载体转染至PC-3细胞中,计为过表达慢病毒组(miRNA-184组)和阴性对照组(NC组),未转染任何质粒的PC-3细胞作为空白组(BLANK组)。选取对数生长期PC-3细胞,以每孔8×104个/毫升,取其中2 ml分别接种于6孔板培养,24 h后细胞生长密度至30%左右,更换新的培养基,每孔1 ml,并分别添加1.0×108TU/ml病毒悬液50 μl[感染复数(MOI)=50],以进行转染,把3组细胞放入培养箱中继续培育10 h后,去除6孔板中的孵化液﹐更换新的孵化液,每孔2 ml。然后继续培养至72 h,将转染miRNA-184组和NC组的PC-3细胞加入浓度为2 μg/ml嘌呤霉素完全培养基筛查两周得到了稳定过表达的miRNA-184的PC-3细胞和阴性对照组PC-3细胞,然后使用荧光显微镜观察转染情况,
1.3RNA的提取与miR-184实时定量PCR检测 使用细胞刮刀从6孔板中轻轻刮取3组细胞,参照试剂盒说明书,提取RNA,然后进行逆转录,最后再以逆转录得到的cDNA上机进行扩增,配置好实时定量PCR体系。miR-184 F:CGCTGGACGGAGAACTGAT,miR-184 R:GTGCAGGGTCCGAGGT。实时定量PCR反应条件:95 ℃ 5 min,95 ℃15 s,60 ℃60 s,40个循环,72 ℃,10 min。再将检测到的CT值,采用2-△△Ct法进行分析。内参选择U6,设置3个平行复孔,重复实验3次。
1.4CCK8法检测PC-3细胞增殖水平 将转染慢病毒72 h并使用嘌呤霉素筛选的PC-3细胞消化,以细胞密度为5×103个/毫升接种在96孔板。在37 ℃,5% CO2条件避光培养下,分别在第24 h、48 h、72 h滴加10 ml CCK-8溶液轻轻震荡至均匀后,避光孵育2~4 h,使用酶标仪在450 nm波长处测定吸光度(OD)值。
1.5Transwell检测PC-3细胞侵袭能力 吸取用无血清培养基稀释后浓度为500 mg/ml Matrigel基质胶200 μl铺于各组Transwell小室底部,置于37 ℃培养箱放置4 h。使用无血清培养重悬细胞,取100 ml的各组细胞悬液(约2×104个细胞)添加在Transwell上室内,在下室中再添加600 μl含10%胎牛血清的培养基,将Transwell板继续培养24 h。后以4%的多聚甲醛固定小室滤膜约15 min。以结晶紫洗染滤层,15 min后用PBS溶液洗两遍,以棉签拭去剩余水,放置于显微镜下观察各组透过滤层侵袭的细胞,拍照以及统计各组PC-3细胞侵袭个数。每组细胞设置了3个复孔,并进行3次重复试验。
1.6细胞划痕实验检测PC-3细胞迁移能力 收取PC-3细胞,以每孔4×105个细胞接种在6孔板,在37 ℃,5%CO2条件培养下直至细胞生长铺满整个孔板,然后在6孔板底部表面均匀作3条细长的横线画,采用高压灭菌后的100 μ枪头垂直于6孔板底部表面横线画下划痕,每孔划3道,接着吸出培养基再以pbs缓冲液轻轻反复清洗2~3遍以去除枪头划下的细胞碎片,加入含有2%胎牛血清培养基培养72 h后在显微镜下观察细胞拍照,使用Image J软件进行分析,计算闭合率。

2 结果
2.1细胞转染情况 如图1、图2所示,用含有GFP荧光蛋白的miRNA-184慢病毒转染人前列腺癌PC-3细胞72 h后,再于荧光显微镜下拍照并观测慢病毒转染效果,观测到过表达组和阴性对照组镜下均可见明显绿色荧光,慢病毒转染的效果在80%以上。

A:明视野,B:荧光视野。
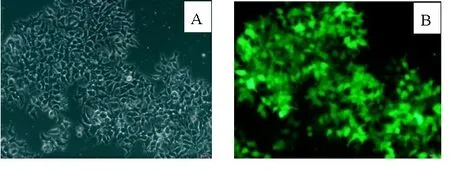
A:明视野,B:荧光视野。
2.2miR-184相对表达量测定结果 实时逆转录PCR后结果显示,与空白组相比较,miR-184组PC-3细胞中miR-184的相对表达量显著升高,差异有统计学意义(P<0.001)。阴性对照组与空白组miR-184的相对表达量差异无统计学意义(P>0.05),提示转染成功,结果见图3、表1。
2.3miR-184对PC-3细胞增殖的影响 阴性对照组与空白组细胞正常繁殖生长能力差异无统计学意义(P>0.05);和阴性对照组与空白组进行比较,miR-184组PC-3细胞繁殖能力在24 h、48 h、72 h均明显下降(P<0.001),见图4、表2。
2.4miR-184对于PC-3细胞侵袭能力的影响 Transwell小室实验检测PC-3细胞侵袭能力结果显示,miR-184组肿瘤细胞穿膜细胞数明显小于阴性对照组和空白组,差异有统计学意义(P<0.001),而阴性对照组与空白组穿膜细胞数差异无统计学意义(P>0.05),见图5、表3。
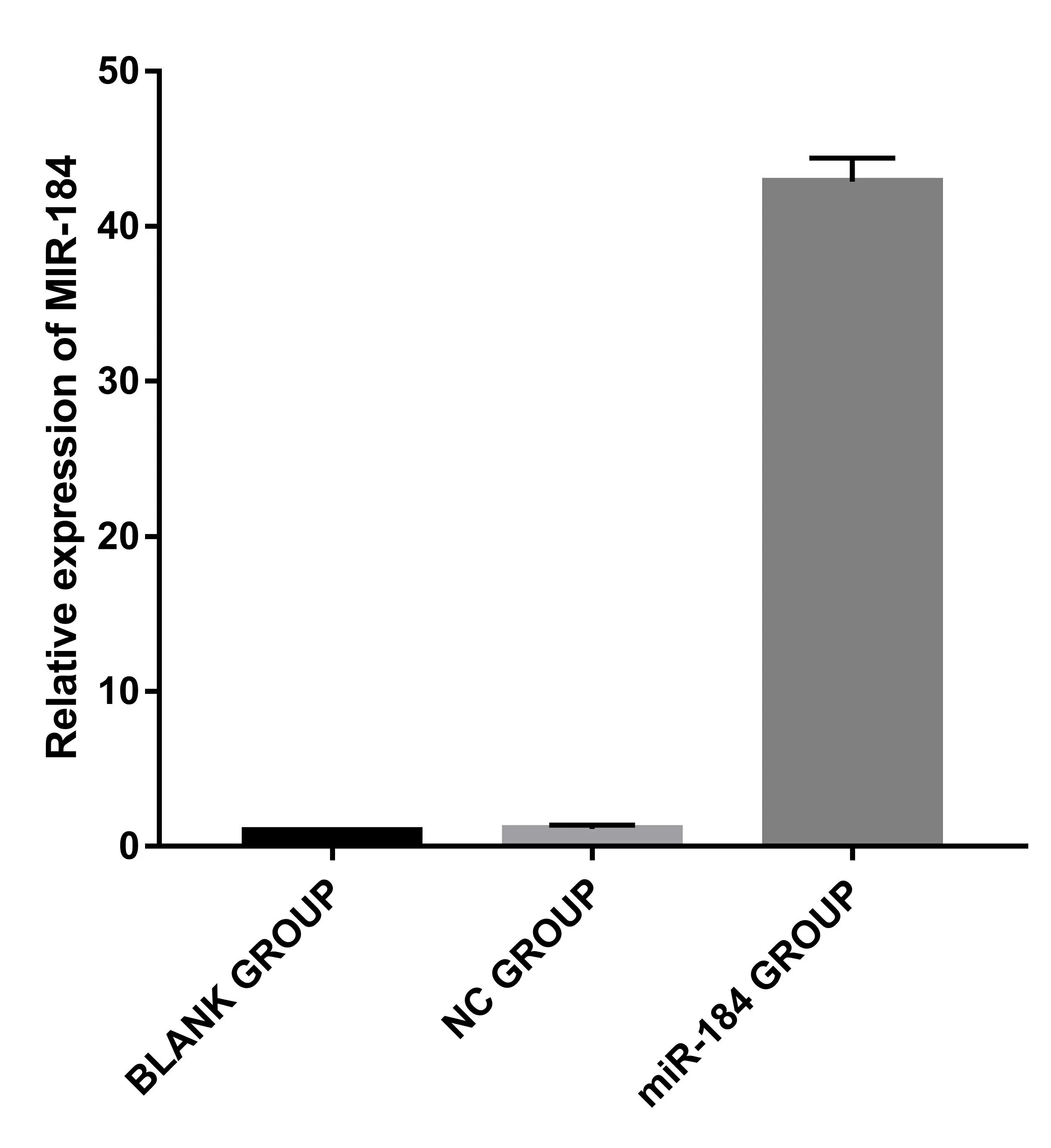
图3 各组细胞中miR-184相对表达量比较
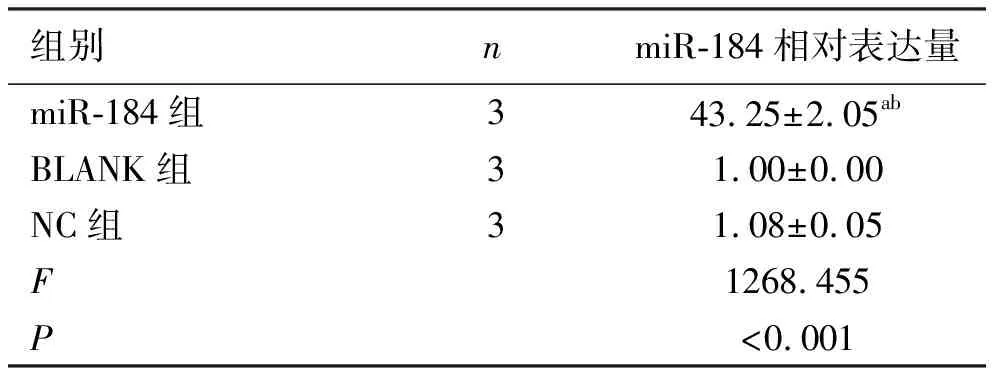
表1 RT-qPCR检测各组细胞miR-184的表达情况
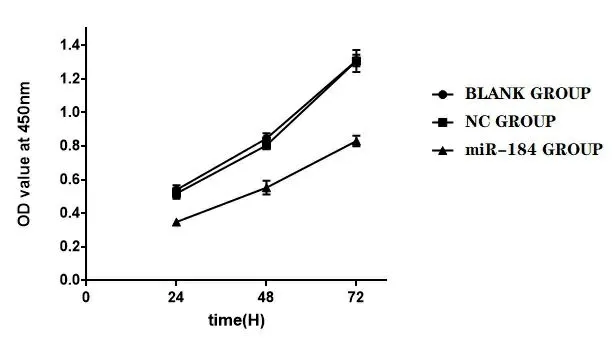
图4 转染不同时间后各组细胞OD值比较
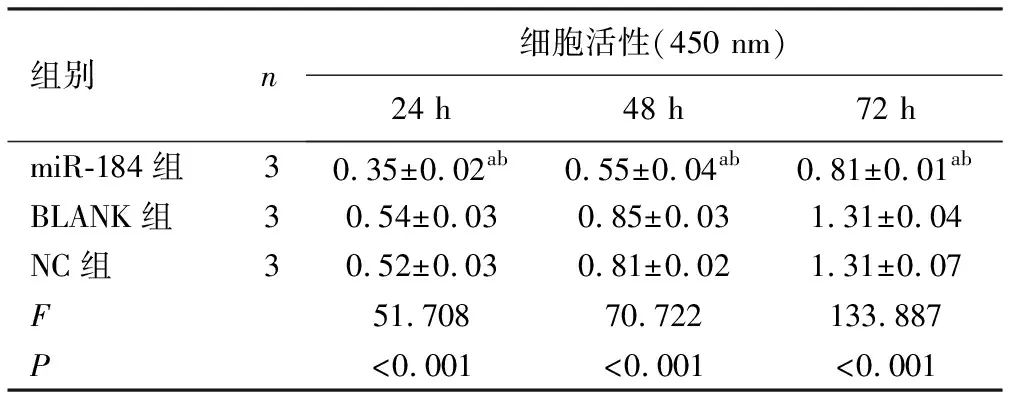
表2 CCK-8法检测各组PC-3细胞增殖的结果

图5 Transwell侵袭实验各组细胞显微镜观察图(×200)
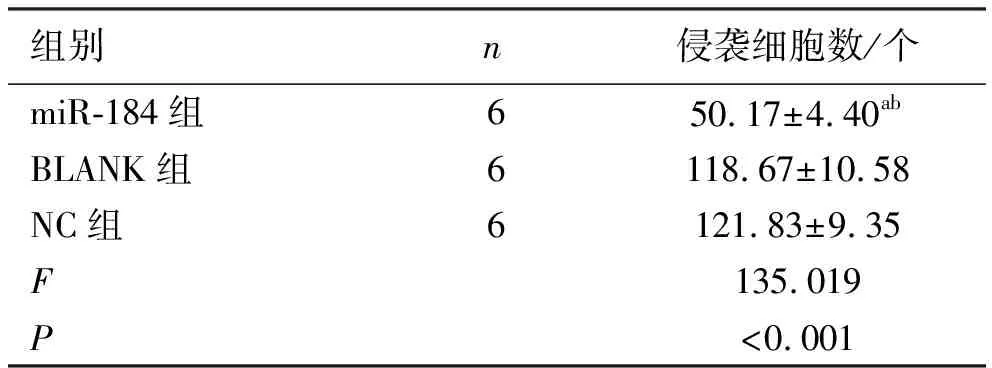
表3 Transwell检测各组PC-3细胞侵袭的结果
2.5miR-184对于PC-3细胞迁移能力的影响 miR-184组肿瘤细胞的闭合率明显小于阴性对照组和空白组,差异有统计学意义(P<0.001),而阴性对照组与空白组闭合率差异无统计学意义(P>0.05),结果见图6、表4。

图6 各组细胞划痕愈合率结果

表4 3组细胞愈合率百分比结果
3 讨论
前列腺癌是泌尿外科常见的恶性肿瘤之一,随着磁共振和功能成像的进步,以及血清前列腺特异性抗原( PSA)筛查普及,前列腺癌的发病率逐年升高,PSA 是筛查和诊断前列腺癌的金标准测试。然而,患有良性前列腺增生或前列腺炎症的男性的PSA水平也会升高。并且许多PSA水平升高的男性经历了不必要的前列腺活检,这会带来显著的发病率,所以开发更加特异的生物标志物十分迫切。
目前临床研究已经充分证实,miRNAs多种癌细胞中充当着癌基因和抑癌基因的角色,并在各种类型癌症基因检测、预后和癌症诊断治疗过程中对其起到了关键性指导意义。与正常细胞相比,由于某些miRNA在肿瘤组织及细胞中呈现高表达,因此这些miRNA有很大可能被作为一些癌症新的诊断生物化学标志物[5]。在肿瘤发生过程中,自由循环的miRNAs的含量发生变化,可以反映肿瘤的情况[6]。循环中的 miRNA 被牢固地堆积并在体液中保持相当稳定[7],这为作为检测疾病特异性变化的非侵入性工具提供了可能性。尿液、血清和前列腺组织中的miRNA已经成为前列腺癌诊断和分期的潜在生物标志物[8-9]。另外,Selth LA等[10]研究了从前列腺癌患者的精液中分离出的miRNA,发现一系列候选miRNA (miR-200b、miR-200c、miR-30a、miR-375和 miR-99a)是比血清PSA更好的诊断工具。多项研究表明,miRNA可作为前列腺的诊断或治疗靶点。Bhagirath D等[11]则特别指出,外泌体中的miR-1246的表达水平和前列腺癌的早期病理化学分级鉴定﹑放射阳性细胞转移以及不良者的预后情况有关,并且被用作前列腺癌早期检查的重要标志物。最近,Wang YT等[12]发现miR-1231可能通过靶向EGFR影响前列腺癌细胞的增殖、迁移和侵袭,多表达的miR-1231在体外抑制前列腺癌细胞增殖、迁移和侵袭,此外,miR-1231下调表达与晚期临床分期和转移显著相关。另外,Li Q等[13]分析了在前列腺癌组织和前列腺癌细胞中的miRNA-33a表达上调后,过表达的miRNA-33a通过直接和相应mRNA的3′非翻译区段相结合,进行靶向控制Engrailed2基因表达,进而有效控制了前列腺癌细胞的生长与转移。Gong PJ等[14]研究发现miRNA-145可介导DNA修复调节参与放疗反应,当上调前列腺癌细胞中miRNA-145表达水平使得前列腺细胞对放疗的敏感性增强。
miR-184是近年来发现的肿瘤相关的miRNA,可通过调节各种靶向基因实现其生物功能,参与了骨肉瘤、肝癌、胃癌、肾癌等各类肿瘤的发生发展。抑制舌鳞状细胞癌细胞中的miR-184可减少细胞增殖并诱导细胞凋亡[15]。其他学者也证明miR-184在神经母细胞瘤中具有肿瘤抑制作用,miR-184通过靶向AKT2抑制神经母细胞瘤细胞存活并促进细胞凋亡[16]。此外,miR-184在人HCC细胞系和组织中上调,它在 HCC中转录后调节SOX7表达并促进细胞增殖[17]。miR-184在不同肿瘤中具有多种作用机制,表明组织特异性。总之,这些研究表明miR-184在调节肿瘤进展中的可能作用,miRNA-184正是通过调控这些靶基因的活动,并进而影响各种癌症的发生、发展和转移。
为了阐明 miR-184 是否可以作为肿瘤抑制因子,在体外评估了 miR-184 过表达的影响。首先,本试验通过将介导上调miR-184慢病毒稳定转染进前列腺癌PC-3细胞,通过荧光显微镜观察转染后的细胞发现绿色荧光效率在80%以上,并通过实时定量PCR检测发现过表达组中 miR-184的相对表达量的阴性对照组和空白组的40倍以上,提示转染成功,说明miR-184上调效果良好。肿瘤细胞的无限制增殖及细胞周期的失调是肿瘤发生发展的主要机制。后续,我们进行了细胞活力测定以研究 miR-184 在癌细胞增殖中是否具有生物学功能,我们的CCK-8增殖实验提示miR-184表达上调后的PC-3细胞生长缓慢,在第24 h、48 h、72 h的细胞增殖数均低于阴性对照组和空白组,并通过生长曲线发现在孵育第72 h时过表达组细胞的增殖速率明显低于阴性对照组和空白组。这证实了稳定上调miR-184具有抑制前列腺癌PC-3细胞生长的作用。肿瘤转移是前列腺癌患者的主要死亡因素,肿瘤细胞的转移是多种细胞机制参与的过程,其中包括细胞程序性死亡发生异常,肿瘤细胞的炎性微环境改变,细胞外基质被降解,上皮-间质转化以及肿瘤血管生长。为进一步研究上调miR-184对PC-3细胞侵袭和迁移能力的影响,我们进行了Transwell小室实验和划痕试验,以确定前列腺癌PC-3细胞的侵袭和迁移能力。实验结果显示,miR-184表达上调后的PC-3细胞运动性显著降低,上调miR-184后的PC-3细胞的侵袭和迁移细胞较阴性对照组和空白组减少,它提供了证据表明 miR-184确实抑制细胞运动,进一步说明miR-184在晚期前列腺癌转移中起着负向调控作用。Su Z等[18]经过试验研究,发现上调人类肾癌细胞系中的miR-184显著地抑制了细胞生长与迁移以及诱发细胞凋亡,与本实验研究结果一致,证明了miR-184可以在肿瘤中作为抑癌因子。我们的实验研究显示miR-184可能在前列腺癌中作为一种抑癌基因调控前列腺癌PC-3细胞增殖、侵袭和迁移。
综上所述,前列腺癌作为亟待解决的重大难题,本研究通过从miRNA入手发现miR-184表达上升在前列腺癌PC-3细胞系中显著抑制细胞增殖、侵袭和迁移,并在前列腺癌中发挥重要作用。但是,miR-184是通过何种途径改变细胞生物学行为的?仍不得而知,故仍需进一步研究。
